Tanulási célok
- Meghatározza a kovalens kötés fogalmát.
- A kovalens kötés kialakulását Lewis elektronpontdiagramokkal szemlélteti.
Ionkötés jellemzően akkor jön létre, ha az egyik atom könnyen veszít egy vagy több elektront, egy másik atom pedig könnyen nyer egy vagy több elektront. Egyes atomok azonban nem adnak le vagy nyernek elektronokat könnyen. Mégis részt vesznek a vegyületképzésben. Hogyan? Van egy másik mechanizmus is a teljes valenciahéj elérésére: az elektronok megosztása. Amikor két atom között elektronokat osztanak meg, akkor egy kovalens kötésnek nevezett kötést hoznak létre.
A kovalens kötést H-atomok segítségével szemléltetjük, azzal, hogy a H-atomoknak csak két elektronra van szükségük az 1s alhéj kitöltéséhez. Minden H atom egyetlen elektronnal indul a valenciahéjában:
\
A két H atom megoszthatja elektronjait:
\
Körökkel mutathatjuk be, hogy minden H atomnak két elektronja van az atommag körül, ami teljesen kitölti mindkét atom valenciahéját:
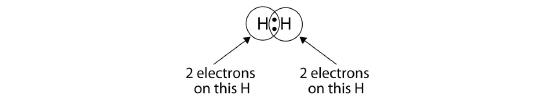
Miatt, hogy minden H atomnak kitöltött valenciahéja van, ez a kötés stabil, és egy kétatomos hidrogénmolekulát hoztunk létre. (Ez megmagyarázza, hogy a hidrogén miért tartozik a kétatomos elemek közé.) Az egyszerűség kedvéért nem szokatlan, hogy a kovalens kötést két pont helyett egy kötőjellel ábrázoljuk:
H-H
Mert mivel két atom osztozik egy elektronpáron, ezt a kovalens kötést egyszerű kötésnek nevezzük. Egy másik példaként tekintsük a fluort. Az F atomoknak hét elektron van a valenciahéjukban:
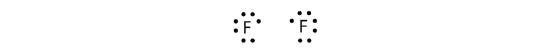
Ez a két atom ugyanazt tudja csinálni, mint a H atomok; megosztják a párosítatlan elektronjaikat, hogy kovalens kötést hozzanak létre.

Megjegyezzük, hogy most már minden F atom körül egy teljes nyolcad van:
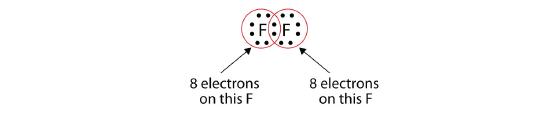
Azt is leírhatjuk, hogy a megosztott elektronpárt kötőjellel jelöljük:
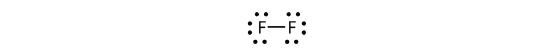
A fluor kétatomos molekulában két különböző típusú elektron van. A kötő elektronpár alkotja a kovalens kötést. Minden F atomnak van három másik elektronpárja, amelyek nem vesznek részt a kötésben; ezeket magányos elektronpárnak nevezzük. Minden F atomnak van egy kötő és három magányos elektronpárja.
Kovalens kötések különböző elemek között is létrejöhetnek. Egy példa erre a HF. Mindkét atom páratlan számú elektronnal indul a valenciahéjában:
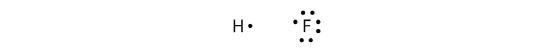
A két atom megoszthatja a párosítatlan elektronjait, így kovalens kötés jön létre:
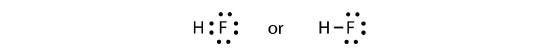
Megjegyezzük, hogy a H atomnak teljes valenciahéja van két elektronnal, míg az F atomnak teljes nyolcas számú elektronja van.
Példa \(\PageIndex{1}\):
A Lewis elektronpontdiagramok segítségével szemléltessük a kovalens kötés kialakulását a HBr-ban.
Solution
A HBr nagyon hasonló a HF-hez, kivéve, hogy F helyett Br van benne. Az atomok a következők:

A két atom megoszthatja a párosítatlan elektronját:
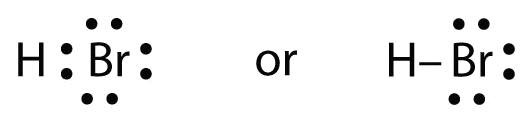
gyakorlat \(\PageIndex{1}\)
A Lewis elektronpontdiagramok segítségével szemléltesse a kovalens kötés kialakulását a Cl2-ben.
Válasz:
A Lewis elektronpontdiagramok segítségével szemléltesse a kovalens kötés kialakulását a Cl2-ben: 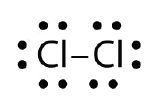
A kovalens szerkezetekkel való munka során néha úgy tűnik, mintha maradványelektronok lennének. Alkalmazod az eddig tanult szabályokat, és még mindig lóg néhány elektron kötés nélkül. Nem hagyhatod csak úgy ott őket. Akkor hová teszed őket?
Sokszoros kovalens kötések
Néhány molekula nem képes megfelelni a nyolcadszabálynak azzal, hogy csak egyetlen kovalens kötést hoz létre az atomok között. Tekintsük az etén vegyületet, amelynek molekuláris képlete \(\ce{C_2H_4}\). A szénatomok úgy kapcsolódnak egymáshoz, hogy minden szénatom két hidrogénatomhoz is kötődik.
két \(\ce{C}\) atom \(= 2 \szer 4 = 8\) valenciaelektron
négy \(\ce{H}\) atom \(= 4 \szer 1 = 4\) valenciaelektron
összesen 12 db. valenciaelektronok a molekulában
Ha a Lewis elektron pontszerkezetet úgy rajzoltuk meg, hogy a szénatomok között egyetlen kötés van, és a nyolcados szabályt követjük, így nézne ki:

Ez a Lewis-szerkezet helytelen, mert összesen 14 elektront tartalmaz. A Lewis-szerkezet azonban megváltoztatható a szénatomok magányos párjainak kiküszöbölésével, és az egy pár helyett két párt kell megosztaniuk.
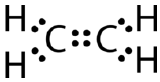
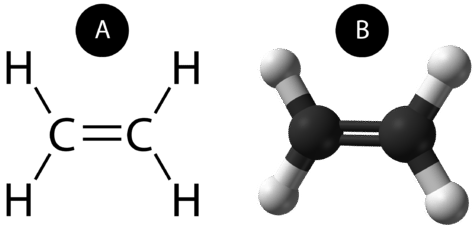
A kettős kovalens kötés olyan kovalens kötés, amelyet két elektronpáron osztozó atomok alkotnak. Az etán két szénatomja között létrejövő kettős kovalens kötés szerkezeti képlettel és molekulamodellel is ábrázolható az alábbi ábrán látható módon.
A hármas kovalens kötés olyan kovalens kötés, amelyet három elektronpáron osztozó atomok alkotnak. A nitrogén egy olyan gáz, amely a Föld légkörének nagy részét alkotja. A nitrogénatomnak öt valenciaelektronja van, amelyek egy pár és három egyszerű elektronként ábrázolhatók. Amikor egy másik nitrogénatomhoz csatlakozva kétatomos molekulát alkot, az egyes atomok három egyes elektronja három közös elektronpárrá egyesül.
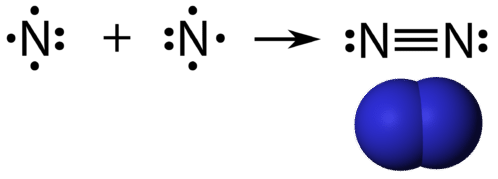
Minden nitrogénatom a nyolcas szabályt követi egy magányos elektronpárral és hat, az atomok között megosztott elektronnal.
Összefoglaló
- Kovalens kötések akkor jönnek létre, amikor az atomok megosztják az elektronokat.
- A kovalens kötés kialakulásának szemléltetésére Lewis-féle elektronpontdiagramok rajzolhatók.
- Az egyes molekulák kötéseinek megfelelő szemléltetéséhez szükség lehet az atomok közötti kettős vagy hármas kötésekre.
Megosztók és hozzászólások
-
CK-12 Alapítvány: Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson és Jean Dupon.
- Névtelen
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)