6.9 Pourquoi les objets absorbent-ils comme ils le font ?
L’atmosphère absorbe une quantité importante de rayonnement dans l’infrarouge mais assez peu dans le visible. De plus, on constate que les gaz absorbent fortement à certaines longueurs d’onde et pas à d’autres. Pourquoi en est-il ainsi ?
Pour répondre à cette question, nous devons examiner les configurations des électrons qui s’agitent autour des atomes et des molécules. Il y a plus de 100 ans, les scientifiques ont commencé à utiliser des prismes pour disperser la lumière du soleil et des flammes contenant différents éléments. Alors que le soleil donnait les couleurs de l’arc-en-ciel, la lumière des flammes se présentait sous forme de lignes ou de bandes très distinctes. Cette énigme a finalement été résolue il y a un peu plus de 100 ans avec l’invention de la mécanique quantique, qui dit essentiellement que les électrons qui zooment autour des atomes et des molécules et les vibrations et rotations des molécules ne peuvent avoir que des énergies discrètes qui sont régies par des règles de conservation du moment angulaire.

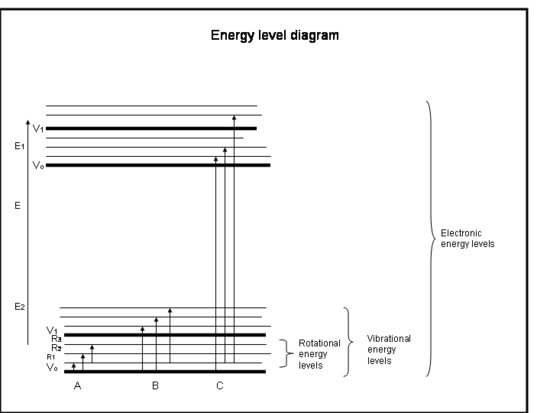
La liste à puces suivante est un cours accéléré sur l’absorption par les électrons dans les atomes et les molécules. Référez-vous à la figure sous l’encadré.
Cours accéléré : Absorption par les électrons dans les atomes et les molécules
- Les liaisons chimiques et la mécanique quantique déterminent ensemble les niveaux d’énergie dans lesquels tout électron, atome ou molécule peut se trouver.
- L’énergie d’une molécule est la somme de l’énergie liée à la position des électrons par rapport à leurs états électroniques stables au sol, de la vibration moléculaire et de la rotation moléculaire.
- L’absorption se produit lorsque l’énergie du photon correspond à la différence entre deux niveaux d’énergie dans une molécule, ΔE = Efinal – Einitial = hc/λ.
- Les règles établies par la conservation du moment angulaire et du spin de l’électron déterminent quelles transitions entre les niveaux d’énergie sont permises.
- La quantité d’absorption, appelée simplement section transversale d’absorption, σ, provient de nombreux facteurs, mais varie considérablement d’une molécule à l’autre et d’une transition à l’autre. La section transversale a des dimensions d’aire et a communément des unités de cm2.
- Les transitions électroniques se produisent lorsque les électrons sautent réellement dans d’autres orbites autour des noyaux. Elles ont des énergies qui sont équivalentes à un rayonnement (c’est-à-dire des photons) dans les longueurs d’onde de l’ultraviolet au visible.
- Les transitions vibrationnelles se produisent lorsque la molécule vibre à une fréquence différente ou d’une manière différente. Les molécules diatomiques (par exemple, O2 et N2) n’ont qu’une seule façon de vibrer, d’avant en arrière le long de la liaison chimique qui les lie. Mais les molécules plus complexes (par exemple, H2O et CO2) peuvent vibrer non seulement avec les noyaux qui se rapprochent et s’éloignent les uns des autres, mais aussi en se courbant dans trois directions. Ces transitions vibratoires, accompagnées de mouvements qui combinent vibration et rotation, ont des énergies équivalentes au rayonnement infrarouge proche et moyen (c’est-à-dire aux photons).
- Les transitions rotationnelles se produisent lorsqu’une molécule change sa vitesse de rotation. Ces transitions ont des énergies équivalentes au rayonnement (c’est-à-dire, photons) dans l’infrarouge lointain aux longueurs d’onde des ondes radio.
- Les énergies translationnelles des molécules dans l’atmosphère terrestre, ~kT, sont généralement un peu plus grandes que l’énergie nécessaire pour passer d’un niveau de rotation à un autre, 10 à 100 fois moins que l’énergie nécessaire pour passer d’un niveau vibratoire à un autre, et des centaines à des milliers de fois moins que ce qui est nécessaire pour passer d’un niveau électronique à un autre.
- Nous avons déjà vu que certaines molécules et certains atomes ont plus d’énergie cinétique que d’autres. Toutes les molécules ayant une énergie cinétique supérieure à la différence d’énergie entre les niveaux de rotation peuvent entrer en collision avec la molécule et lui donner suffisamment d’énergie de rotation pour passer à un niveau de rotation supérieur. Ainsi, nous voyons que l’énergie de rotation est distribuée sur de nombreux niveaux de rotation, mais que les niveaux vibrationnels et électroniques sont généralement les niveaux de base (énergie la plus basse).
- Les atomes n’ont pas de vibrations et de rotations semblables à celles des molécules parce qu’ils n’ont qu’un seul noyau, de sorte que leurs spectres ne sont constitués que de transitions électroniques.
- Une transition nette d’un niveau discret à un autre, qui apparaît comme une ligne dans un spectre, se produit dans une gamme étroite d’énergies autour de la différence d’énergie de transition. Le rayonnement qui en résulte se produit dans une bande étroite de longueurs d’onde autour de la longueur d’onde centrale de la ligne. La largeur de cette raie (mesurée à la moitié de la hauteur maximale de la raie) est appelée largeur de raie.
- Cette largeur de raie naturelle peut être élargie par le mouvement de la molécule, appelé élargissement Doppler, ou par des collisions, appelé élargissement par pression.
- Haut dans l’atmosphère, l’élargissement Doppler est dominant car la pression est faible, mais plus bas dans l’atmosphère, l’élargissement par pression devient dominant même si l’élargissement Doppler augmente également. Les lignes d’absorption sont donc plus larges près de la surface de la Terre qu’elles ne le sont plus haut dans l’atmosphère.
La section transversale d’absorption, σ, varie considérablement sur la largeur de la ligne d’absorption. Il est donc possible que tout le rayonnement soit absorbé au milieu de la ligne mais que très peu soit absorbé dans les « ailes ».
Interprétation physique
Les atomes et les molécules peuvent absorber un rayonnement (un photon) uniquement si leur structure présente une différence d’énergie entre les niveaux qui correspond à l’énergie du photon (hc/λ). Sinon, l’atome ou la molécule n’absorbera pas la lumière. Une fois que la molécule a absorbé le photon, elle peut soit perdre un photon et retourner à son niveau d’énergie inférieur d’origine, soit se briser si l’énergie du photon est supérieure à la liaison chimique qui maintient la molécule ensemble, soit entrer en collision avec d’autres molécules, comme N2 ou O2, et leur transférer de l’énergie pendant qu’elle retourne à son niveau d’énergie inférieur. Les collisions se produisent souvent, de sorte que l’énergie du photon absorbé est souvent transférée en énergie thermique.
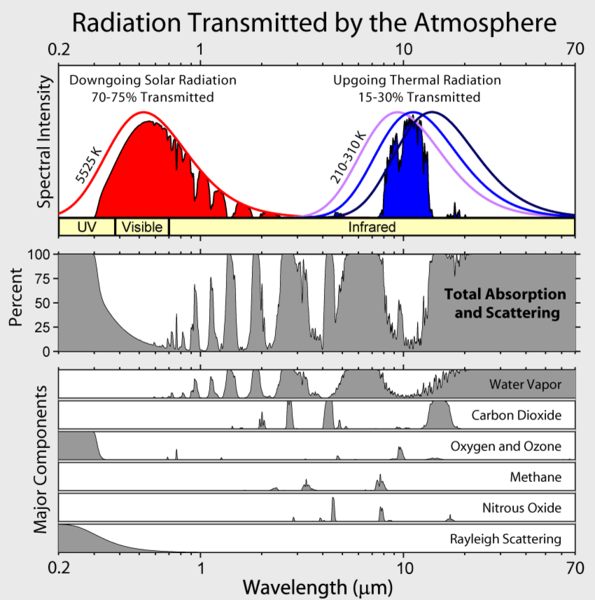
Notez que l’irradiance infrarouge sortante de la Terre est limitée à quelques « fenêtres » atmosphériques et que l’irradiance à toutes les autres longueurs d’onde est fortement absorbée, principalement par la vapeur d’eau, mais aussi par le dioxyde de carbone, l’ozone, l’oxyde nitreux, le méthane et d’autres gaz plus traces qui ne sont pas représentés dans la figure ci-dessus.