Objectifs d’apprentissage
- Définir la liaison covalente.
- Illustrer la formation de la liaison covalente avec les diagrammes de points électroniques de Lewis.
La liaison ionique se produit généralement lorsqu’il est facile pour un atome de perdre un ou plusieurs électrons et pour un autre atome de gagner un ou plusieurs électrons. Cependant, certains atomes ne cèdent ou ne gagnent pas facilement des électrons. Pourtant, ils participent quand même à la formation des composés. Comment ? Il existe un autre mécanisme pour obtenir une coquille de valence complète : le partage des électrons. Lorsque des électrons sont partagés entre deux atomes, ils forment une liaison appelée liaison covalente.
Illustrons une liaison covalente en utilisant des atomes H, étant entendu que les atomes H n’ont besoin que de deux électrons pour remplir la sous-coquille 1s. Chaque atome H commence avec un seul électron dans sa coquille de valence:
\
Les deux atomes H peuvent partager leurs électrons:
Nous pouvons utiliser des cercles pour montrer que chaque atome H a deux électrons autour du noyau, remplissant complètement la coquille de valence de chaque atome :
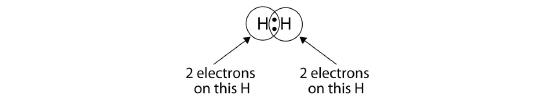
Parce que chaque atome H a une coquille de valence remplie, cette liaison est stable, et nous avons fait une molécule d’hydrogène diatomique. (Ceci explique pourquoi l’hydrogène est l’un des éléments diatomiques.) Pour des raisons de simplicité, il n’est pas inhabituel de représenter la liaison covalente par un tiret, plutôt que par deux points :
H-H
Parce que deux atomes partagent une paire d’électrons, cette liaison covalente est appelée liaison simple. Comme autre exemple, considérons le fluor. Les atomes de F ont sept électrons dans leur coquille de valence:
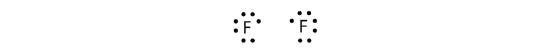
Ces deux atomes peuvent faire la même chose que les atomes de H ; ils partagent leurs électrons non appariés pour faire une liaison covalente.

Notez que chaque atome de F a un octuor complet autour de lui maintenant:
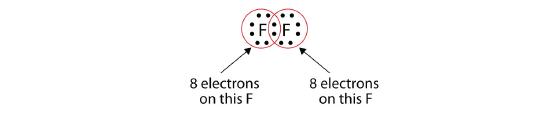
Nous pouvons également écrire ceci en utilisant un tiret pour représenter la paire d’électrons partagée:
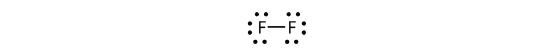
Il y a deux types d’électrons différents dans la molécule diatomique de fluor. La paire d’électrons de liaison réalise la liaison covalente. Chaque atome de F possède trois autres paires d’électrons qui ne participent pas à la liaison ; ils sont appelés électrons solitaires. Chaque atome de F possède une paire de liaison et trois paires d’électrons solitaires.
Des liaisons covalentes peuvent également être établies entre différents éléments. Un exemple est le HF. Chaque atome commence avec un nombre impair d’électrons dans sa coquille de valence:
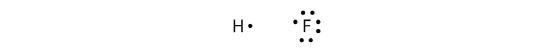
Les deux atomes peuvent partager leurs électrons non appariés pour faire une liaison covalente:
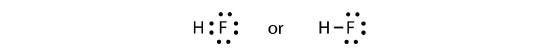
Nous remarquons que l’atome H a une coquille de valence complète avec deux électrons, tandis que l’atome F a un octuor complet d’électrons.
Exemple \(\PageIndex{1}\):
Utilisez les diagrammes de Lewis à points électroniques pour illustrer la formation d’une liaison covalente dans HBr.
Solution
HBr est très similaire à HF, sauf qu’il a Br au lieu de F. Les atomes sont les suivants :

Les deux atomes peuvent partager leur électron non apparié :
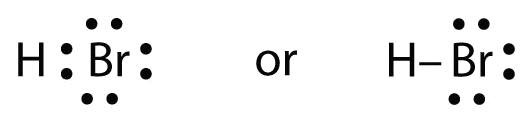
Exercice \(\PageIndex{1}\)
Utiliser les diagrammes de Lewis à points électroniques pour illustrer la formation d’une liaison covalente dans Cl2.
Réponse : 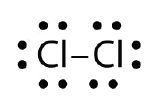
Lorsque vous travaillez avec des structures covalentes, il semble parfois que vous ayez des électrons restants. Vous appliquez les règles que vous avez apprises jusqu’à présent et il y a encore quelques électrons qui traînent là sans être attachés. Vous ne pouvez pas simplement les laisser là. Alors où les mettez-vous ?
Les liaisons covalentes multiples
Certaines molécules ne sont pas capables de satisfaire la règle de l’octuor en ne faisant que des liaisons covalentes simples entre les atomes. Prenons l’exemple du composé éthène, dont la formule moléculaire est \(\ce{C_2H_4}\). Les atomes de carbone sont liés entre eux, chaque carbone étant également lié à deux atomes d’hydrogène.
deux atomes \(\ce{C}\) \(= 2 \times 4 = 8\) électrons de valence
quatre atomes \(\ce{H}\) \(= 4 \times 1 = 4\) électrons de valence
total de 12 électrons de valence dans la molécule
Si la structure électronique de Lewis était dessinée avec une liaison simple entre les atomes de carbone et en suivant la règle de l’octuplet, elle ressemblerait à ceci :

Cette structure de Lewis est incorrecte car elle contient un total de 14 électrons. Cependant, la structure de Lewis peut être modifiée en éliminant les paires solitaires sur les atomes de carbone et en devant partager deux paires au lieu d’une seule.
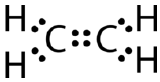
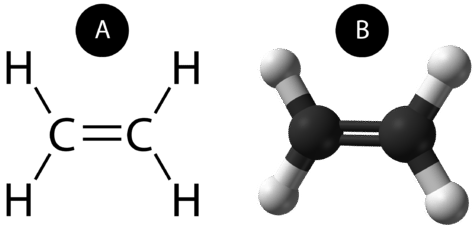
Une double liaison covalente est une liaison covalente formée par des atomes qui partagent deux paires d’électrons. La double liaison covalente qui se produit entre les deux atomes de carbone dans l’éthane peut également être représentée par une formule structurelle et avec un modèle moléculaire comme le montre la figure ci-dessous.
Une triple liaison covalente est une liaison covalente formée par des atomes qui partagent trois paires d’électrons. L’élément azote est un gaz qui compose la majorité de l’atmosphère terrestre. Un atome d’azote possède cinq électrons de valence, qui peuvent être représentés par une paire et trois électrons simples. Lorsqu’il se combine avec un autre atome d’azote pour former une molécule diatomique, les trois électrons célibataires de chaque atome se combinent pour former trois paires d’électrons partagées.
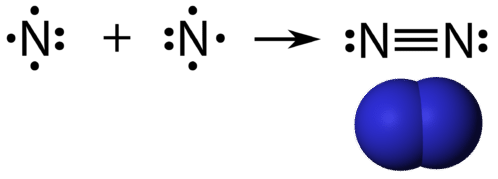
Chaque atome d’azote suit la règle de l’octet avec une paire d’électrons solitaires et six électrons qui sont partagés entre les atomes.
Résumé
- Des liaisons covalentes sont formées lorsque les atomes partagent des électrons.
- Des diagrammes de points électroniques de Lewis peuvent être dessinés pour illustrer la formation de liaisons covalentes.
- Des liaisons doubles ou triples entre atomes peuvent être nécessaires pour illustrer correctement la liaison dans certaines molécules.
Contributeurs et attributions
-
Fondation du CK-12 par Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson et Jean Dupon.
- Anonymat
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)
.