6.9 Miksi esineet absorboivat niin kuin ne absorboivat?
Amosfääri absorboi huomattavan määrän säteilyä infrapunassa, mutta melko vähän näkyvässä spektrissä. Lisäksi näemme, että kaasut absorboivat voimakkaasti joillakin aallonpituuksilla ja toisilla ei. Miksi näin on?
Vastaaksemme tähän kysymykseen meidän on tarkasteltava atomien ja molekyylien ympärillä liikkuvien elektronien konfiguraatioita. Yli 100 vuotta sitten tutkijat alkoivat käyttää prismoja hajottaakseen auringon ja eri alkuaineita sisältävien liekkien valoa. Auringosta saatiin sateenkaaren värit, mutta liekeissä valo oli hyvin selvinä viivoina tai kaistoina. Tämä arvoitus ratkaistiin lopulta hieman yli 100 vuotta sitten, kun keksittiin kvanttimekaniikka, jonka mukaan atomien ja molekyylien ympärillä pyörivillä elektroneilla sekä molekyylien värähtelyillä ja pyörimisliikkeillä voi olla vain diskreettejä energioita, joita säätelevät kulmamomentin säilymissäännöt.

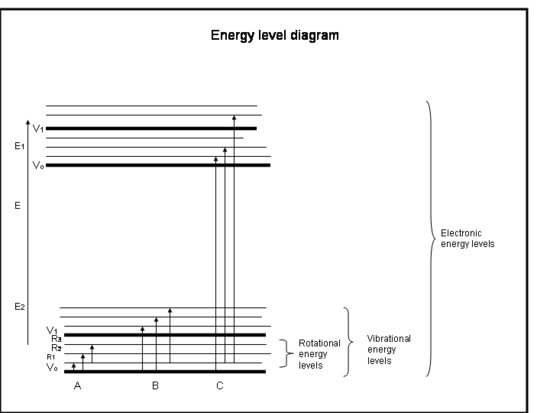
Seuraavasta luettelopalstasta saat pikakurssin atomeissa ja molekyyleissä esiintyvistä elektroneista johtuvasta absorptiosta. Katso laatikon alla olevaa kuvaa.
Yrmäiskurssi: Absorptio elektronien toimesta atomeissa ja molekyyleissä
- Kemialliset sidokset ja kvanttimekaniikka yhdessä määrittelevät energiatasot, joilla mikä tahansa elektroni, atomi tai molekyyli voi olla.
- Molekyylin energia on summa energiasta, joka liittyy elektronien sijaintiin suhteessa niiden stabiileihin elektronisiin perustiloihin, molekyylin värähtelyyn ja molekyylin kiertoon.
- Absorptio tapahtuu, kun fotonin energia vastaa molekyylin kahden energiatason välistä eroa, ΔE = Efinal – Einitial = hc/λ.
- Kulmavauhdin ja elektronin spinin säilymisen asettamat säännöt määräävät, mitkä siirtymät energiatasojen välillä ovat sallittuja.
- Absorption määrä, jota kutsutaan yksinkertaisesti absorptioristipoikkileikkaukseksi, σ, syntyy monien tekijöiden vaikutuksesta, mutta se vaihtelee merkittävästi molekyyleittäin ja siirtymästä toiseen. Poikkileikkauksella on pinta-alan mitat, ja sen yksiköt ovat yleisesti cm2.
- Elektroniset siirtymät tapahtuvat, kun elektronit todella hyppäävät toisille radoille ytimien ympärille. Niiden energiat vastaavat säteilyä (eli fotoneja) ultravioletin ja näkyvän aallonpituuden välillä.
- Värähtelysiirtymät tapahtuvat, kun molekyyli värähtelee eri taajuudella tai eri tavalla. Kaksiatomisilla molekyyleillä (esim. O2:lla ja N2:lla) on vain yksi tapa värähtää – edestakaisin niitä sitovaa kemiallista sidosta pitkin. Mutta monimutkaisemmat molekyylit (esim. H2O ja CO2) voivat värähtää paitsi siten, että ytimet kulkevat toisiaan kohti ja toisistaan poispäin, myös siten, että ne taipuvat kolmeen suuntaan. Näillä värähtelysiirtymillä, joihin liittyy värähtelyä ja pyörimistä yhdistäviä liikkeitä, on lähi- ja keski-infrapunasäteilyä (eli fotoneja) vastaavat energiat.
- Rotaatiosiirtymiä tapahtuu, kun molekyyli muuttaa pyörimisnopeuttaan. Näillä siirtymillä on säteilyä vastaavat energiat (ts, fotoneja) kaukaisesta infrapunasta radioaaltojen aallonpituuksiin.
- Molekyylien translaatioenergiat Maan ilmakehässä, ~kT, ovat yleensä hieman suuremmat kuin energia, joka tarvitaan siirtymiseen kiertotasolta toiselle, 10-100 kertaa pienemmät kuin energia, joka tarvitaan siirtymiseen värähtelytasolta toiselle, ja sadoista tuhansiin kertoihin pienemmät kuin se energia, joka tarvitaan siirtymiseen elektronitasolta toiselle.
- Olemme jo nähneet, että joillakin molekyyleillä ja atomeilla on suurempaa liike-energiaa kuin muilla. Kaikki molekyylit, joiden liike-energia on suurempi kuin rotaatiotasojen välinen energiaero, voivat törmätä molekyyliin ja antaa sille tarpeeksi rotaatioenergiaa siirtyäkseen korkeammalle rotaatiotasolle. Näemme siis, että rotaatioenergia jakautuu monille rotaatiotasoille, mutta värähtely- ja elektronitasot ovat yleensä perustasoja (matalimman energian tasoja).
- Atomeilla ei ole molekyylin kaltaisia värähtelyjä ja rotaatioita, koska niillä on vain yksi ydin, joten niiden spektrit koostuvat vain elektronisista siirtymistä.
- Jyrkkä siirtymä yhdeltä diskreetiltä tasolta toiselle, joka näkyy spektrissä viivana, tapahtuu kapealla energia-alueella siirtymän energiaeron ympärillä. Syntyvä säteily esiintyy kapealla aallonpituuskaistalla, joka on linjan keskiaallonpituuden ympärillä. Tämän viivan leveyttä (mitattuna puolet viivan maksimikorkeudesta) kutsutaan viivanleveydeksi.
- Tätä luonnollista viivanleveyttä voi leventää molekyylin liike, jota kutsutaan Dopplerin levennykseksi, tai törmäykset, jota kutsutaan paineen levennykseksi.
- Korkealla atmosfäärissä Dopplerin levennys on hallitsevaa, koska paine on matala, mutta alempana atmosfäärissä paineenlevennys muuttuu hallitsevaksi, vaikkakin Dopplerin levennyskin kasvaa. Absorptioviivat ovat siis leveämpiä lähellä Maan pintaa kuin korkeammalla ilmakehässä.
Absorptiopoikkileikkaus σ vaihtelee merkittävästi absorptioviivan leveyden mukaan. On siis mahdollista, että kaikki säteily absorboituu viivan keskellä, mutta ”siivissä” absorboituu hyvin vähän.”
Fysikaalinen tulkinta
Atomit ja molekyylit voivat absorboida säteilyä (fotonia) vain, jos niiden rakenteessa on tasojen välinen energiaero, joka vastaa fotonin energiaa (hc/λ). Muussa tapauksessa atomi tai molekyyli ei absorboi valoa. Kun molekyyli on absorboinut fotonin, se voi joko menettää fotonin ja palata alkuperäiselle alemmalle energiatasolleen, tai se voi hajota, jos fotonin energia on suurempi kuin molekyyliä koossa pitävä kemiallinen sidos, tai se voi törmätä toisiin molekyyleihin, kuten N2:een tai O2:een, ja siirtää energiaa niihin samalla kun se palaa alemmalle energiatasolleen. Törmäyksiä tapahtuu usein, joten absorboituneen fotonin energia siirtyy usein lämpöenergiaksi.
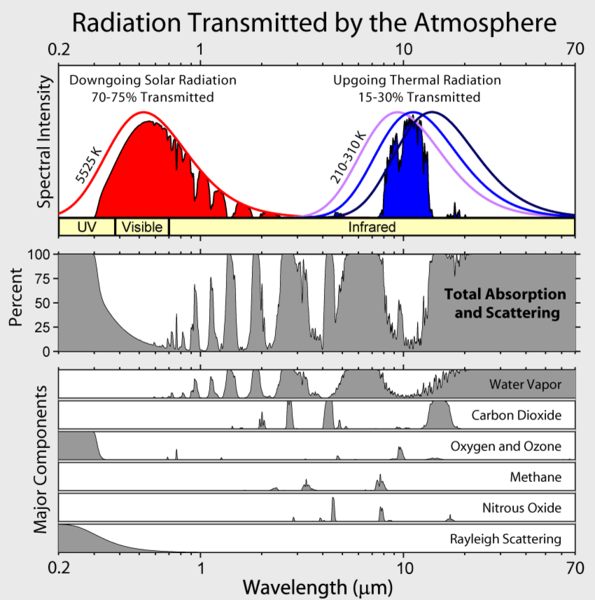
Huomaa, että maapallon lähtevä infrapunasäteily rajoittuu muutamaan ilmakehän ”ikkunaan”, ja säteily kaikilla muilla aallonpituuksilla absorboituu voimakkaasti, enimmäkseen vesihöyryyn, mutta myös hiilidioksidiin, otsoniin, dityppioksidiin, metaaniin ja muihin hivenaineena oleviin kaasuihin, joita ei näytetä yllä olevassa kuvassa.