Oppimistavoitteet
- Määrittele kovalenttinen sidos.
- Kuvasta kovalenttisen sidoksen muodostumista Lewisin elektronipistekaavioilla.
Ioninen sidos syntyy tyypillisesti silloin, kun yhden atomin on helppo menettää yksi tai useampi elektroni ja toisen atomin on helppo saada yksi tai useampi elektroni. Jotkut atomit eivät kuitenkaan luovuta tai saa elektroneja helposti. Silti ne osallistuvat silti yhdisteiden muodostukseen. Miten? Täydellisen valenssikuoren saamiseksi on toinenkin mekanismi: elektronien jakaminen. Kun elektronit jaetaan kahden atomin kesken, ne muodostavat sidoksen, jota kutsutaan kovalenttiseksi sidokseksi.
Kuvitellaan kovalenttista sidosta H-atomien avulla, sillä H-atomit tarvitsevat vain kaksi elektronia täyttääkseen 1s-alakuoren. Jokaisella H-atomilla on aluksi yksi elektroni valenssikuoressaan:
\
Kaksi H-atomia voivat jakaa elektroninsa:
\
Voidaan käyttää ympyröitä osoittamaan, että kullakin H-atomilla on kaksi elektronia ytimen ympärillä, jolloin kummankin atomin valenssikuori täyttyy kokonaan:
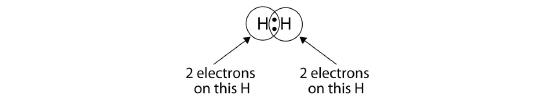
Koska kullakin H-atomilla on täysi valenssikuori, tämä sidos on stabiili, ja olemme muodostaneet kaksiatomisen vetymolekyylin. (Tämä selittää, miksi vety on yksi kaksiatomisista alkuaineista.) Yksinkertaisuuden vuoksi ei ole epätavallista esittää kovalenttista sidosta katkoviivalla eikä kahdella pisteellä:
H-H
Koska kaksi atomia jakaa yhden elektroniparin, tätä kovalenttista sidosta kutsutaan yksinkertaiseksi sidokseksi. Toisena esimerkkinä tarkastellaan fluoria. F-atomeilla on seitsemän elektronia valenssikuoressaan:
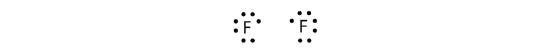
Nämä kaksi atomia voivat tehdä saman kuin H-atomit; ne jakavat parittomat elektroninsa muodostaakseen kovalenttisen sidoksen.

Huomaa, että kummallakin F-atomilla on nyt kokonainen oktetti ympärillään:
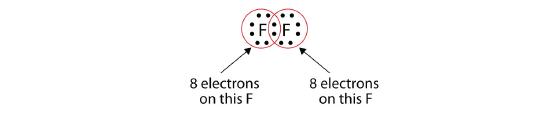
Voidaan myös kirjoittaa tämä käyttäen viivaa kuvaamaan jaettua elektroniparia:
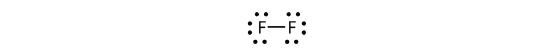
Fluorin kaksiatomisessa molekyylissä on kahta erityyppistä elektronia. Sitova elektronipari muodostaa kovalenttisen sidoksen. Kullakin F-atomilla on kolme muuta elektroniparia, jotka eivät osallistu sidokseen; niitä kutsutaan yksinäiselektroneiksi. Kullakin F-atomilla on yksi sidoselektronipari ja kolme yksinäistä elektroniparia.
Kovalenttisia sidoksia voidaan muodostaa myös eri alkuaineiden välille. Yksi esimerkki on HF. Kummallakin atomilla on aluksi pariton määrä elektroneja valenssikuoressaan:
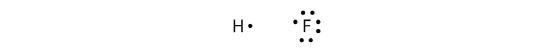
Kaksi atomia voivat jakaa parittomat elektronit keskenään muodostaakseen kovalenttisen sidoksen:
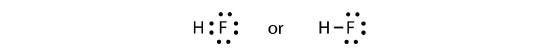
Huomautamme, että H-atomilla on täysi valenssikuori, jossa on kaksi elektronia, kun taas F-atomilla on täysi kahdeksikko elektroneja.
Esimerkki \(\PageIndex{1}\):
Käyttäkää Lewisin elektronipistekaavioita havainnollistamaan kovalenttisen sidoksen muodostumista HBr:ssä.
Liuos
HBr on hyvin samanlainen kuin HF, paitsi että siinä on F:n sijasta Br. Atomit ovat seuraavat:

Kaksi atomia voivat jakaa parittoman elektroninsa:
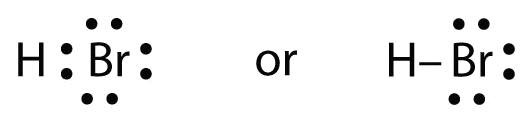
Harjoitus \(\PageIndex{1}\)
Käyttäkää Lewisin elektronipistediagrammeja havainnollistaaksenne kovalenttisen sidoksen muodostumista Cl2:ssä.
Vastaus:
Kaikki atomit voivat jakaa pariutumattoman elektronin: 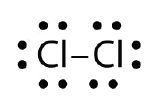
Kovalenttirakenteiden kanssa työskenneltäessä näyttää joskus siltä, että elektronit ovat jääneet jäljelle. Sovellat tähän mennessä oppimiasi sääntöjä ja siellä roikkuu vielä joitakin elektroneja irrallaan. Et voi vain jättää niitä sinne. Minne siis laitat ne?
Moninkertaiset kovalenttiset sidokset
Jotkut molekyylit eivät pysty täyttämään oktettisääntöä tekemällä atomien välille vain yhden kovalenttisen sidoksen. Tarkastellaan yhdistettä eteni, jonka molekyylikaava on \(\ce{C_2H_4}\). Hiiliatomit ovat sitoutuneet toisiinsa, ja kukin hiili on sitoutunut myös kahteen vetyatomiin.
kaksi \(\ce{C}\)-atomia \(= 2 \ kertaa 4 = 8\) valenssielektronia
neljä \(\ce{H}\)-atomia \(= 4 \ kertaa 1 = 4\) valenssielektronia
yhteenlaskettuna 12 \(\ce{C}\)-atomia. molekyylin valenssielektronit
Jos Lewisin elektronipisterakenne piirretään siten, että hiiliatomien välillä on yksi sidos ja noudatetaan oktettisääntöä, se näyttäisi tältä:

Tämä Lewisin rakenne on virheellinen, koska se sisältää yhteensä 14 elektronia. Lewis-rakennetta voidaan kuitenkin muuttaa poistamalla hiiliatomien yksinäiset parit ja jakamalla kaksi paria yhden parin sijaan.
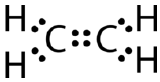
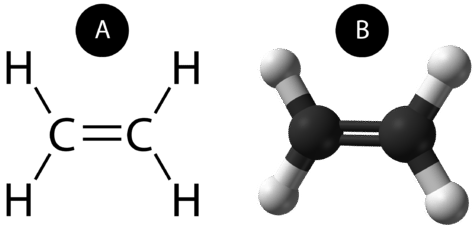
Kovalenttinen kaksoissidos on kovalenttinen sidos, jonka muodostavat atomit, jotka jakavat kaksi elektroniparia. Eteenin kahden hiiliatomin välillä esiintyvä kaksoiskovalenttinen sidos voidaan esittää myös rakennekaavalla ja molekyylimallilla alla olevan kuvan mukaisesti.
Kolminkertainen kovalenttinen sidos on kovalenttinen sidos, jonka muodostavat atomit, jotka jakavat kolme elektroniparia. Alkuaine typpi on kaasu, joka muodostaa suurimman osan maapallon ilmakehästä. Typen atomilla on viisi valenssielektronia, jotka voidaan esittää yhtenä parina ja kolmena yksittäisenä elektronina. Kun se yhdistyy toisen typpiatomin kanssa muodostaen kaksiatomisen molekyylin, kunkin atomin kolme yksittäistä elektronia yhdistyvät kolmeksi jaetuksi elektronipariksi.
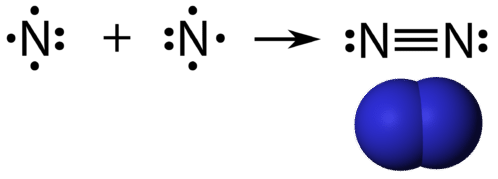
Jokainen typpiatomi noudattaa oktettisääntöä, jossa on yksi yksinäinen elektronipari ja kuusi atomien kesken jaettua elektronia.
Yhteenveto
- Kovalenttiset sidokset muodostuvat, kun atomit jakavat elektroneja.
- Kovalenttisten sidosten muodostumista voidaan havainnollistaa Lewisin elektronipistekaavioilla.
- Atomien väliset kaksoissidokset tai kolmoissidokset voivat olla välttämättömiä, jotta joidenkin molekyylien sidoksia voidaan havainnollistaa oikein.
Tekijät ja omistusosuudet
-
CK-12-säätiö, jonka perustajina ovat toimineet Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson ja Jean Dupon.
- Anonyymi
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)