Lernziele
- Definieren Sie eine kovalente Bindung.
- Veranschaulichen Sie die Bildung einer kovalenten Bindung mit Lewis-Elektronenpunktdiagrammen.
Ionische Bindungen treten typischerweise auf, wenn es für ein Atom leicht ist, ein oder mehrere Elektronen abzugeben und für ein anderes Atom, ein oder mehrere Elektronen zu gewinnen. Manche Atome geben jedoch nicht so leicht Elektronen ab oder nehmen sie auf. Dennoch sind sie an der Bildung von Verbindungen beteiligt. Wie das? Es gibt einen weiteren Mechanismus, um eine vollständige Valenzschale zu erhalten: die gemeinsame Nutzung von Elektronen. Wenn zwei Atome Elektronen miteinander teilen, gehen sie eine Bindung ein, die als kovalente Bindung bezeichnet wird.
Lassen Sie uns eine kovalente Bindung anhand von H-Atomen veranschaulichen, wobei wir davon ausgehen, dass H-Atome nur zwei Elektronen benötigen, um die 1s-Unterschale zu füllen. Jedes H-Atom beginnt mit einem einzigen Elektron in seiner Valenzschale:
\
Die beiden H-Atome können sich ihre Elektronen teilen:
\
Wir können Kreise verwenden, um zu zeigen, dass jedes H-Atom zwei Elektronen um den Kern herum hat, wodurch die Valenzschale jedes Atoms vollständig gefüllt wird:
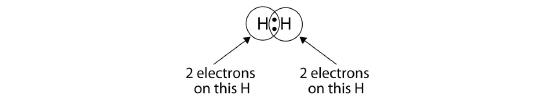
Da jedes H-Atom eine gefüllte Valenzschale hat, ist diese Bindung stabil, und wir haben ein zweiatomiges Wasserstoffmolekül hergestellt. (Dies erklärt, warum Wasserstoff zu den zweiatomigen Elementen gehört.) Der Einfachheit halber ist es nicht unüblich, die kovalente Bindung mit einem Strich statt mit zwei Punkten darzustellen:
H-H
Da sich zwei Atome ein Elektronenpaar teilen, wird diese kovalente Bindung als Einfachbindung bezeichnet. Ein weiteres Beispiel ist Fluor. F-Atome haben sieben Elektronen in ihrer Valenzschale:
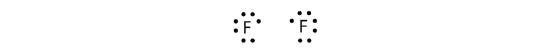
Diese beiden Atome können dasselbe tun wie die H-Atome; sie teilen ihre ungepaarten Elektronen, um eine kovalente Bindung einzugehen.

Beachte, dass jedes F-Atom jetzt ein komplettes Oktett um sich herum hat:
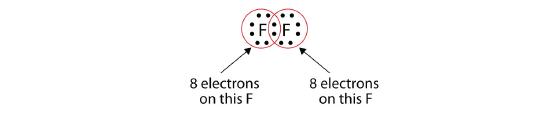
Wir können dies auch mit einem Bindestrich schreiben, um das geteilte Elektronenpaar darzustellen:
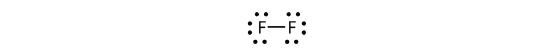
Es gibt zwei verschiedene Arten von Elektronen in dem zweiatomigen Fluormolekül. Das bindende Elektronenpaar bildet die kovalente Bindung. Jedes F-Atom verfügt über drei weitere Elektronenpaare, die nicht an der Bindung beteiligt sind; sie werden als Einzelelektronen bezeichnet. Jedes F-Atom hat ein bindendes Elektronenpaar und drei einsame Elektronenpaare.
Kovalente Bindungen können auch zwischen verschiedenen Elementen eingegangen werden. Ein Beispiel ist HF. Jedes Atom beginnt mit einer ungeraden Anzahl von Elektronen in seiner Valenzschale:
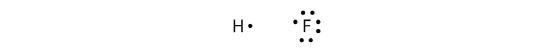
Die beiden Atome können ihre ungepaarten Elektronen teilen, um eine kovalente Bindung einzugehen:
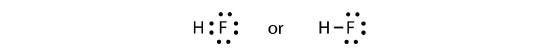
Wir stellen fest, dass das H-Atom eine volle Valenzschale mit zwei Elektronen hat, während das F-Atom ein komplettes Oktett von Elektronen hat.
Beispiel \(\PageIndex{1}\):
Verwenden Sie Lewis-Elektronenpunktdiagramme zur Veranschaulichung der kovalenten Bindungsbildung in HBr.
Lösung
HBr ist HF sehr ähnlich, nur dass es Br anstelle von F hat. Die Atome sind wie folgt:

Die beiden Atome können sich ihr ungepaartes Elektron teilen:
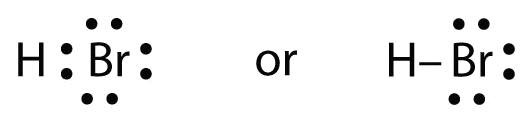
Übung \(\PageIndex{1}\)
Verwenden Sie Lewis-Elektronenpunktdiagramme, um die kovalente Bindungsbildung in Cl2 zu veranschaulichen.
Antwort: 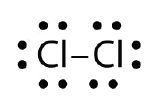
Beim Arbeiten mit kovalenten Strukturen sieht es manchmal so aus, als hätte man Elektronen übrig. Man wendet die Regeln an, die man bisher gelernt hat, und es gibt immer noch ein paar Elektronen, die dort ungebunden herumhängen. Man kann sie nicht einfach dort lassen. Wohin also mit ihnen?
Mehrfache kovalente Bindungen
Einige Moleküle können die Oktettregel nicht erfüllen, indem sie nur einfache kovalente Bindungen zwischen den Atomen eingehen. Nehmen wir die Verbindung Ethen, die die Summenformel \(\ce{C_2H_4}\) hat. Die Kohlenstoffatome sind miteinander verbunden, wobei jedes Kohlenstoffatom auch an zwei Wasserstoffatome gebunden ist.
zwei \(\ce{C}\) Atome \(= 2 \mal 4 = 8\) Valenzelektronen
vier \(\ce{H}\) Atome \(= 4 \mal 1 = 4\) Valenzelektronen
insgesamt 12 Valenzelektronen im Molekül
Wenn die Lewis-Elektronenpunktstruktur mit einer Einfachbindung zwischen den Kohlenstoffatomen und unter Einhaltung der Oktettregel gezeichnet würde, würde sie wie folgt aussehen:

Diese Lewis-Struktur ist falsch, weil sie insgesamt 14 Elektronen enthält. Die Lewis-Struktur kann jedoch geändert werden, indem die einsamen Paare an den Kohlenstoffatomen eliminiert werden und zwei Paare anstelle von nur einem Paar geteilt werden.
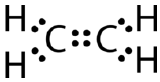
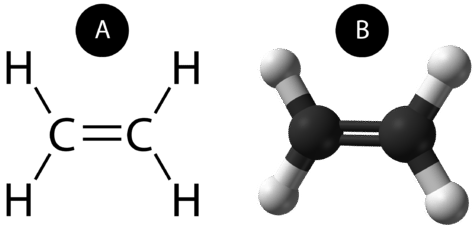
Eine kovalente Doppelbindung ist eine kovalente Bindung, die von Atomen gebildet wird, die sich zwei Elektronenpaare teilen. Die doppelte kovalente Bindung, die zwischen den beiden Kohlenstoffatomen in Ethan auftritt, kann auch durch eine Strukturformel und mit einem Molekülmodell dargestellt werden, wie in der folgenden Abbildung gezeigt.
Eine dreifache kovalente Bindung ist eine kovalente Bindung, die von Atomen gebildet wird, die sich drei Elektronenpaare teilen. Das Element Stickstoff ist ein Gas, das den größten Teil der Erdatmosphäre ausmacht. Ein Stickstoffatom hat fünf Valenzelektronen, die als ein Paar und drei einzelne Elektronen dargestellt werden können. Wenn es sich mit einem anderen Stickstoffatom zu einem zweiatomigen Molekül verbindet, verbinden sich die drei Einzelelektronen an jedem Atom zu drei gemeinsamen Elektronenpaaren.
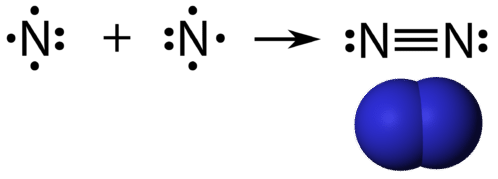
Jedes Stickstoffatom folgt der Oktettregel mit einem einsamen Elektronenpaar und sechs Elektronen, die zwischen den Atomen geteilt werden.
Zusammenfassung
- Kovalente Bindungen entstehen, wenn sich Atome Elektronen teilen.
- Zur Veranschaulichung der Bildung kovalenter Bindungen können Lewis-Elektronenpunktdiagramme gezeichnet werden.
- Doppel- oder Dreifachbindungen zwischen Atomen können notwendig sein, um die Bindungen in einigen Molekülen richtig zu veranschaulichen.
Mitwirkende und Verantwortliche
-
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- Anonym
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)