6.9 Hvorfor absorberer objekter på den måde, de gør?
Atmosfæren absorberer en betydelig mængde stråling i det infrarøde område, men kun lidt i det synlige område. Vi kan også se, at gasser absorberer kraftigt ved nogle bølgelængder og ikke ved andre bølgelængder. Hvorfor er det sådan?
For at besvare dette spørgsmål skal vi se på konfigurationen af de elektroner, der suser rundt omkring atomer og molekyler. For mere end 100 år siden begyndte forskerne at bruge prismer til at sprede lyset fra solen og fra flammer, der indeholder forskellige grundstoffer. Mens solen gav regnbuens farver, havde flammerne lys i meget tydelige linjer eller bånd. Denne gåde blev endelig løst for lidt over 100 år siden med opfindelsen af kvantemekanikken, som grundlæggende siger, at de elektroner, der suser rundt i atomer og molekyler, og molekylernes vibrationer og rotationer kun kan have diskrete energier, der er styret af reglerne for bevarelse af impulsmængden.

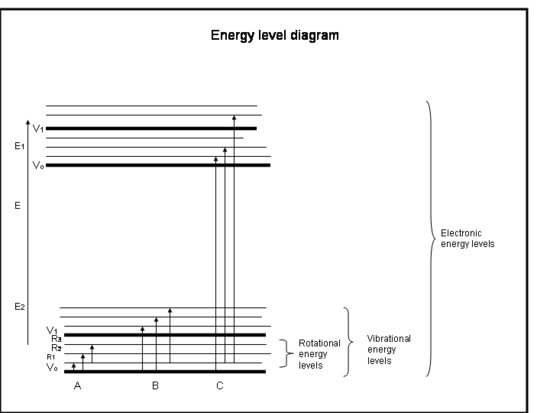
Den følgende liste med punktopstillinger er et lynkursus i absorption af elektronerne i atomer og molekyler. Se figuren under boksen.
Crashkursus: Absorption af elektronerne i atomer og molekyler
- Kemiske bindinger og kvantemekanikken bestemmer tilsammen de energiniveauer, som en elektron, et atom eller et molekyle kan befinde sig i.
- Enerien i et molekyle er summen af den energi, der er relateret til elektronernes position i forhold til deres stabile elektroniske grundtilstande, molekylvibrationen og molekylrotationen.
- Absorption sker, når fotonens energi passer til forskellen mellem to energiniveauer i et molekyle, ΔE = Efinal – Einitial = hc/λ.
- Regler fastsat af bevarelse af vinkelimpuls og elektronspin bestemmer, hvilke overgange mellem energiniveauer der er tilladt.
- Mængden af absorption, der blot kaldes absorptionstværsnittet, σ, kommer fra mange faktorer, men varierer betydeligt fra molekyle til molekyle og fra overgang til overgang. Tværsnittet har dimensioner af areal og har almindeligvis enheder af cm2.
- Elektroniske overgange opstår, når elektronerne faktisk hopper ind i andre baner omkring atomkerner. De har energier, der svarer til stråling (dvs. fotoner) i de ultraviolette til synlige bølgelængder.
- Vibrationelle overgange opstår, når molekylet vibrerer ved en anden frekvens eller på en anden måde. Diatomare molekyler (f.eks. O2 og N2) har kun én måde at vibrere på – frem og tilbage langs den kemiske binding, der binder dem. Men mere komplicerede molekyler (f.eks. H2O og CO2) kan vibrere ikke kun med kerner, der går mod og væk fra hinanden, men også ved at bøje sig i tre retninger. Disse vibrationsovergange, der ledsages af bevægelser, der kombinerer vibration og rotation, har energier svarende til den nær- og melleminfrarøde stråling (dvs. fotoner).
- Rotationsovergange opstår, når et molekyle ændrer sin rotationshastighed. Disse overgange har energier svarende til stråling (dvs, fotoner) i det fjernt infrarøde til radiobølgelængder.
- Translationsenergierne for molekyler i Jordens atmosfære, ~kT, er generelt lidt større end den energi, der kræves for at bevæge sig fra et rotationsniveau til et andet, 10-100 gange mindre end den energi, der kræves for at gå fra et vibrationsniveau til et andet, og hundreder til tusinder af gange mindre end det, der kræves for at gå fra et elektronisk niveau til et andet.
- Vi har allerede set, at nogle molekyler og atomer har mere kinetisk energi end andre. Alle molekyler med en kinetisk energi, der er større end energiforskellen mellem rotationsniveauerne, kan kollidere med molekylet og give det nok rotationsenergi til at skifte til et højere rotationsniveau. Vi ser således, at rotationsenergien er fordelt på mange rotationsniveauer, men at vibrations- og elektroniske niveauer normalt er grundniveauerne (lavenergi).
- Atomer har ikke molekyllignende vibrationer og rotationer, fordi de kun har én kerne, så deres spektrer består kun af elektroniske overgange.
- En skarp overgang fra et diskret niveau til et andet, der fremstår som en linje i et spektrum, forekommer i et snævert energiforhold omkring energiforskellen ved overgangen. Den resulterende stråling forekommer i et smalt bånd af bølgelængder omkring linjens centrale bølgelængde. Bredden af denne linje (målt ved halvdelen af linjens maksimale højde) kaldes linjebredden.
- Denne naturlige linjebredde kan udvides af molekylets bevægelse, kaldet Dopplerudvidelse, eller af kollisioner, kaldet trykudvidelse.
- Højt i atmosfæren er Dopplerudvidelsen dominerende, fordi trykket er lavt, men lavere i atmosfæren bliver trykudvidelsen dominerende, selv om Dopplerudvidelsen også øges. Absorptionslinjerne er altså bredere nær Jordens overflade, end de er højere oppe i atmosfæren.
Absorptionstværsnittet, σ, varierer betydeligt over bredden af absorptionslinjen. Det er således muligt, at al strålingen absorberes i midten af linjen, men at meget lidt absorberes i “vingerne”.”
Fysisk fortolkning
Atomer og molekyler kan kun absorbere stråling (en foton), hvis deres struktur har en energiforskel mellem niveauer, der matcher fotonens energi (hc/λ). Ellers vil atomet eller molekylet ikke absorbere lyset. Når molekylet har absorberet fotonen, kan det enten miste en foton og gå tilbage til sit oprindelige lavere energiniveau, eller det kan bryde fra hinanden, hvis fotonens energi er større end den kemiske binding, der holder molekylet sammen, eller det kan kollidere med andre molekyler, f.eks. N2 eller O2, og overføre energi til dem, mens det går tilbage til sit lavere energiniveau. Kollisioner sker ofte, så energien fra den absorberede foton overføres ofte til termisk energi.
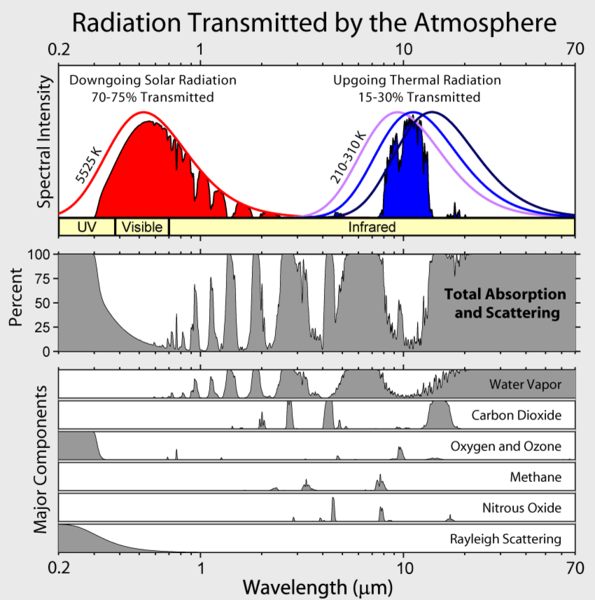
Bemærk, at Jordens udgående infrarøde bestråling er begrænset til nogle få atmosfæriske “vinduer”, og at bestråling ved alle andre bølgelængder absorberes kraftigt, mest af vanddamp, men også af kuldioxid, ozon, lattergas, metan og andre mere sporede gasser, som ikke er vist i figuren ovenfor.