Læringsmål
- Definer kovalent binding.
- Illustrer dannelse af kovalente bindinger med Lewis-elektronpunktdiagrammer.
Ionisk binding opstår typisk, når det er let for et atom at miste en eller flere elektroner og et andet atom at få en eller flere elektroner. Nogle atomer vil dog ikke let afgive eller få elektroner. Alligevel deltager de stadig i dannelsen af forbindelser. Hvordan? Der er en anden mekanisme til at opnå en komplet valensskal: deling af elektroner. Når elektroner deles mellem to atomer, danner de en binding kaldet en kovalent binding.
Lad os illustrere en kovalent binding ved hjælp af H-atomer, idet vi forstår, at H-atomer kun har brug for to elektroner for at fylde 1s-subskallen. Hvert H-atom starter med en enkelt elektron i sin valensskal:
\
De to H-atomer kan dele deres elektroner:
\
Vi kan bruge cirkler til at vise, at hvert H-atom har to elektroner omkring kernen og dermed fylder hvert atoms valensskal fuldstændigt:
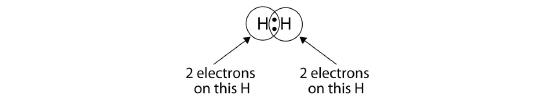
Da hvert H-atom har en fyldt valensskal, er denne binding stabil, og vi har lavet et toatomigt brintmolekyle. (Dette forklarer, hvorfor brint er et af de toatomige grundstoffer.) For enkelhedens skyld er det ikke usædvanligt at repræsentere den kovalente binding med en streg i stedet for med to prikker:
H-H
Da to atomer deler ét elektronpar, kaldes denne kovalente binding en enkeltbinding. Som et andet eksempel kan vi se på fluor. F-atomer har syv elektroner i deres valensskal:
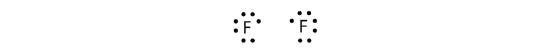
Disse to atomer kan gøre det samme, som H-atomerne gjorde; de deler deres uparrede elektroner for at lave en kovalent binding.

Bemærk, at hvert F-atom nu har en komplet oktet omkring sig:
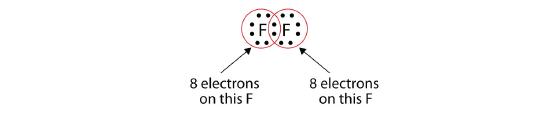
Vi kan også skrive dette ved hjælp af en streg for at repræsentere det delte elektronpar:
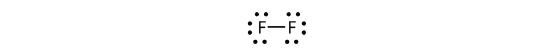
Der er to forskellige typer af elektroner i det toatomige fluormolekyle. Det bindende elektronpar danner den kovalente binding. Hvert F-atom har tre andre elektronpar, som ikke deltager i bindingen; de kaldes lone pair-elektroner. Hvert F-atom har et bindingselektronpar og tre lone-elektronpar.
Kovalente bindinger kan også laves mellem forskellige grundstoffer. Et eksempel er HF. Hvert atom starter med et ulige antal elektroner i sin valensskal:
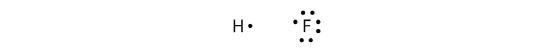
De to atomer kan dele deres uparrede elektroner for at lave en kovalent binding:
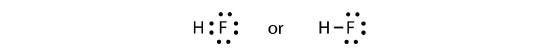
Vi bemærker, at H-atomet har en fuld valensskal med to elektroner, mens F-atomet har en komplet oktet af elektroner.
Eksempel \(\PageIndex{1}\):
Brug Lewis-elektronpunktdiagrammer til at illustrere dannelsen af den kovalente binding i HBr.
Løsning
HBr ligner meget HF, bortset fra at det har Br i stedet for F. Atomerne er som følger:

De to atomer kan dele deres uparrede elektroner:
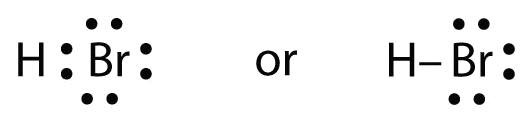
Ovelse \(\PageIndex{1}\)
Brug Lewis elektronpunktdiagrammer til at illustrere dannelsen af den kovalente binding i Cl2.
Svar: 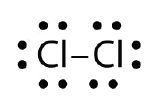
Når man arbejder med kovalente strukturer, ser det nogle gange ud som om man har overskydende elektroner. Man anvender de regler, man har lært indtil nu, og der er stadig nogle elektroner, der hænger derude uden at være bundet. Man kan ikke bare lade dem ligge der. Så hvor skal du sætte dem?
Multiple kovalente bindinger
Nogle molekyler er ikke i stand til at opfylde oktetreglen ved kun at lave enkelte kovalente bindinger mellem atomerne. Tag forbindelsen ethen, som har molekylformlen \(\ce{C_2H_4}\). Kulstofatomerne er bundet til hinanden, og hvert kulstof er også bundet til to hydrogenatomer.
to \(\ce{C}\) atomer \(= 2 \ gange 4 = 8\) valenselektroner
fire \(\ce{H}\) atomer \(= 4 \ gange 1 = 4\) valenselektroner
total af 12 valenselektroner i molekylet
Hvis Lewis-elektronpunktstrukturen blev tegnet med en enkelt binding mellem kulstofatomerne og med oktetreglen fulgt, ville den se således ud:

Denne Lewis-struktur er forkert, fordi den indeholder i alt 14 elektroner. Lewis-strukturen kan dog ændres ved at fjerne de ensomme par på kulstofatomerne, så de skal dele to par i stedet for kun ét par.
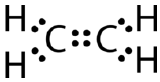
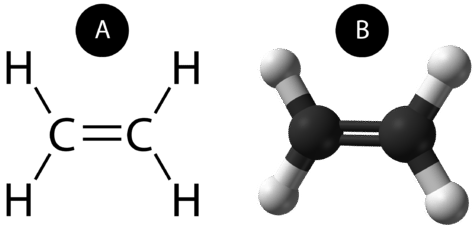
En dobbelt kovalent binding er en kovalent binding, der dannes af atomer, der deler to elektronpar. Den dobbelte kovalente binding, der opstår mellem de to kulstofatomer i ethan, kan også repræsenteres med en strukturformel og med en molekylær model som vist i nedenstående figur.
En tredobbelt kovalent binding er en kovalent binding dannet af atomer, der deler tre elektronpar. Grundstoffet nitrogen er en gas, som udgør størstedelen af Jordens atmosfære. Et nitrogenatom har fem valenselektroner, som kan vises som et par og tre enkeltelektroner. Når de kombineres med et andet nitrogenatom for at danne et toatomigt molekyle, kombineres de tre enkeltelektroner på hvert atom for at danne tre fælles elektronpar.
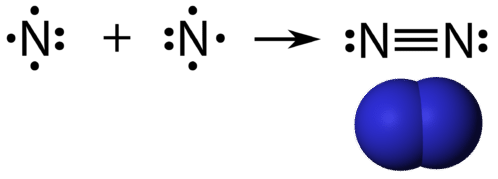
Hvert nitrogenatom følger oktetreglen med et enkelt elektronpar og seks elektroner, der deles mellem atomerne.
Summarum
- Kovalente bindinger dannes, når atomer deler elektroner.
- Lewis elektronpunktdiagrammer kan tegnes for at illustrere dannelsen af kovalente bindinger.
- Dobbeltbindinger eller trippelbindinger mellem atomer kan være nødvendige for at illustrere bindingerne i nogle molekyler korrekt.
Medvirkende og bidragsydere
-
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
- Anonym
-
Marisa Alviar-Agnew (Sacramento City College)
-
Henry Agnew (UC Davis)