6.9 Proč objekty absorbují tak, jak absorbují?
Amosféra absorbuje značné množství záření v infračervené oblasti, ale poměrně málo ve viditelné oblasti. Také vidíme, že plyny silně absorbují v některých vlnových délkách a v jiných ne. Proč tomu tak je?
Chceme-li odpovědět na tuto otázku, musíme se podívat na konfigurace elektronů, které se přibližují kolem atomů a molekul. Před více než 100 lety začali vědci používat hranoly k rozptylování světla ze Slunce a z plamenů obsahujících různé prvky. Zatímco slunce dávalo barvy duhy, plameny měly světlo ve velmi výrazných liniích nebo pásech. Tato záhada byla konečně vyřešena před o něco více než 100 lety vynálezem kvantové mechaniky, která v podstatě říká, že elektrony přibližující se kolem atomů a molekul a vibrace a rotace molekul mohou mít pouze diskrétní energie, které se řídí pravidly zachování momentu hybnosti.

Následující seznam s odrážkami je rychlokurzem absorpce elektrony v atomech a molekulách. Podívejte se na obrázek pod rámečkem.
Crash kurz:
Absorpční průřez, σ, se výrazně mění v závislosti na šířce absorpční čáry. Je tedy možné, aby bylo veškeré záření pohlceno uprostřed čáry, ale jen velmi málo pohlceno v „křídlech“.
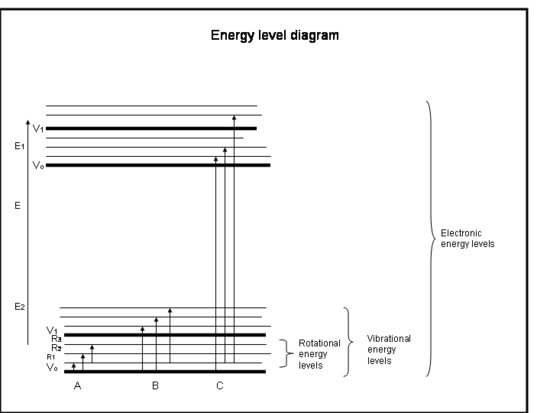
Fyzikální výklad
Atomy a molekuly mohou absorbovat záření (foton) pouze tehdy, pokud jejich struktura má energetický rozdíl mezi hladinami, který odpovídá energii fotonu (hc/λ). V opačném případě atom nebo molekula světlo nepohltí. Jakmile molekula absorbuje foton, může buď ztratit foton a vrátit se na svou původní nižší energetickou hladinu, nebo se může rozpadnout, pokud je energie fotonu větší než energie chemické vazby, která drží molekulu pohromadě, nebo se může srazit s jinými molekulami, například N2 nebo O2, a předat jim energii, zatímco se vrátí na svou nižší energetickou hladinu. Ke srážkám dochází často, takže energie pohlceného fotonu je často převedena na tepelnou energii.
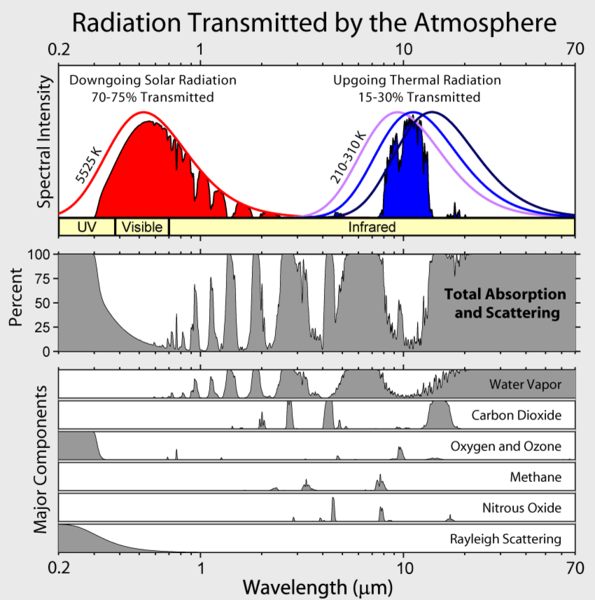
Všimněte si, že infračervené záření vycházející ze Země je omezeno na několik atmosférických „oken“ a záření na všech ostatních vlnových délkách je silně pohlcováno především vodní párou, ale také oxidem uhličitým, ozonem, oxidem dusným, metanem a dalšími stopovějšími plyny, které nejsou na obrázku výše zobrazeny.
.