ORIGINAL
Gorlin-Goltz syndrom: behandling av basalcellscancer i ansiktet
Gorlin-Goltz syndrom: behandling av basalcellscancer i ansiktet
Rocío Gilabert Rodrígueza, Pedro Infante Cossíob, Pablo Redondo Parejob, Eusebio Torres Carranzab, Alberto García-Perla Garcíab och Domingo Sicilia Castroa
aService of Plastic and Reconstructive Surgery, Hospital Universitario Virgen del Rocío, Sevilla, Spanien
bService of Oral and Maxillofacial Surgery, Hospital Universitario Virgen del Rocío, Sevilla, Spanien
Korrespondensadress
SUMMARY
Introduktion/syfte: Gorlin-Goltz syndrom (GGS) är en autosomalt dominant ärftlig sjukdom som i första hand ger upphov till tumörproliferation, t.ex. basalcellskarcinom och keratocystor. Det orsakas av en mutation i Patched-genen på kromosom 9. Basalcellscancer hos patienter med GGS är vanligtvis multipla, kliniskt polymorfa till utseendet, utan könsbestämning, upptäcks ibland tidigt i livet och drabbar även områden som inte utsätts för solljus. Deras kliniska beteende är varierande, även om de ibland kan vara mycket aggressiva, särskilt i ansiktet. För att studera beteendet hos basalcellscancer hos patienter med GCS genomfördes en studie av patienter som behandlades på vårt sjukhus mellan 2001 och 2011 och som uppfyllde kriterierna för sjukdomen.
Material och metoder: 11 patienter med en klinisk och/eller genetisk diagnos av GGG inkluderades. Vi studerade fördelningen enligt ålder och kön, kliniska manifestationer, histologiska egenskaper, kirurgisk teknik, förekomst av återfall och patienternas utveckling.
Resultat: 36 % av patienterna hade basalcellscancer i ansiktet. Antalet tumörer per patient varierade från 9 till 21. Kirurgisk excision var den föredragna behandlingen, även om alla patienter utvecklade nya lesioner och återfall som krävde flera ingrepp. Histologisk undersökning visade att tumören var i kontakt med eller låg nära operationsgränserna i 28 % av lesionerna.
Slutsatser: Det finns inte tillräckligt med bevis i litteraturen för att avgöra vilken behandling som är den bästa bland de olika metoder som finns tillgängliga för behandling av basalcellscancer i SGG. Ett förebyggande tillvägagångssätt där man undviker solexponering är nödvändigt.
Nyckelord: Gorlin-Goltz syndrom. Nevoid basalcellscancer syndrom. Basalcellscancer. Queratoquiste maxilar.
ABSTRACT
Introduktion/syfte: Gorlin-Goltz syndrom (GGS) är en autosomalt dominant ärftlig sjukdom som huvudsakligen predisponerar för proliferation av tumörer, såsom basalcellskarcinom och käkkeratocyster. GGS orsakas av Patched-genmutationen på kromosom 9. Basalcellskarcinom hos patienter med GGS uppträder vanligen som multipla tumörer, med polymorfa kliniska drag, utan könspredilektion, som ibland uppträder i tidiga skeden av livet och som till och med drabbar områden som inte utsätts för solljus. Det kliniska beteendet kan variera och kan ibland vara mycket aggressivt, särskilt i ansiktet. För att studera beteendet hos basalcellskarcinom hos GGS-patienter genomfördes en studie på de patienter som uppfyllde kriterierna för sjukdomen och som behandlades på vårt sjukhus under perioden mellan 2001 och 2011.
Material och metoder: Studien omfattade 11 patienter med klinisk och/eller genetisk diagnos av GGS. Patienterna studerades utifrån kön och ålder, kliniska aspekter, histologiska särdrag, utförd kirurgisk behandling, förekomst av återfall och uppföljning.
Resultat: Basalcellskarcinom sågs i ansiktet hos 36 % av patienterna. Antalet tumörer per patient varierade mellan 9 och 21. Den föredragna behandlingen var kirurgisk excision, även om alla patienter utvecklade nya lesioner och recidiv som krävde flera ingrepp. Den histologiska studien visade att tumören hade kontakt eller närhet till de kirurgiska marginalerna i 28 % av lesionerna.
Slutsatser: Det finns inte tillräckligt med bevis i litteraturen för att fastställa vilken behandling som är det bästa valet bland de olika metoder som finns tillgängliga för behandling av basalcellscancer i GGS. Ett förebyggande tillvägagångssätt är nödvändigt för att undvika exponering för solljus.
Nyckelord: Gorlin-Goltz syndrom. Nevoid basalcellscancer syndrom. Basalcellscancer. Käkkeratocyst.
Introduktion
Gorlin-Goltz syndrom (GGS) beskrevs 1960 av författarna Gorlin och Goltz1. De beskrev först den triad som kännetecknar syndromet: multipla basalcellskarcinom, keratocystor i kinden och bifida revben. Det är numera känt som en genetisk sjukdom med autosomal dominant nedärvning, ofullständig penetrering och varierande fenotyp2,3 . Den orsakas av en mutation i Patched-genen (PTCH), en tumörsuppressorgen som finns på kromosom 9 (9q22, 3-q31). Den uppskattade prevalensen varierar från 1:57 000 till 1:164 000 beroende på land, med en allmänt accepterad genomsnittlig prevalens på cirka 1:60 0004.
GGS är en sjukdom som kliniskt kännetecknas av en predisposition för utveckling av multipla neoplasmer, samt av förekomsten av utvecklingsavvikelser. Den kliniska debuten inträffar i barndomen eller tonåren och åtföljs av ett antal manifestationer, varav den vanligaste är förekomsten av många basalcellskarcinom och odontogena keratocystor i kinden. Andra manifestationer är palmoplantär hyperkeratos, skelettmissbildningar, ektopiska intrakraniella förkalkningar och dysmorfi i ansiktet (makrocefali, läpp- och gomspalt och allvarliga okulära anomalier)5. Intellektuell brist förekommer i cirka 5 % av fallen. Det kan också förekomma ögon-, genitourinära och kardiovaskulära problem6 . Maligna medulloblastom utvecklas hos 5-10 % av patienterna med GGS och kan vara en potentiell orsak till tidig död. Diagnosen fastställs när två huvudkriterier eller ett huvudkriterium och två mindre kliniska kriterier är uppfyllda5 (tabell 1). Det definitiva diagnostiska testet är att påvisa en mutation i PTCH-genen.

Tumörer uppstår i SGG till följd av förändringar i pro-onkogener eller tumörsuppressorgener. De senare utövar en suppressorfunktion på pro-onkogener. När det gäller basalcellscancer är det oklart vilken pro-onkogen som är inblandad. RAS-vägen förändras, men inte i alla fall. När det gäller tumörsuppressorgener verkar det som om p53 spelar en sekundär roll i utvecklingen av denna tumör. Dessa patienters benägenhet för hudcancer verkar bero på att de celler som påverkas av mutationen är mer känsliga för solljus på grund av förändrade DNA-reparationsmekanismer. Basalcellscancer kan drabba alla delar av hudens anatomi, men förekommer främst på områden som utsätts för ultraviolett strålning, främst i ansiktet, på ryggen och på bröstet. Det finns vissa skillnader mellan basalcellscancer som förekommer i den allmänna befolkningen och hos patienter med GBS. I det senare fallet är de oftare talrika, har ett polymorft utseende, har ingen könstillhörighet och kan till och med drabba områden som inte är utsatta för solljus. De uppträder vanligen kliniskt i flera former6 , i antal från några få till hundratals, och de uppträder tidigt i livet (till och med vid födseln); deras kliniska beteende är varierande, även om de ibland kan vara mycket aggressiva från början, särskilt i ansiktet.
De flesta av de kliniska bevisen som finns tillgängliga om hanteringen av basalcellskarcinom vid GTS kommer från studier som utförts på patienter som inte är drabbade av syndromet. På grund av den omfattande erfarenheten av dessa tumörer i den allmänna befolkningen tillämpar de flesta författare samma terapeutiska åtgärder på patienter med GBS.
Syftet med den här studien var att analysera hanteringen av basalcellscancer i ansiktet hos patienter med GBS för att bedöma det kliniska beteendet och de diagnostiska och terapeutiska kriterierna baserat på en klinisk studie av patienter som behandlats med GBS under de senaste tio åren vid Hospital Universitario Virgen del Rocío i Sevilla (Spanien).
Material och metoder
De kliniska journalerna för patienter som diagnostiserats med GTS mellan 2001 och 2011 på avdelningarna för mun- och käkkirurgi och plastisk och rekonstruktiv kirurgi studerades på ett observationellt och retrospektivt sätt. Elva patienter med en klinisk och/eller genetisk diagnos av GGS inkluderades, med undantag för de patienter som hade en ofullständig klinisk historia trots att de hade diagnosen. Epidemiologiska data (ålder och kön) och medicinsk-kirurgiska data (antal och lokalisering av lesioner, histopatologisk diagnos, använd kirurgisk teknik, förekomst av återfall och utveckling) analyserades. Den kliniska uppföljningen skedde genom regelbundna kontroller med en medeltid på 4,5 år.
Resultat
Patienternas medelålder var 27 år och majoriteten var män (73 %). I 45 % av fallen var åldern vid diagnosen lägre än 20 år. Klinisk diagnos ställdes hos 9 patienter (2 huvudkriterier eller 1 huvudkriterium och 2 mindre kriterier), medan 2 patienter hade en genetisk diagnos. Tre patienter hade en familjehistoria (tabell 2).

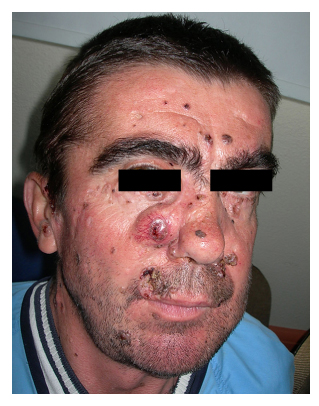
När det gäller de kliniska egenskaperna (tabell 3) var keratocyst i kinden det vanligaste kliniska tecknet, som förekom hos 91 % av urvalet (10 patienter). Därefter följde skelettförändringar (63 %) och karakteristisk fasciit (54 %). Fyra av de 11 patienterna (36 %) utvecklade basalcellscancer (tabell 4). Antalet lesioner per patient varierade från 9 till 21, och det exakta antalet lesioner registrerades inte för en patient. Alla var huvudsakligen lokaliserade i ansiktsregionen (fig. 1 och 2), följt av nacken och ryggen. I samtliga fall gjordes en kirurgisk excision av lesionerna (fig. 3). Patologin visade nodulär histologi i de flesta fall och en stor andel av de kirurgiska marginalerna var involverade (28 % av lesionerna hade kontakt med eller närhet till marginalen). I samtliga fall utfördes mer än ett kirurgiskt ingrepp.
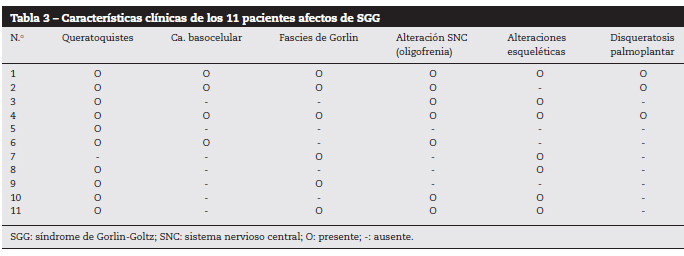

Figur 1. Patient nummer 6.
Multipelt basalcellscancer i ansiktet.
Figur 2. Patient nummer 2 visar
basalcellscancer på kinden.

Figur 3. Patient nummer 1.
A: Preoperativ bild av multipla basalcellscancer i ansiktet och på halsen.
B: Omedelbar postoperativ detalj efter excision.
Patient nummer 4 utvecklade flera recidiverande basalcellskarcinom på den nedre tredjedelen av ansiktet som krävde aggressiv excision inklusive mandibulektomi och omedelbar rekonstruktion med två sekventiella fria klaffar (fibula osteoseptokutan och antebrachial fasciokutan) (fig. 4). Patient nummer 6 hade ett epidermoidkarcinom på underkäkskroppen i samband med en keratocyst och avled till följd av detta.

Figur 4. A: Återkommande basalcellscancer i den nedre tredjedelen av ansiktet.
B: 3D-CT-rekonstruktion som visar ben och perineural inblandning.
C: Aggressiv excision med mandibulektomi.
D: Komplex rekonstruktion med två på varandra följande fria klaffar
(osteoseptokutan fibula och antebrachial fasciokutan med palmaris minor-sena).
E: Panoramaröntgen efter operationen.
F: Postoperativ bild av patienten.
Diskussion
Som utgångspunkt gjordes en litteraturgenomgång för att utvärdera den vetenskapliga information som publicerats om SGG under de senaste tio åren, vilket visade på ett ökande intresse för ämnet, främst i tidskrifter inom dermatologi, mun- och käkkirurgi, tandvård och genetik. Det största antalet artiklar finns i dermatologiska tidskrifter, möjligen för att basalcellscancer är en av de mest frekventa och återkommande lesionerna och på en plats (särskilt på ansiktshuden) som gör dem mer synliga och lättare att diagnostisera. Nästa grupp av tidskrifter är tidskrifter inom områdena mun- och käkkirurgi, tandvård och genetik. Keratocystor i käkbenet är de vanligaste skadorna vid detta syndrom och är ofta det ledande symtomet som styr diagnosen.
I vår serie var keratocystor i käkbenet det vanligaste kliniska tecknet hos 10 patienter, vilket också rapporterats i litteraturen. Endast en patient hade inga keratocystor i överkäken, även om patientens unga ålder kan förklara bristen på tid för deras utveckling (patient nummer 7). Det fanns en tydlig dominans av män, även om det inte finns någon beskrivning av könsfördelning i litteraturen, så det går inte att dra några slutsatser av detta faktum med tanke på den lilla urvalsstorleken. Det finns fyra typiska fall av SGG med högt fenotypiskt uttryck (patientnummer 1, 2, 4 och 6) där vi kan se att de mest dominerande kliniska manifestationerna (maxillära keratocystor och basalcellskarcinom) förekommer. Även om man i de flesta fall antar att det finns en drabbad förälder är detta inte fallet i vår serie, där endast tre patienter (27 jämfört med 70-80 % i litteraturen) har minst en drabbad familjemedlem som vi känner till (tabell 2). Fyra av de 11 patienterna med SGG utvecklade basalcellscancer. Detta motsvarar 36 % av fallen, vilket är en låg procentsats jämfört med den 90 %-iga frekvens som klassiskt anses gälla för denna sjukdom. Det är viktigt att notera att vissa av patienterna är unga. Även om dessa lesioner har beskrivits i detta syndrom redan vid födseln är detta inte normen och flera års exponering för riskfaktorer (ultraviolett strålning) krävs för att de ska visa sig kliniskt. Medelåldern för patienter med basalcellscancer i denna serie var dock 39 år (19 år den yngsta).
Basalcellscancer anses vara en av de vanligaste maligna hudtumörerna, särskilt hos kaukasier i geografiska områden nära ekvatorn, där den är förknippad med exponering för ultraviolett strålning hos ljushyade individer.7 I den allmänna befolkningen uppträder sjukdomen mellan det sjätte och sjunde decenniet i livet, och dess incidens har ökat avsevärt under de senaste åren. I den allmänna befolkningen uppträder sjukdomen mellan det sjätte och sjunde decenniet i livet och dess förekomst har ökat avsevärt under de senaste åren. Kronisk exponering för solljus är den främsta orsaken till basalcellscancer och därför förekommer skadorna i allmänhet på utsatta delar av kroppen: ansikte, öron, hals, hårbotten, axlar och rygg. Bland de kända etiologiska faktorerna finns bl.a. exponering för ultravioletta strålar (både på kort och lång sikt), vissa kemiska cancerframkallande ämnen (arsenik och kolväten), joniserande strålning och kronisk irritation. Det finns flera syndromformer, bland annat xeroderma pigmentosum och basalcellsnevoid syndrom (BNS).8.
Hanteringen av basalcellscancer i BNS är dåligt studerad och avser huvudsakligen konservativ behandling. Pauwels et al. presenterade fotodynamisk terapi som ett alternativ för behandling av basalcellscancer hos patienter med SGG med gynnsamma resultat jämfört med kirurgi9. Micali et al. analyserade betydelsen av topisk imiquimod för behandling av basalcellscancer hos patienter med SGG och framhöll denna terapeutiska modalitet som ett effektivt alternativ på grund av det höga antalet patienter som föredrar den framför flera kirurgiska excisioner10. I studier om behandling av basalcellscancer i den allmänna befolkningen är kirurgisk behandling (enkel excision med klinisk uppföljning av lesioner med marginalinflammation) viktigare än de andra behandlingsalternativen11-13. Även om beteendet hos basalcellscancer i den allmänna befolkningen skiljer sig från beteendet hos GTS, verkar det mer än rimligt att tillämpa den omfattande erfarenhet som vi har på dessa patienter tills andra specifika studier finns tillgängliga.
Bearbetning av basalcellscancer innebär ett fullständigt avlägsnande av lesionen, vilket kan utföras med flera olika metoder. Kirurgisk excision är det vanligaste ingreppet och det tycks råda konsensus om att detta är det bästa alternativet med tanke på den höga graden av bot, särskilt när det gäller små och medelstora lesioner. Andra alternativ (kryoterapi, elektrodesickation och curettage, strålbehandling, topisk kemoterapi etc.) används för patienter där kirurgi är kontraindicerat14 , antingen på grund av tumörens egenskaper (antal eller storlek) eller på grund av allmänna patientfaktorer (ålder, anestesirisk etc.). Eftersom dessa tumörer kan bli mycket aggressiva med perineural infiltration och multifokalitet, och särskilt vid återfall, kan de ibland kräva omfattande resektioner som lämnar defekter som kräver komplexa rekonstruktioner, vilket inträffade hos patient 4, där en mandibulär rekonstruktion utfördes med en mikrovaskulariserad fibula- och radiellapp.
Kirurgiskt avlägsnande av basalcellscancer har en botningsfrekvens på mer än 90 %. De kirurgiska marginalerna är väldefinierade, och bot anses föreligga om marginalerna är tydliga. Liksom vid andra former av behandling bidrar storlek, lokalisering och histologisk subtyp till den totala prognosen. Det finns ingen enhetlig rekommendation om gränsen för de kirurgiska marginalerna. De flesta kirurger väljer en marginal på minst 3 till 5 mm i både yta och djup för små, väl omskrivna lesioner och 1 cm eller mer för stora, aggressiva lesioner.
Hanteringen är kontroversiell i tumörer där den anatomiska patologirapporten visar att marginalerna är involverade. I olika studier av icke-syndromiska patienter har man rapporterat att det finns mellan 4 och 16,6 % positiva marginaler15-18. I vår serie hade 28 % av lesionerna histologiskt nära och/eller involverade marginaler, vilket är en hög andel jämfört med dem som rapporterats i den allmänna befolkningen. Litteraturen tyder på att huvud- och halsregionen har en högre grad av marginalinblandning, vilket kan förklaras av svårigheten att avlägsna tumörer utan att skada ädla anatomiska strukturer16,17. I stora serier med uppföljning av patienter med basalcellscancer har endast 25 % recidiv efter fem år observerats i lesioner med ofullständig resektion13. Konservativ behandling med efterföljande uppföljning och observation verkar vara det mest förnuftiga tillvägagångssättet i dessa fall19,20, med tanke på att endast 28-54 % av de angripna marginalerna uppvisas efter ett kirurgiskt ingrepp15-18. 15-18 Hos patienter med SGG verkar denna inställning till uppföljning och observation mycket tillrådlig för tumörer med nära och/eller positiva histologiska marginaler utan tecken på perineural utbredning och i områden som är lättillgängliga för undersökning, även med hänsyn till den höga sannolikheten för sporadisk uppkomst av nya karcinom och deras multidisciplinäritet, vilket kan kräva flera ytterligare kirurgiska ingrepp i området på lång sikt.
Mohs mikrografisk kirurgi är den kirurgiska behandlingen för återkommande lesioner på utsatta områden (ögonlock, ögonhålor, etc.)21. Den är också indicerad för tumörer som på grund av sina kliniska egenskaper (histologisk subtyp, dåligt definierade gränser, benägenhet att återkomma) eller sitt läge klassificeras som högrisk tumörer22. Fördelen ligger i metodiken som gör det möjligt att kontrollera operationsmarginalerna till 100 procent, både på djupet och på ytan. Detta kan i sin tur säkerställa fullständig resektion av tumören, garantera maximalt bevarande av frisk vävnad och i andra hand optimera den efterföljande rekonstruktionen.
Och även om SGG inte kan botas bidrar en tidig diagnos till att tillhandahålla ett multidisciplinärt tillvägagångssätt för att undvika komplikationer, t.ex. uppkomsten av nya basalcellscancer på grund av exponering för solstrålning eller multipla keratocystor som kan förstöra käkarna. Basalcellscancer är en elakartad tumör som inte bildar metastaser men som kan bli allvarligt aggressiv om den infiltrerar de djupare hudlagren. Med tanke på att kirurgisk excision är det mest effektiva alternativet vid behandling av basalcellscancer i SGG är det viktigt att ha ett förebyggande medicinskt tillvägagångssätt för att försöka behandla lesioner när de är små för att minska de postoperativa följderna. Även om det finns flera specialiteter som har stor erfarenhet av SGG, vilket framgår av det stora antalet publikationer, är primärvården frånvarande på detta område, vilket gör det nödvändigt att främja hälsoutbildning eller utbildning av yrkesverksamma inom denna sektor för att öka den tidiga diagnosen och därmed en tidig behandlingsstart och en förbättrad prognos. Resultaten av flera epidemiologiska studier har visat att risken för basalcellscancer har en stark positiv korrelation med UV-exponering och att dessa patienter därför bör undvika överdriven solexponering. På samma sätt bör strålbehandling om möjligt undvikas på grund av risken för uppkomst och återfall av basalcellscancer. Kemoprevention kan användas för att undvika hudskador. A-vitaminanaloger, såsom retinoider eller isotretinoin, kan ha en viktig roll när det gäller att förebygga eller fördröja utvecklingen av nya basalcellscancer.
Sammanfattningsvis är basalcellscancer hos patienter med GGS förknippade med förändringar i tumörundertryckningsmekanismen på grund av mutationer i PTCH-genen, vilket resulterar i att sådana tumörer uppträder sporadiskt, särskilt i förhållande till ultraviolett strålning. Det finns skillnader mellan de kliniska egenskaperna hos basalcellscancer hos patienter med SGG och i den allmänna befolkningen, främst när det gäller antalet lesioner (högre hos SGG), ålder vid presentation (lägre hos SGG) och beteende (högre aggressivitet och recidivfrekvens hos SGG). I vår genomgång av 11 patienter hade 36 % basalcellscancer i ansiktet. Den mest accepterade behandlingen i litteraturen är kirurgisk excision och detta var också den behandling som användes i alla våra fall. I vår serie hade 28 % av tumörerna nära och/eller komprometterade histologiska marginaler, vilket är en hög andel jämfört med serier i den icke-syndromiska populationen. Nya lesioner och återfall upptäcktes hos 100 % av patienterna efter den första behandlingen. De befintliga uppgifterna i litteraturen är otillräckliga för att fatta evidensbaserade beslut bland de olika terapier som finns tillgängliga för behandling av basalcellscancer i SGG. En förebyggande strategi för att undvika UV-exponering rekommenderas.
Etiskt ansvar
Skydd av människor och djur. Författarna förklarar att inga experiment på människor eller djur har utförts för denna forskning.
Datakonfidentialitet. Författarna förklarar att inga patientuppgifter förekommer i denna artikel.
Rätt till personlig integritet och informerat samtycke. Författarna förklarar att inga patientuppgifter förekommer i denna artikel.
Intressekonflikter
Författarna förklarar att de inte har några intressekonflikter.
Bibliografi
1. Gorlin RJ, Goltz RW. Multipel nevoid basalcellsepiteliom, käkcyste och bifid revben. Ett syndrom. N Engl J Med. 1960; 262:908-12.
2. Stoelinga PJ, Peters JH, van de Staak WJ, Cohen MM. Några nya rön om basalcellsnevussyndromet. Oral Surg Oral Med Oral Pathol. 1973; 36:686-92.
3. Totten JR. Det multipla nevoida basalcellscancersyndromet. Rapport om dess förekomst i fyra generationer i en familj. Cancer. 1980; 46:1456-62.
4. Visioli F, Martins CA, Heitz C, Rados PV, Sant’Ana Filho M. Är nevoid basalcellscarcinomsyndromet verkligen så sällsynt? Förslag till ett undersökningsprotokoll baserat på en fallserie. J Oral Maxillofac Surg. 2010; 68:903-8.
5. Evans DG, Ladusans EJ, Rimmer S, Burnell LD, Thakker N, Farndon PA. Komplikationer vid nevoid basalcellscancer-syndromet: resultat av en befolkningsbaserad studie. J Med Genet. 1993; 30:460-4.
6. Díaz-Fernández JM, Infante-Cossío P, Belmonte-Caro R, Ruiz-Laza L, García-Perla-García A, Gutiérrez-Pérez JL. Basalcellsnevussyndromet. Presentation av sex fall och litteraturgenomgång. Med Oral Patol Oral Cir Bucal. 2005; 10 Suppl 1:E57-66.
7. Roewert-Huber J, Lange-Asschenfeldt B, Stockfleth E, Kerl H. Epidemiologi och etiologi för basalcellscancer. Br J Dermatol. 2007; 157 Suppl 2:47-51.
8. Kyrgidis A, Tzellos TG, Vahtsevanos K, Triaridis S. Nya koncept för basalcellscancer. Demografiska, kliniska, histologiska riskfaktorer och biomarkörer. En systematisk genomgång av bevisen för risk för tumörutveckling, benägenhet för andra primära tumörer och återfall. J Surg Res. 2010; 159:545-56.
9. Pauwels C, Mazereeuw-Hautier J, Basset-Seguin N, Livideanu C, Viraben R, Paul C, et al. Topisk fotodynamisk terapi med metylaminolevulinat för behandling av basalcellskarcinom hos patienter med basalcellsnevussyndrom förbättrar patientens tillfredsställelse och minskar behovet av kirurgiska ingrepp. J Eur Acad Dermatol Venereol. 2011; 25:861-4.
10. Micali G, de Pasquale R, Caltabiano R, Impallomeni R, Lacarrubba F. Topisk imiquimodbehandling av ytliga och nodulära basalcellskarcinom hos patienter som drabbats av basalcellsnevussyndromet: en preliminär rapport. J Dermatolog Treat. 2002; 13:123-7.
11. Chren MM, Torres JS, Stuart SE, Bertenthal D, Labrador RJ, Boscardin WJ. Recidiv efter behandling av icke melanom hudcancer: en prospektiv kohortstudie. Arch Dermatol. 2011; 147:540-6.
12. Wallace DL, Jaffe W. Reply to: Do basalcellscancer recurras efter fullständig konventionell kirurgisk excision? R.W. Griffiths, S.K., Suvarna. J. Stone BJPS. 2005; 58:795-805. J Plast Reconstr Aesthet Surg 2006;59:1247.
13. Sherry KR, Reid LA, Wilmshurst AD. En femårig översyn av excisioner av basalcellscancer. J Plast Reconstr Aesthet Surg. 2010; 63:1485-9.
14. Kopera D, Cerroni L, Fink-Puches R, Kerl H. Olika behandlingsmodaliteter för hantering av en patient med nevoid basalcellscancer-syndromet. J Am Acad Dermatol. 1996; 34:937-9.
15. Patel SS, Cliff SH, Ward Booth P. Incomplete removal of basal cell carcinoma: what is the value of further surgery? Oral Maxillofac Surg. 2012. (Epub före tryckning).
16. Farhi D, Dupin N, Palangié A, Carlotti A, Avril MF. Inkomplett excision av basalcellscancer: frekvens och associerade faktorer bland 362 konsekutiva fall. Dermatol Surg. 2007; 33:1207-14.
17. Bogdanov-Berezovsky A, Cohen A, Glesinger R, Cagnano E, Krieger Y, Rosenberg L. Kliniska och patologiska fynd vid reexcision av ofullständigt exciserade basalcellscancer. Ann Plast Surg. 2001; 47:299-302.
18. Kumar P, Orton CI, McWilliam LJ, Watson S. Incidence of incomplete excision in surgically treated basal cell carcinoma: a retrospective clinical audit. Br J Plast Surg. 2000; 53:563-6.
19. Griffiths RW, Suvarna SK, Stone J. Basalcellskarcinom: en analys av 1539 konventionellt exciderade tumörer. Ännu bredare och djupare? J Plast Reconstr Aesthet Surg. 2007; 60:41-7.
20. Anthony ML. Kirurgisk behandling av icke-melanom hudcancer. AORN J. 2000; 71:552-4. 556-8, 560-4.
21. Mosterd K, Krekels GA, Nieman FH, Ostertag JU, Essers BA, Dirksen CD, et al. Surgical excision versus Mohs’ micrographic surgery for primary and recurrent basal-cell carcinoma of the fa a prospective randomised controlled trial with 5-years’ follow-up. Lancet Oncol. 2008; 9:1149-56.
22. Galimberti G, Pontón Montaño A, Ferrario D, Kowalczuk A, Galimberti R. Mohs micrographic surgery for the treatment of basal cell carcinoma. Actas Dermosifiliogr. 2010; 101:853-7.