ORIGINAL
Gorlin-Goltz-Syndrom: Behandlung von Basalzellkarzinomen im Gesicht
Gorlin-Goltz-Syndrom: Behandlung des Basalzellkarzinoms im Gesicht
Rocío Gilabert Rodrígueza, Pedro Infante Cossíob, Pablo Redondo Parejob, Eusebio Torres Carranzab, Alberto García-Perla Garcíab und Domingo Sicilia Castroa
aService of Plastic and Reconstructive Surgery, Hospital Universitario Virgen del Rocío, Sevilla, Spanien
bService of Oral and Maxillofacial Surgery, Hospital Universitario Virgen del Rocío, Sevilla, Spanien
Address for correspondence
SUMMARY
Introduction/Objective: Das Gorlin-Goltz-Syndrom (GGS) ist eine autosomal-dominant vererbte Störung, die in erster Linie zur Ausbreitung von Tumoren wie Basalzellkarzinomen und Oberkieferkeratozysten prädisponiert. Sie wird durch eine Mutation des Patched-Gens auf Chromosom 9 verursacht. Basalzellkarzinome, die bei Patienten mit GGS auftreten, sind in der Regel multipel, haben ein klinisch polymorphes Erscheinungsbild, sind nicht geschlechtsspezifisch, werden manchmal schon früh im Leben entdeckt und betreffen auch Bereiche, die nicht dem Sonnenlicht ausgesetzt sind. Ihr klinisches Verhalten ist variabel, obwohl sie manchmal sehr aggressiv sein können, insbesondere im Gesicht. Um das Verhalten von Basalzellkarzinomen bei Patienten mit GCS zu untersuchen, wurde eine Studie mit Patienten durchgeführt, die zwischen 2001 und 2011 in unserem Krankenhaus behandelt wurden und die Kriterien für diese Krankheit erfüllten.
Material und Methoden: 11 Patienten mit einer klinischen und/oder genetischen Diagnose von GGG wurden eingeschlossen. Wir untersuchten die Verteilung nach Alter und Geschlecht, klinischen Manifestationen, histologischen Merkmalen, angewandter Operationstechnik, Vorhandensein eines Rezidivs und der Entwicklung der Patienten.
Ergebnisse: 36% der Patienten hatten ein Basalzellkarzinom im Gesicht. Die Anzahl der Tumore pro Patientin schwankte zwischen 9 und 21. Die chirurgische Entfernung war die bevorzugte Behandlung, obwohl alle Patienten neue Läsionen und Rezidive entwickelten, die mehrere Eingriffe erforderten. Die histologische Untersuchung ergab, dass der Tumor in 28 % der Läsionen in Kontakt oder in der Nähe der chirurgischen Ränder stand.
Schlussfolgerungen: In der Literatur gibt es keine ausreichenden Belege, um die Behandlung der Wahl unter den verschiedenen Methoden zur Behandlung des Basalzellkarzinoms bei SGG zu bestimmen. Ein präventiver Ansatz zur Vermeidung von Sonnenexposition ist notwendig.
Schlüsselwörter: Gorlin-Goltz-Syndrom. Syndrom des nevoiden Basalzellkarzinoms. Basalzellkarzinom. Queratoquiste maxilar.
ABSTRACT
Einführung/Ziel: Das Gorlin-Goltz-Syndrom (GGS) ist eine autosomal-dominant vererbte Störung, die vor allem zur Ausbreitung von Tumoren, wie Basalzellkarzinomen und Kieferkeratozysten, prädisponiert. GGS wird durch die Mutation des Patched-Gens auf Chromosom 9 verursacht. Basalzellkarzinome bei Patienten mit GGS treten in der Regel als multiple Tumore auf, mit polymorphen klinischen Merkmalen, einer nicht geschlechtsspezifischen Prädilektion, die manchmal in den frühen Lebensphasen auftreten und sogar Bereiche betreffen, die nicht dem Sonnenlicht ausgesetzt sind. Das klinische Verhalten kann variieren und manchmal sehr aggressiv sein, insbesondere im Gesicht. Um das Verhalten von Basalzellkarzinomen bei GGS-Patienten zu untersuchen, wurde eine Studie an den Patienten durchgeführt, die die Kriterien für die Krankheit erfüllten und in unserem Krankenhaus im Zeitraum zwischen 2001 und 2011 behandelt wurden.
Material und Methoden: Die Studie umfasste 11 Patienten mit klinischer und/oder genetischer Diagnose von GGS. Die Patienten wurden nach Geschlecht und Alter, klinischen Aspekten, histologischen Merkmalen, durchgeführter chirurgischer Behandlung, Vorhandensein eines Rezidivs und Nachuntersuchungen untersucht.
Ergebnisse: Bei 36 % der Patienten wurden Basalzellkarzinome im Gesicht festgestellt. Die Anzahl der Tumore pro Patient lag zwischen 9 und 21. Die bevorzugte Behandlung war die chirurgische Exzision, obwohl alle Patienten neue Läsionen und Rezidive entwickelten, die mehrere Eingriffe erforderten. Die histologische Untersuchung ergab bei 28 % der Läsionen einen Kontakt oder eine Nähe des Tumors zu den Operationsrändern.
Schlussfolgerungen: In der Literatur gibt es keine ausreichenden Belege, um die Behandlung der Wahl unter den verschiedenen verfügbaren Methoden zur Behandlung des Basalzellkarzinoms bei GGS zu bestimmen. Ein präventiver Ansatz ist notwendig, um Sonnenlicht zu vermeiden.
Schlüsselwörter: Gorlin-Goltz-Syndrom. Nevoides Basalzellkarzinom-Syndrom. Basalzellkarzinom. Kieferkeratozyste.
Einführung
Das Gorlin-Goltz-Syndrom (GGS) wurde 1960 von seinen Namensgebern, Gorlin und Goltz1, beschrieben. Sie beschrieben zunächst die Trias, die das Syndrom charakterisiert: multiple Basalzellkarzinome, Keratozysten im Oberkiefer und bifide Rippen. Es handelt sich um eine genetisch bedingte Erkrankung mit autosomal-dominantem Erbgang, unvollständiger Penetranz und variablem Phänotyp2,3, die unter anderem auch als Naevoid-Basalzell-Syndrom oder Naevoid-Basalzell-Karzinom-Syndrom bekannt ist. Sie wird durch eine Mutation des Patched-Gens (PTCH) verursacht, einem Tumorsuppressor-Gen auf Chromosom 9 (9q22, 3-q31). Die geschätzte Prävalenz schwankt je nach Land zwischen 1:57.000 und 1:164.000, mit einer allgemein akzeptierten mittleren Prävalenz von etwa 1:60.0004.
GGS ist eine Krankheit, die klinisch durch eine Prädisposition für die Entwicklung multipler Neoplasmen sowie durch das Auftreten von Entwicklungsanomalien gekennzeichnet ist. Der klinische Ausbruch erfolgt im Kindes- oder Jugendalter und wird von einer Reihe von Manifestationen begleitet, von denen die häufigsten das Vorhandensein zahlreicher Basalzellkarzinome und odontogener Keratozysten im Oberkiefer sind. Weitere Erscheinungsformen sind palmoplantare Hyperkeratose, Skelettanomalien, ektopische intrakranielle Verkalkungen und Gesichtsdysmorphien (Makrozephalie, Lippen-Kiefer-Gaumenspalten und schwere Augenanomalien)5. Ein intellektuelles Defizit liegt in etwa 5 % der Fälle vor. Es können auch Augen-, Urogenital- und Herz-Kreislauf-Probleme auftreten6 . Bösartige Medulloblastome entwickeln sich bei 5-10 % der Patienten mit GGS und können eine mögliche Ursache für einen frühen Tod sein. Die Diagnose wird gestellt, wenn 2 wichtige oder 1 wichtiges und 2 weniger wichtige klinische Kriterien erfüllt sind5 (Tabelle 1). Der definitive diagnostische Test ist der Nachweis einer Mutation im PTCH-Gen.

Tumore entstehen im SGG durch veränderte Pro-Onkogene oder Tumorsuppressor-Gene. Letztere üben eine Suppressorfunktion auf Pro-Onkogene aus. Beim Basalzellkarzinom ist nicht klar, welches Pro-Onkogen beteiligt ist. Der RAS-Signalweg ist verändert, aber nicht in allen Fällen. Was die Tumorsuppressorgene betrifft, so scheint p53 bei der Entstehung dieses Tumors eine untergeordnete Rolle zu spielen. Die Prädisposition dieser Patienten für Hautkarzinome scheint darauf zurückzuführen zu sein, dass die von der Mutation betroffenen Zellen aufgrund veränderter DNA-Reparaturmechanismen anfälliger für Sonnenlicht sind. Basalzellkarzinome können in allen Bereichen der Hautanatomie auftreten, vor allem aber in Bereichen, die ultravioletter Strahlung ausgesetzt sind, vor allem im Gesicht, am Rücken und auf der Brust. Es gibt gewisse Unterschiede zwischen Basalzellkarzinomen in der Allgemeinbevölkerung und bei Patienten mit GBS. Bei letzteren sind sie häufiger zahlreich, haben ein polymorphes Aussehen, sind geschlechtsunabhängig und können auch Bereiche befallen, die nicht dem Sonnenlicht ausgesetzt sind. Klinisch treten sie in der Regel in multiplen Formen auf6 , in einer Anzahl von einigen wenigen bis zu Hunderten, und erscheinen früh im Leben (sogar schon bei der Geburt); ihr klinisches Verhalten ist variabel, obwohl sie manchmal von Anfang an sehr aggressiv sein können, insbesondere im Gesichtsbereich.
Die meisten klinischen Erkenntnisse über die Behandlung von Basalzellkarzinomen bei GTS stammen aus Studien, die an Patienten durchgeführt wurden, die nicht von dem Syndrom betroffen sind. Aufgrund der umfangreichen Erfahrungen mit diesen Tumoren in der Allgemeinbevölkerung wenden die meisten Autoren die gleichen therapeutischen Maßnahmen bei Patienten mit GBS an.
Ziel dieser Studie war es, die Behandlung von Basalzellkarzinomen im Gesicht bei Patienten mit GBS zu analysieren, um das klinische Verhalten und die diagnostischen und therapeutischen Kriterien auf der Grundlage einer klinischen Studie von Patienten, die in den letzten 10 Jahren am Hospital Universitario Virgen del Rocío in Sevilla (Spanien) mit GBS behandelt wurden, zu bewerten.
Materialien und Methoden
Die klinischen Aufzeichnungen von Patienten, bei denen zwischen 2001 und 2011 in den Abteilungen für Mund-, Kiefer- und Gesichtschirurgie sowie für plastische und rekonstruktive Chirurgie ein GTS diagnostiziert wurde, wurden in einer beobachtenden und retrospektiven Weise untersucht. Elf Patienten mit einer klinischen und/oder genetischen GGS-Diagnose wurden in die Studie aufgenommen, wobei diejenigen ausgeschlossen wurden, bei denen die klinische Anamnese unvollständig war, obwohl die Diagnose gestellt wurde. Analysiert wurden epidemiologische Daten (Alter und Geschlecht) und medizinisch-chirurgische Daten (Anzahl und Lage der Läsionen, histopathologische Diagnose, angewandte Operationstechnik, Vorhandensein von Rezidiven und Entwicklung). Die klinische Nachbeobachtung erfolgte durch regelmäßige Kontrolluntersuchungen über einen Zeitraum von durchschnittlich 4,5 Jahren.
Ergebnisse
Das Durchschnittsalter der Patienten betrug 27 Jahre, wobei die Mehrheit Männer waren (73 %). In 45 % der Fälle lag das Alter bei der Diagnose unter 20 Jahren. Bei 9 Patienten wurde eine klinische Diagnose gestellt (2 Haupt- oder 1 Haupt- und 2 Nebenkriterien), während bei 2 Patienten eine genetische Diagnose gestellt wurde. Drei Patienten hatten eine Familienanamnese (Tabelle 2).

In Bezug auf die klinischen Merkmale (Tabelle 3) war die Oberkieferkeratozyste das häufigste klinische Zeichen und trat bei 91 % der Stichprobe (10 Patienten) auf. Es folgten Skelettveränderungen (63 %) und eine charakteristische Fasziitis (54 %). Vier der 11 Patienten (36 %) entwickelten Basalzellkarzinome (Tabelle 4). Die Anzahl der Läsionen pro Patient lag zwischen 9 und 21, wobei die genaue Anzahl der Läsionen bei einem Patienten nicht erfasst wurde. Alle befanden sich hauptsächlich im Gesichtsbereich (Abb. 1 und 2), gefolgt von Hals und Rücken. Die chirurgische Entfernung der Läsionen wurde in allen Fällen durchgeführt (Abb. 3). Die Pathologie ergab in den meisten Fällen eine knotige Histologie, und ein hoher Anteil der chirurgischen Ränder war betroffen (28 % der Läsionen hatten Kontakt oder Nähe des Tumors zum Rand). In allen Fällen wurde mehr als ein chirurgischer Eingriff durchgeführt.

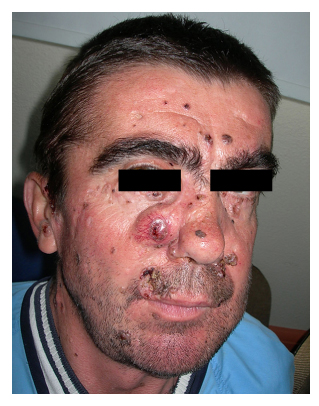
Abbildung 1: Patient Nummer 6.
Mehrere Basalzellkarzinome im Gesicht.
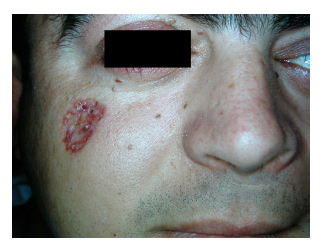
Abbildung 2. Patient Nummer 2 mit
Basalzellkarzinom auf der Wange.

Abbildung 3: Patient Nummer 1.
A: Präoperatives Bild von multiplen Basalzellkarzinomen im Gesicht und am Hals.
B: Unmittelbares postoperatives Detail nach der Exzision.
Patient Nummer 4 entwickelte multiple rezidivierende Basalzellkarzinome im unteren Gesichtsdrittel, die eine aggressive Exzision einschließlich Mandibulektomie und sofortige Rekonstruktion mit 2 aufeinanderfolgenden freien Lappen (osteoseptokutane Fibula und antebrachiale Fasziokutane) erforderten (Abb. 4). Patient Nummer 6 stellte sich mit einem Epidermoidkarzinom am Unterkieferkörper in Verbindung mit einer Keratozyste vor und starb an den Folgen.

Abbildung 4. A: Rezidivierende Basalzellkarzinome im unteren Drittel des Gesichts.
B: 3D-CT-Rekonstruktion mit Knochen- und perineuraler Beteiligung.
C: Aggressive Exzision mit Mandibulektomie.
D: Komplexe Rekonstruktion mit 2 aufeinanderfolgenden freien Lappen
(osteoseptokutane Fibula und antebrachiale Fasziokutane mit Palmaris-Minor-Sehne).
E: Postoperatives Panoramaröntgenbild.
F: Postoperatives Bild des Patienten.
Diskussion
Als Ausgangspunkt wurde eine Literaturübersicht durchgeführt, um die in den letzten 10 Jahren veröffentlichten wissenschaftlichen Informationen über das SGG auszuwerten, die ein wachsendes Interesse an diesem Thema erkennen ließ, vor allem in Zeitschriften aus den Bereichen Dermatologie, Mund-, Kiefer- und Gesichtschirurgie, Zahnmedizin und Genetik. Die meisten Artikel sind in dermatologischen Fachzeitschriften zu finden, möglicherweise weil Basalzellkarzinome zu den häufigsten und am häufigsten wiederkehrenden Läsionen gehören und sich an einer Stelle befinden (insbesondere auf der Gesichtshaut), an der sie besser sichtbar und leichter zu diagnostizieren sind. Die nächste Gruppe von Zeitschriften, in der Reihenfolge ihrer Häufigkeit, sind die Zeitschriften aus den Bereichen Mund-, Kiefer- und Gesichtschirurgie, Zahnmedizin und Genetik. Keratozysten im Oberkiefer sind die häufigsten Läsionen bei diesem Syndrom und sind oft das Leitsymptom, das zur Diagnose führt.
In unserer Serie, über die in der Literatur viel berichtet wird, war die Keratozyste im Oberkiefer das häufigste klinische Zeichen bei 10 Patienten. Nur ein Patient hatte keine Keratozysten im Oberkiefer, obwohl das junge Alter dieses Patienten die fehlende Zeit für ihre Entwicklung erklären könnte (Patient Nummer 7). Obwohl in der Literatur keine geschlechtsspezifische Vorliebe beschrieben wird, überwiegt eindeutig die männliche Beteiligung, so dass angesichts der geringen Stichprobengröße keine Schlussfolgerungen daraus gezogen werden können. Es gibt vier typische Fälle von SGG mit hoher phänotypischer Ausprägung (Patientennummern 1, 2, 4 und 6), bei denen die vorherrschenden klinischen Manifestationen (Keratozysten im Oberkiefer und Basalzellkarzinome) zu beobachten sind. Obwohl in den meisten Fällen von einem betroffenen Elternteil ausgegangen wird, ist dies in unserer Serie nicht der Fall, da nur 3 Patienten (27 im Vergleich zu den 70-80 % in der Literatur) mindestens ein betroffenes Familienmitglied haben, das uns bekannt ist (Tabelle 2). Vier der 11 Patienten mit SGG entwickelten ein Basalzellkarzinom. Dies entspricht einem Anteil von 36 %, ein geringer Prozentsatz im Vergleich zu den 90 %, die klassischerweise für diese Krankheit gelten. Es ist wichtig, das junge Alter einiger der Patienten zu beachten. Obwohl diese Läsionen bei diesem Syndrom bereits bei der Geburt beschrieben wurden, ist dies nicht die Norm, und für die klinische Ausprägung sind mehrere Jahre der Exposition gegenüber Risikofaktoren (ultraviolette Strahlung) erforderlich. Das Durchschnittsalter der Patienten mit Basalzellkarzinom in dieser Serie lag jedoch bei 39 Jahren (der jüngste Patient war 19 Jahre alt).
Das Basalzellkarzinom gilt als einer der häufigsten bösartigen Hauttumore, insbesondere bei Kaukasiern in äquatornahen Regionen, wo es bei hellhäutigen Menschen mit der Exposition gegenüber ultravioletter Strahlung in Verbindung gebracht wird.7 In der Allgemeinbevölkerung tritt diese Erkrankung zwischen dem sechsten und siebten Lebensjahrzehnt auf, und ihre Häufigkeit hat in den letzten Jahren erheblich zugenommen. In der Allgemeinbevölkerung tritt diese Krankheit zwischen dem sechsten und siebten Lebensjahrzehnt auf, und ihre Häufigkeit hat in den letzten Jahren erheblich zugenommen. Chronische Sonneneinstrahlung ist die Hauptursache für das Basalzellkarzinom. Daher treten die Läsionen in der Regel an exponierten Körperstellen auf: Gesicht, Ohren, Nacken, Kopfhaut, Schultern und Rücken. Zu den bekannten ätiologischen Faktoren gehören u. a. die Exposition gegenüber ultravioletter Strahlung (sowohl kurz- als auch langfristig), bestimmte chemische Karzinogene (Arsen und Kohlenwasserstoffe), ionisierende Strahlung und chronische Reizung. Es gibt mehrere syndromale Formen, darunter Xeroderma pigmentosum und das Basalzellnävoid-Syndrom (BNS)8.
Die Behandlung des Basalzellkarzinoms bei BNS ist wenig erforscht und bezieht sich hauptsächlich auf eine konservative Behandlung. Pauwels et al. stellten die photodynamische Therapie als eine Option für die Behandlung von Basalzellkarzinomen bei Patienten mit SGG vor, die im Vergleich zur Operation günstige Ergebnisse erzielte9. Micali et al. analysierten die Rolle von topischem Imiquimod bei der Behandlung von Basalzellkarzinomen bei Patienten mit SGG und hoben diese Therapieform als wirksame Option hervor, da viele Patienten sie einer mehrfachen chirurgischen Entfernung vorziehen10. In Studien über die Behandlung von Basalzellkarzinomen in der Allgemeinbevölkerung hebt sich die chirurgische Behandlung (einfache Exzision mit klinischer Nachuntersuchung von Läsionen mit Randbefall) von den anderen Therapieoptionen ab11-13. Obwohl sich das Verhalten des Basalzellkarzinoms in der Allgemeinbevölkerung von dem der GTS unterscheidet, scheint es bis zum Vorliegen weiterer spezifischer Studien mehr als vernünftig, die umfangreichen Erfahrungen, die wir haben, auf diese Patienten anzuwenden.
Die Behandlung von Basalzellkarzinomen beinhaltet die vollständige Entfernung der Läsion, die mit verschiedenen Methoden durchgeführt werden kann. Die chirurgische Exzision ist das am häufigsten angewandte Verfahren, und es scheint ein Konsens darüber zu bestehen, dass dies angesichts der hohen Heilungsrate, insbesondere bei kleinen und mittelgroßen Läsionen, die beste Option ist. Andere Optionen (Kryotherapie, Elektrodesikkation und Kürettage, Strahlentherapie, topische Chemotherapie usw.) werden bei Patienten eingesetzt, bei denen eine Operation kontraindiziert ist14 , entweder aufgrund der Merkmale des Tumors (Anzahl oder Größe) oder aufgrund allgemeiner Patientenfaktoren (Alter, Narkoserisiko usw.). Da diese Tumoren mit perineuraler Infiltration und Multifokalität sehr aggressiv werden können, und insbesondere in Fällen von Rezidiven, können sie manchmal umfangreiche Resektionen erfordern, die Defekte hinterlassen, die komplexe Rekonstruktionen erfordern, wie bei Patient 4, bei dem eine Unterkieferrekonstruktion mit einem mikrovaskularisierten Fibula- und Radialislappen durchgeführt wurde.
Die chirurgische Entfernung von Basalzellkarzinomen hat eine Heilungsrate von mehr als 90 %. Die chirurgischen Ränder sind gut definiert, und eine Heilung ist möglich, wenn die Ränder klar sind. Wie bei anderen Behandlungsformen tragen auch hier Größe, Lokalisation und histologischer Subtyp zur Gesamtprognose bei. Es gibt keine einheitliche Empfehlung für die Begrenzung der Operationsränder. Die meisten Chirurgen wählen einen Rand von mindestens 3 bis 5 mm in Fläche und Tiefe für kleine, gut umschriebene Läsionen und 1 cm oder mehr für große, aggressive Läsionen.
Die Behandlung von Tumoren, bei denen der anatomisch-pathologische Bericht darauf hinweist, dass die Ränder betroffen sind, ist umstritten. In verschiedenen Studien bei nicht-syndromalen Patienten wurde eine positive Randbeteiligung zwischen 4 und 16,6 % festgestellt15-18. In unserer Serie wiesen 28 % der Läsionen histologisch enge und/oder beteiligte Ränder auf, eine hohe Rate im Vergleich zu den in der Allgemeinbevölkerung berichteten Werten. Aus der Literatur geht hervor, dass die Kopf-Hals-Region eine höhere Rate an Randbeteiligungen aufweist, was durch die Schwierigkeit erklärt werden kann, Tumore zu entfernen, ohne edle anatomische Strukturen zu beschädigen16,17. In großen Serien mit Nachbeobachtung von Patienten mit Basalzellkarzinomen wurde bei Läsionen mit unvollständiger Resektion nur eine Rezidivrate von 25 % nach 5 Jahren beobachtet13. Eine konservative Behandlung mit anschließender Nachsorge und Beobachtung scheint in diesen Fällen am sinnvollsten zu sein19,20, wenn man bedenkt, dass nach einer erneuten chirurgischen Intervention nur 28-54 % der betroffenen Ränder nachweisbar sind15-18. 15-18 Bei Patienten mit SGG scheint diese Haltung der Nachsorge und Beobachtung bei Tumoren mit engen und/oder positiven histologischen Rändern ohne Anzeichen einer perineuralen Ausdehnung und in leicht zugänglichen Bereichen sehr ratsam zu sein, auch in Anbetracht der hohen Wahrscheinlichkeit des sporadischen Auftretens neuer Karzinome und ihrer Multidisziplinarität, die langfristig mehrere zusätzliche chirurgische Eingriffe in diesem Bereich erfordern kann.
Die mikrographische Chirurgie nach Mohs ist die chirurgische Behandlung der Wahl bei rezidivierenden Läsionen in gefährdeten Bereichen (Augenlider, Orbitaränder usw.)21. Sie ist auch bei Tumoren indiziert, die aufgrund ihrer klinischen Merkmale (histologischer Subtyp, schlecht definierte Grenzen, Neigung zu Rezidiven) oder ihrer Lage als risikoreich eingestuft werden22. Sein Vorteil liegt in der Methodik des Verfahrens, die eine 100%ige Kontrolle der Operationsränder sowohl in der Tiefe als auch an der Oberfläche ermöglicht. Dies wiederum kann eine vollständige Resektion des Tumors gewährleisten, eine maximale Erhaltung des gesunden Gewebes garantieren und in zweiter Linie die anschließende Rekonstruktion optimieren.
Auch wenn SGG nicht geheilt werden kann, trägt eine frühzeitige Diagnose zu einem multidisziplinären Ansatz bei, um Komplikationen wie das Auftreten neuer Basalzellkarzinome aufgrund von Sonneneinstrahlung oder multipler Keratozysten, die die Kiefer zerstören können, zu vermeiden. Das Basalzellkarzinom ist ein bösartiger Tumor, der keine Metastasen bildet, aber sehr aggressiv sein kann, wenn er in die tieferen Schichten der Haut eindringt. Da die chirurgische Entfernung die wirksamste Option bei der Behandlung von Basalzellkarzinomen im SGG ist, ist es wichtig, einen präventiven medizinischen Ansatz zu verfolgen und zu versuchen, Läsionen zu behandeln, wenn sie noch klein sind, um postoperative Folgen zu reduzieren. Obwohl es mehrere Fachrichtungen gibt, die über umfangreiche Erfahrungen mit SGG verfügen, wie die große Zahl von Veröffentlichungen zeigt, ist die Primärversorgung in diesem Bereich nicht vertreten. Dabei wäre es notwendig, die Gesundheitserziehung oder die Ausbildung von Fachkräften in diesem Bereich zu fördern, um die Frühdiagnose zu verbessern und folglich eine frühzeitige Einleitung der Behandlung und eine bessere Prognose zu ermöglichen. Die Ergebnisse mehrerer epidemiologischer Studien deuten darauf hin, dass das Risiko eines Basalzellkarzinoms stark positiv mit der UV-Exposition korreliert, weshalb diese Patienten eine übermäßige Sonnenexposition vermeiden sollten. Ebenso sollte eine Strahlentherapie wegen des Risikos des Auftretens und Wiederauftretens von Basalzellkarzinomen möglichst vermieden werden. Die Chemoprävention kann zur Vermeidung von Hautläsionen eingesetzt werden. Vitamin-A-Analoga wie Retinoide oder Isotretinoin könnten eine wichtige Rolle bei der Vorbeugung oder Verzögerung der Entwicklung neuer Basalzellkarzinome spielen.
Zusammenfassend lässt sich sagen, dass Basalzellkarzinome bei Patienten mit GGS mit Veränderungen im Tumorsuppressionsmechanismus aufgrund von Mutationen im PTCH-Gen in Verbindung gebracht werden, was zu einem sporadischen Auftreten solcher Tumore insbesondere in Verbindung mit ultravioletter Strahlung führt. Es gibt Unterschiede zwischen den klinischen Merkmalen von Basalzellkarzinomen bei Patienten mit SGG und in der Allgemeinbevölkerung, vor allem in Bezug auf die Anzahl der Läsionen (höher bei SGG), das Alter bei der Präsentation (niedriger bei SGG) und das Verhalten (höhere Aggressivität und Rezidivrate bei SGG). In unserer Untersuchung von 11 Patienten wiesen 36 % ein Basalzellkarzinom im Gesicht auf. Die in der Literatur am meisten akzeptierte Behandlung ist die chirurgische Exzision, die auch in allen unseren Fällen angewandt wurde. In unserer Serie wiesen 28 % der Tumore enge und/oder beeinträchtigte histologische Ränder auf, eine hohe Rate im Vergleich zu Serien in der nicht-syndromalen Bevölkerung. Neue Läsionen und Rezidive wurden bei 100 % der Patienten nach der Erstbehandlung festgestellt. Die vorhandenen Daten in der Literatur sind unzureichend, um eine evidenzbasierte Entscheidung zwischen den verschiedenen verfügbaren Therapien für die Behandlung des Basalzellkarzinoms bei SGG zu treffen. Es wird ein präventiver Ansatz zur Vermeidung von UV-Exposition empfohlen.
Ethische Verantwortung
Schutz von Mensch und Tier. Die Autoren erklären, dass für diese Forschung keine Versuche an Menschen oder Tieren durchgeführt wurden.
Datenschutz. Die Autoren erklären, dass keine Patientendaten in diesem Artikel erscheinen.
Recht auf Privatsphäre und informierte Zustimmung. Die Autoren erklären, dass keine Patientendaten in diesem Artikel erscheinen.
Interessenkonflikt
Die Autoren erklären, dass sie keinen Interessenkonflikt haben.
Bibliographie
1. Gorlin RJ, Goltz RW. Mehrfaches nävoides Basalzellenepitheliom, Kieferzyste und bifide Rippe. Ein Syndrom. N Engl J Med. 1960; 262:908-12.
2. Stoelinga PJ, Peters JH, van de Staak WJ, Cohen MM. Einige neue Erkenntnisse über das Basalzellnävus-Syndrom. Oral Surg Oral Med Oral Pathol. 1973; 36:686-92.
3. Totten JR. Das Syndrom der multiplen nävoiden Basalzellkarzinome. Bericht über sein Auftreten in vier Generationen einer Familie. Krebs. 1980; 46:1456-62.
4. Visioli F, Martins CA, Heitz C, Rados PV, Sant’Ana Filho M. Is nevoid basal cell carcinoma syndrome really so rare? Vorschlag für ein Untersuchungsprotokoll auf der Grundlage einer Fallserie. J Oral Maxillofac Surg. 2010; 68:903-8.
5. Evans DG, Ladusans EJ, Rimmer S, Burnell LD, Thakker N, Farndon PA. Komplikationen des nevoiden Basalzellkarzinom-Syndroms: Ergebnisse einer bevölkerungsbasierten Studie. J Med Genet. 1993; 30:460-4.
6. Díaz-Fernández JM, Infante-Cossío P, Belmonte-Caro R, Ruiz-Laza L, García-Perla-García A, Gutiérrez-Pérez JL. Basalzell-Nävus-Syndrom. Vorstellung von sechs Fällen und Literaturübersicht. Med Oral Patol Oral Cir Bucal. 2005; 10 Suppl 1:E57-66.
7. Roewert-Huber J, Lange-Asschenfeldt B, Stockfleth E, Kerl H. Epidemiologie und Ätiologie des Basalzellkarzinoms. Br J Dermatol. 2007; 157 Suppl 2:47-51.
8. Kyrgidis A, Tzellos TG, Vahtsevanos K, Triaridis S. New concepts for basal cell carcinoma. Demographische, klinische, histologische Risikofaktoren und Biomarker. Eine systematische Übersicht über das Risiko für die Tumorentwicklung, die Anfälligkeit für ein zweites Primärtumor und ein Rezidiv. J Surg Res. 2010; 159:545-56.
9. Pauwels C, Mazereeuw-Hautier J, Basset-Seguin N, Livideanu C, Viraben R, Paul C, et al. Topical methyl aminolevulinate photodynamic therapy for management of basal cell carcinomas in patients with basal cell nevus syndrome improves patient’s satisfaction and reduces the need for surgical procedures. J Eur Acad Dermatol Venereol. 2011; 25:861-4.
10. Micali G, de Pasquale R, Caltabiano R, Impallomeni R, Lacarrubba F. Topical imiquimod treatment of superficial and nodular basal cell carcinomas in patients affected by basal cell nevus syndrome: a preliminary report. J Dermatolog Treat. 2002; 13:123-7.
11. Chren MM, Torres JS, Stuart SE, Bertenthal D, Labrador RJ, Boscardin WJ. Recurrence after treatment of nonmelanoma skin cancer: a prospective cohort study. Arch Dermatol. 2011; 147:540-6.
12. Wallace DL, Jaffe W. Reply to: Do basal cell carcinomas recurrence after complete conventional surgical excision? R.W. Griffiths, S.K., Suvarna. J. Stone BJPS. 2005; 58:795-805. J Plast Reconstr Aesthet Surg 2006;59:1247.
13. Sherry KR, Reid LA, Wilmshurst AD. Ein Fünfjahresrückblick auf Basalzellkarzinomexzisionen. J Plast Reconstr Aesthet Surg. 2010; 63:1485-9.
14. Kopera D, Cerroni L, Fink-Puches R, Kerl H. Different treatment modalities for the management of a patient with the nevoid basal cell carcinoma syndrome. J Am Acad Dermatol. 1996; 34:937-9.
15. Patel SS, Cliff SH, Ward Booth P. Incomplete removal of basal cell carcinoma: what is the value of further surgery? Oral Maxillofac Surg. 2012. (Epub ahead of print).
16. Farhi D, Dupin N, Palangié A, Carlotti A, Avril MF. Unvollständige Exzision von Basalzellkarzinomen: Rate und assoziierte Faktoren bei 362 konsekutiven Fällen. Dermatol Surg. 2007; 33:1207-14.
17. Bogdanov-Berezovsky A, Cohen A, Glesinger R, Cagnano E, Krieger Y, Rosenberg L. Clinical and pathological findings in reexcision of incompletely excised basal cell carcinomas. Ann Plast Surg. 2001; 47:299-302.
18. Kumar P, Orton CI, McWilliam LJ, Watson S. Incidence of incomplete excision in surgical treated basal cell carcinoma: a retrospective clinical audit. Br J Plast Surg. 2000; 53:563-6.
19. Griffiths RW, Suvarna SK, Stone J. Basalzellkarzinom histological clearance margins: an analysis of 1539 conventionally excised tumours. Noch breiter und tiefer? J Plast Reconstr Aesthet Surg. 2007; 60:41-7.
20. Anthony ML. Chirurgische Behandlung von Nicht-Melanom-Hautkrebs. AORN J. 2000; 71:552-4. 556-8, 560-4.
21. Mosterd K, Krekels GA, Nieman FH, Ostertag JU, Essers BA, Dirksen CD, et al. Surgical excision versus Mohs‘ micrographic surgery for primary and recurrent basal-cell carcinoma of the fa a prospective randomised controlled trial with 5-years‘ follow-up. Lancet Oncol. 2008; 9:1149-56.
22. Galimberti G, Pontón Montaño A, Ferrario D, Kowalczuk A, Galimberti R. Mohs micrographic surgery for the treatment of basal cell carcinoma. Actas Dermosifiliogr. 2010; 101:853-7.