ORIGINEEL
Gorlin-Goltz-syndroom: behandeling van basaalcelcarcinoom in het gezicht
Gorlin-Goltz-syndroom: behandeling van basaalcelcarcinoom in het gelaat
Rocío Gilabert Rodrígueza, Pedro Infante Cossíob, Pablo Redondo Parejob, Eusebio Torres Carranzab, Alberto García-Perla Garcíab en Domingo Sicilia Castroa
aDienst Plastische en Reconstructieve Chirurgie, Hospital Universitario Virgen del Rocío, Sevilla, Spanje
bDienst Mondziekten en Kaakchirurgie, Hospital Universitario Virgen del Rocío, Sevilla, Spanje
Adres voor correspondentie
Samenvatting
Inleiding/ Doelstelling: Het Gorlin-Goltz-syndroom (GGS) is een autosomaal dominant overervende aandoening die vooral aanleg heeft voor de proliferatie van tumoren zoals basaalcelcarcinomen en kraakbeenkeratocysten. Het wordt veroorzaakt door mutatie van het Patched-gen op chromosoom 9. Basaalcelcarcinomen die bij patiënten met GGS voorkomen, zijn meestal multipel, klinisch polymorf van verschijning, zonder voorkeursbehandeling voor het geslacht, soms al vroeg in het leven ontdekt en komen zelfs voor op plaatsen die niet aan zonlicht zijn blootgesteld. Hun klinisch gedrag is variabel, hoewel ze soms zeer agressief kunnen zijn, vooral in het gezicht. Om het gedrag van basaalcelcarcinomen bij patiënten met GCS te bestuderen, werd een studie uitgevoerd bij patiënten die tussen 2001 en 2011 in ons ziekenhuis werden behandeld en voldeden aan de criteria voor de ziekte.
Materiaal en methoden: 11 patiënten met een klinische en/of genetische diagnose van GGG werden geïncludeerd. Wij bestudeerden de verdeling naar leeftijd en geslacht, klinische verschijnselen, histologische kenmerken, toegepaste chirurgische techniek, aanwezigheid van recidief en evolutie van de patiënten.
Resultaten: 36% van de patiënten had basaalcelcarcinoom in het gezicht. Het aantal tumoren per patiënt varieerde van 9 tot 21. Chirurgische excisie was de voorkeursbehandeling, hoewel alle patiënten nieuwe laesies en recidieven ontwikkelden die verscheidene procedures vereisten. Histologisch onderzoek toonde bij 28% van de laesies tumorcontact of nabijheid van de chirurgische marges aan.
Conclusies: Er is in de literatuur onvoldoende bewijsmateriaal om te bepalen welke behandeling de voorkeur geniet onder de verschillende methoden die beschikbaar zijn voor de behandeling van basaalcelcarcinomen bij SGG. Een preventieve aanpak waarbij blootstelling aan de zon wordt vermeden, is noodzakelijk.
Sleutelwoorden: Gorlin-Goltz-syndroom. Nevoid basaalcel carcinoom syndroom. Basaalcelcarcinoom. Queratoquiste maxilar.
ABSTRACT
Inleiding/doelstelling: Het syndroom van Gorlin Goltz (GGS) is een autosomaal dominant overervende aandoening die voornamelijk predisponeert voor de proliferatie van tumoren, zoals basaalcelcarcinomen en kaakkeratocysten. GGS wordt veroorzaakt door de Patched-genmutatie op chromosoom 9. Basaalcelcarcinomen bij patiënten met GGS presenteren zich meestal als meervoudige tumoren, met polymorfe klinische kenmerken, een niet-geslachtsvoorkeur, die soms al in een vroeg levensstadium optreden en zelfs gebieden aantasten die niet aan zonlicht zijn blootgesteld. Het klinisch gedrag kan variëren, en kan soms zeer agressief zijn, vooral in het gezicht. Om het gedrag van basaalcelcarcinomen bij GGS patiënten te bestuderen, werd een studie uitgevoerd bij de patiënten die voldeden aan de criteria voor de ziekte en behandeld werden in ons ziekenhuis in de periode tussen 2001 en 2011.
Materiaal en methoden: De studie omvatte 11 patiënten met klinische en/of genetische diagnose van GGS. De patiënten werden bestudeerd op geslacht en leeftijd, klinische aspecten, histologische kenmerken, uitgevoerde chirurgische behandeling, aanwezigheid van recidief, en follow-up.
Resultaten: Basaalcelcarcinomen werden in het gezicht gezien bij 36% van de patiënten. Het aantal tumoren per patiënt varieerde tussen 9 en 21. De voorkeursbehandeling was chirurgische excisie, hoewel alle patiënten nieuwe laesies en recidieven ontwikkelden die meerdere procedures vereisten. De histologische studie toonde een contact of nabijheid van de tumor met de chirurgische marges in 28% van de laesies.
Conclusies: Er is onvoldoende bewijs in de literatuur om de behandeling van keuze te bepalen tussen de verschillende methoden die beschikbaar zijn voor de behandeling van het basaalcelcarcinoom bij GGS. Een preventieve aanpak is noodzakelijk om blootstelling aan zonlicht te vermijden.
Key words: Gorlin-Goltz syndroom. Nevoid basaalcelcarcinoom syndroom. Basaalcelcarcinoom. Kaak keratocyst.
Inleiding
Gorlin-Goltz syndroom (GGS) werd in 1960 beschreven door de gelijknamige auteurs, Gorlin en Goltz1. Zij beschreven aanvankelijk de triade die het syndroom kenmerkt: meervoudige basaalcelcarcinomen, maxillaire keratocysten en bifide ribben. Het is nu bekend dat het een genetische ziekte is met een autosomaal dominante overerving, onvolledige penetrantie en een variabel fenotype2,3. Het wordt veroorzaakt door mutatie van het Patched-gen (PTCH), een tumoronderdrukkend gen dat zich op chromosoom 9 (9q22, 3-q31) bevindt. De geschatte prevalentie varieert van 1:57.000 tot 1:164.000 afhankelijk van het land, met een algemeen aanvaarde gemiddelde prevalentie van ongeveer 1:60.0004.
GGS is een ziekte die klinisch wordt gekenmerkt door een aanleg voor de ontwikkeling van meerdere neoplasma’s, alsook door het optreden van ontwikkelingsanomalieën. Het klinisch begin treedt op in de kinder- of adolescentiejaren en gaat gepaard met de associatie van een aantal manifestaties, waarvan de meest voorkomende de aanwezigheid van talrijke basaalcelcarcinomen en maxillaire odontogene keratocysten is. Andere manifestaties zijn palmoplantaire hyperkeratose, skeletafwijkingen, ectopische intracraniële verkalkingen en gezichtsdysmorfie (macrocefalie, gespleten lip en gehemelte en ernstige oogafwijkingen)5. Intellectuele achterstand is aanwezig in ongeveer 5% van de gevallen. Er kunnen zich ook oog-, urogenitale en cardiovasculaire problemen voordoen6 . Kwaadaardige medulloblastomen ontwikkelen zich bij 5-10% van de patiënten met GGS en kunnen een potentiële oorzaak zijn van vroegtijdig overlijden. De diagnose is gesteld wanneer aan 2 belangrijke of 1 belangrijke en 2 minder belangrijke klinische criteria is voldaan5 (tabel 1). De definitieve diagnostische test is het aantonen van een mutatie in het PTCH-gen.

Tumoren ontstaan in het SGG als gevolg van veranderde pro-oncogenen of tumoronderdrukkende genen. Deze laatste oefenen een onderdrukkende functie uit op pro-oncogenen. In het geval van basaalcelcarcinoom is het niet duidelijk welk pro-oncogen hierbij betrokken is. De RAS-route is veranderd, maar niet in alle gevallen. Wat tumoronderdrukkende genen betreft, lijkt het erop dat p53 een secundaire rol speelt in de ontwikkeling van deze tumor. De aanleg van deze patiënten voor huidcarcinomen lijkt toe te schrijven te zijn aan het feit dat de door de mutatie getroffen cellen gevoeliger zijn voor zonlicht ten gevolge van veranderde DNA-herstelmechanismen. Basaalcelcarcinomen komen voor op elk deel van de anatomie van de huid, maar verschijnen vooral op aan ultraviolette straling blootgestelde plaatsen, vooral in het gezicht, op de rug en op de borst. Er zijn bepaalde verschillen tussen basaalcelcarcinomen die voorkomen in de algemene bevolking en bij patiënten met GBS. In het laatste geval zijn ze talrijker, zien ze er polymorf uit, hebben ze geen voorkeur voor het geslacht en kunnen ze zelfs gebieden aantasten die niet aan zonlicht zijn blootgesteld. Ze presenteren zich meestal klinisch in meerdere vormen6 , in aantallen variërend van enkele tot honderden, en verschijnen vroeg in het leven (zelfs bij de geboorte); hun klinisch gedrag is variabel, hoewel ze soms vanaf het begin zeer agressief kunnen zijn, vooral in het gezicht.
De meeste klinische bewijzen die beschikbaar zijn over de behandeling van basaalcelcarcinoom bij GTS zijn afkomstig van studies die zijn uitgevoerd bij patiënten die niet aan het syndroom lijden. Door de uitgebreide ervaring met deze tumoren in de algemene bevolking passen de meeste auteurs dezelfde therapeutische maatregelen toe op patiënten met GBS.
Het doel van deze studie was het analyseren van de behandeling van basaalcelcarcinoom in het gezicht bij patiënten met GBS om het klinisch gedrag en de diagnostische en therapeutische criteria te beoordelen op basis van een klinische studie van patiënten behandeld met GBS in de laatste 10 jaar in het Hospital Universitario Virgen del Rocío in Sevilla (Spanje).
Materialen en methoden
De klinische dossiers van patiënten gediagnosticeerd met GTS tussen 2001 en 2011 gezien op de afdelingen Mondziekten en Kaakchirurgie en Plastische en Reconstructieve Chirurgie werden bestudeerd op een observationele en retrospectieve manier. Elf patiënten met een klinische en/of genetische diagnose van GGS werden geïncludeerd, met uitsluiting van degenen met een onvolledige klinische voorgeschiedenis ondanks het feit dat zij de diagnose hadden. Epidemiologische gegevens (leeftijd en geslacht) en medisch-chirurgische gegevens (aantal en plaats van de laesies, histopathologische diagnose, toegepaste chirurgische techniek, aanwezigheid van recidief en evolutie) werden geanalyseerd. De klinische follow-up bestond uit periodieke controles met een gemiddelde van 4,5 jaar.
Resultaten
De gemiddelde leeftijd van de patiënten was 27 jaar, met een meerderheid van mannen (73%). In 45% van de gevallen was de leeftijd bij diagnose lager dan 20 jaar. Klinische diagnose werd gesteld bij 9 patiënten (2 major of 1 major en 2 minor criteria), terwijl 2 patiënten een genetische diagnose hadden. Drie patiënten hadden een familieanamnese (tabel 2).

In termen van klinische kenmerken (tabel 3), was maxillaire keratocyste het meest frequente klinische teken, voorkomend in 91% van de steekproef (10 patiënten). Het werd gevolgd door skeletveranderingen (63%) en karakteristieke fasciitis (54%). Vier van de 11 patiënten (36%) ontwikkelden basaalcelcarcinomen (tabel 4). Het aantal laesies per patiënt varieerde van 9 tot 21; bij één patiënt werd het exacte aantal laesies niet genoteerd. Zij bevonden zich allemaal hoofdzakelijk in het gezicht (fig. 1 en 2), gevolgd door de hals en de rug. Chirurgische excisie van de laesies werd in alle gevallen uitgevoerd (fig. 3). De pathologie toonde in de meeste gevallen nodulaire histologie en een groot deel van de chirurgische marges was betrokken (28% van de laesies had contact of nabijheid van de tumor met de marge). In alle gevallen werd meer dan één chirurgische ingreep verricht.
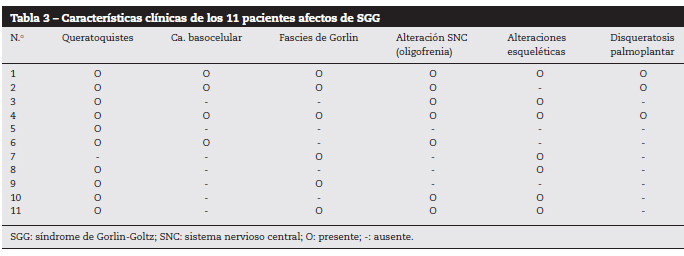

Figuur 1. Patiënt nummer 6.
Meervoudige basaalcelcarcinomen in het gelaat.
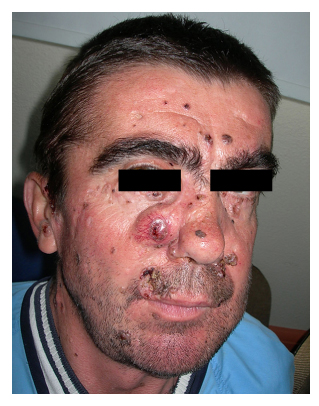
Figuur 2. Patiënt nummer 2 met
basaalcelcarcinoom op de wang.

Figuur 3. Patiënt nummer 1.
A: Preoperatief beeld van meerdere basaalcelcarcinomen in het gezicht en in de hals.
B: Onmiddellijk postoperatief detail na excisie.
Patiënt nummer 4 ontwikkelde meerdere recidiverende basaalcelcarcinomen op het onderste derde deel van het gelaat waarvoor agressieve excisie nodig was inclusief mandibulectomie en onmiddellijke reconstructie met 2 opeenvolgende vrije flappen (fibula osteoseptocutane en antebrachiale fasciocutane) (fig. 4). Patiënt nummer 6 presenteerde zich met een epidermoïd carcinoom gelegen op het mandibulair lichaam in associatie met een keratocyste, en overleed als gevolg daarvan.

Figuur 4. A: Recidiverende basaalcelcarcinomen in het onderste derde deel van het gezicht.
B: 3D-CT reconstructie toont bot en perineurale betrokkenheid.
C: Agressieve excisie met mandibulectomie.
D: Complexe reconstructie met 2 opeenvolgende vrije flappen
(osteoseptocutane fibula en antebrachiale fasciocutane met palmaris minor pees).
E: Postoperatieve panoramische röntgenfoto.
F: Postoperatieve foto van de patiënt.
Discussie
Als uitgangspunt werd een literatuuroverzicht uitgevoerd om de wetenschappelijke informatie te evalueren die in de laatste 10 jaar over het SGG is gepubliceerd, waaruit bleek dat er een groeiende belangstelling voor het onderwerp bestaat, voornamelijk in tijdschriften op het gebied van dermatologie, mond- en kaakchirurgie, tandheelkunde en genetica. Het grootste aantal artikelen is gegroepeerd in dermatologische tijdschriften, mogelijk omdat basaalcelcarcinomen een van de meest frequente en recurrente laesies zijn en op een plaats (vooral op de gezichtshuid) waardoor ze zichtbaarder zijn en gemakkelijk gediagnosticeerd kunnen worden. De volgende groep tijdschriften, in volgorde van frequentie, zijn die op het gebied van Mondziekten en Kaakchirurgie, Tandheelkunde en Genetica. Kraakbeenkeratocysten zijn de meest frequente laesies bij dit syndroom en zijn vaak het leidende symptoom dat de diagnose oriënteert.
In onze serie was de kraakbeenkeratocyt, zoals veel gerapporteerd in de literatuur, het meest frequente klinische teken dat bij 10 patiënten aanwezig was. Slechts één patiënt had geen keratocysten in de bovenkaak, hoewel de jonge leeftijd van deze patiënt het gebrek aan tijd voor hun ontwikkeling kan verklaren (patiënt nummer 7). Er was een duidelijk overwicht van mannelijke betrokkenheid, hoewel in de literatuur geen voorliefde voor het geslacht wordt beschreven, zodat uit dit feit geen conclusies kunnen worden getrokken gezien de kleine steekproefgrootte. Er zijn 4 typische gevallen van SGG met hoge fenotypische expressie (patiëntnummers 1, 2, 4 en 6) waarbij we kunnen zien dat de meest overheersende klinische manifestaties (maxillaire keratocysten en basaalcelcarcinomen) aanwezig zijn. Hoewel in de meeste gevallen een aangedane ouder wordt verondersteld, is dit niet het geval in onze serie, waarin slechts 3 patiënten (27 vergeleken met 70-80% gerapporteerd in de literatuur) ten minste één aangedaan familielid hebben dat bij ons bekend is (tabel 2). Vier van de 11 patiënten met SGG ontwikkelden een basaalcelcarcinoom. Dit is 36% betrokkenheid, een laag percentage vergeleken met de 90% frequentie die klassiek voor deze ziekte wordt beschouwd. Het is belangrijk te wijzen op de jonge leeftijd van sommige van de patiënten. Hoewel deze laesies bij dit syndroom al bij de geboorte zijn beschreven, is dit niet de norm en zijn meerdere jaren van blootstelling aan risicofactoren (ultraviolette straling) nodig voor klinische expressie. De gemiddelde leeftijd van de patiënten met basaalcelcarcinoom in deze serie was echter 39 jaar (19 jaar de jongste).
Basaalcelcarcinoom wordt beschouwd als een van de meest voorkomende kwaadaardige huidtumoren, vooral bij Kaukasiërs in geografische regio’s dicht bij de evenaar, waar het wordt geassocieerd met blootstelling aan ultraviolette straling bij personen met een lichte huid.7 In de algemene bevolking komt deze ziekte voor tussen het zesde en zevende decennium van het leven en de incidentie is de laatste jaren aanzienlijk toegenomen. In de algemene bevolking komt deze ziekte voor tussen het zesde en het zevende decennium van het leven en de incidentie is de laatste jaren aanzienlijk toegenomen. Chronische blootstelling aan zonlicht is de belangrijkste oorzaak van basaalcelcarcinoom en de laesies komen dan ook meestal voor op blootgestelde lichaamsdelen: gezicht, oren, hals, hoofdhuid, schouders en rug. Bekende etiologische factoren zijn onder meer blootstelling aan ultraviolette stralen (zowel van korte als van lange duur), bepaalde chemische carcinogenen (arsenicum en koolwaterstoffen), ioniserende straling en chronische irritatie. Er zijn verschillende syndromale vormen, waaronder xeroderma pigmentosum en het basaalcelnevoïd syndroom (BNS).8
De behandeling van basaalcelcarcinoom in BNS is slecht bestudeerd en verwijst voornamelijk naar conservatieve behandeling. Pauwels et al. presenteerden fotodynamische therapie als een optie voor de behandeling van basaalcelcarcinoom bij patiënten met SGG met gunstige resultaten in vergelijking met chirurgie9. Micali et al. analyseerden de rol van topisch imiquimod voor de behandeling van basaalcelcarcinoom bij patiënten met SGG en benadrukten deze therapeutische modaliteit als een effectieve optie vanwege de hoge mate van medewerking van patiënten die hieraan de voorkeur geven boven meervoudige chirurgische excisies10. In studies over de behandeling van basaalcelcarcinomen bij de algemene bevolking onderscheidt de chirurgische behandeling (eenvoudige excisie met klinische follow-up van laesies met margebetrokkenheid) zich van de andere therapeutische opties11-13. Hoewel het gedrag van basaalcelcarcinomen in de algemene bevolking verschilt van dat van GTS, lijkt het, totdat andere specifieke studies beschikbaar zijn, meer dan redelijk om de uitgebreide ervaring die wij hebben op deze patiënten toe te passen.
De behandeling van basaalcelcarcinomen omvat volledige verwijdering van de laesie, die op verschillende manieren kan worden uitgevoerd. Chirurgische excisie is de meest gebruikte procedure en men lijkt het erover eens te zijn dat dit de beste optie is gezien het hoge genezingspercentage, vooral bij kleine en middelgrote laesies. Andere opties (cryotherapie, elektrodesiccatie en curettage, radiotherapie, lokale chemotherapie, enz.) worden gebruikt bij patiënten bij wie chirurgie gecontra-indiceerd is14 , hetzij vanwege de kenmerken van de tumor (aantal of grootte) of vanwege algemene patiëntfactoren (leeftijd, anesthesierisico, enz.). Aangezien deze tumoren zeer agressief kunnen worden met perineurale infiltratie en multifocaliteit, en vooral in gevallen van recidief, vereisen zij soms uitgebreide resecties die defecten achterlaten waarvoor complexe reconstructies nodig zijn, zoals het geval was bij patiënte 4, bij wie een mandibulaire reconstructie werd uitgevoerd met een gemicrovasculeerde fibula en radiale flap.
Chirurgische verwijdering van basaalcelcarcinoom heeft een genezingspercentage van meer dan 90%. De chirurgische marges zijn goed gedefinieerd, en genezing wordt overwogen als de marges vrij zijn. Net als bij andere vormen van behandeling dragen grootte, lokalisatie en histologisch subtype bij tot de algemene prognose. Er is geen uniforme aanbeveling over de grens van de chirurgische marges. De meeste chirurgen kiezen een marge van ten minste 3 tot 5 mm in zowel oppervlakte als diepte voor kleine, goed omcirkelde laesies en 1 cm of meer voor grote, agressieve laesies.
Het beheer is controversieel bij tumoren waarbij het anatomische pathologieverslag aangeeft dat de marges betrokken zijn. Verschillende studies bij niet-syndromale patiënten hebben positieve marginale betrokkenheid gemeld tussen 4 en 16,6%15-18. In onze serie hadden 28% van de laesies histologisch nauwe en/of betrokken marges, een hoog percentage in vergelijking met die gerapporteerd in de algemene bevolking. In de literatuur wordt gesuggereerd dat het hoofd-halsgebied een hoger percentage marginale betrokkenheid heeft, wat verklaard kan worden door de moeilijkheid om tumoren te verwijderen zonder edele anatomische structuren te beschadigen16,17. In grote series met follow-up van patiënten met basaalcelcarcinomen is slechts een recidiefpercentage van 25% na 5 jaar waargenomen bij laesies met onvolledige resectie13. Conservatief beheer met latere follow-up en observatie lijkt in deze gevallen de meest verstandige aanpak19,20, in aanmerking nemend dat na chirurgische herinterventie slechts 28-54% van de aangetaste marges wordt aangetoond15-18. 15-18 Bij patiënten met SGG lijkt deze houding van follow-up en observatie zeer raadzaam voor tumoren met nauwe en/of positieve histologische marges zonder aanwijzingen van perineurale uitbreiding en in gebieden die gemakkelijk toegankelijk zijn voor exploratie, ook rekening houdend met de grote waarschijnlijkheid van sporadisch verschijnen van nieuwe carcinomen en hun multidisciplinariteit, die op lange termijn verscheidene aanvullende chirurgische ingrepen in het gebied kunnen vereisen.
Mohs micrografische chirurgie is de chirurgische behandeling bij uitstek voor recidiverende laesies in gecompromitteerde gebieden (oogleden, orbitale randen, enz.)21. Zij is ook geïndiceerd voor tumoren die op grond van hun klinische kenmerken (histologisch subtype, slecht afgebakende grenzen, neiging tot recidiveren) of hun plaats als risicovol worden geclassificeerd22. Het voordeel is gebaseerd op de methodologie van de procedure, die 100% controle van de chirurgische marges mogelijk maakt, zowel in de diepte als aan de oppervlakte. Dit kan op zijn beurt een volledige resectie van de tumor verzekeren, een maximaal behoud van gezond weefsel garanderen en, op de tweede plaats, de daaropvolgende reconstructie optimaliseren.
Hoewel SGG niet kan genezen worden, helpt een vroege diagnose bij het voorzien van een multidisciplinaire aanpak om complicaties te vermijden zoals het verschijnen van nieuwe basaalcelcarcinomen door blootstelling aan zonnestraling of meervoudige keratocysten die de kaken kunnen vernietigen. Basaalcelcarcinoom is een kwaadaardige tumor die niet uitzaait, maar ernstig agressief kan zijn als hij infiltreert in de diepere lagen van de huid. Aangezien chirurgische excisie de meest effectieve optie is bij de behandeling van basaalcelcarcinomen in het SGG, is het belangrijk om een preventieve medische benadering te hebben om te proberen laesies te behandelen wanneer ze klein van omvang zijn om postoperatieve sequelae te verminderen. Hoewel er verschillende specialismen zijn die veel ervaring hebben met SGG, zoals blijkt uit het grote aantal publicaties, is de eerstelijnsgezondheidszorg afwezig op dit gebied, zodat de opleiding of scholing van gezondheidswerkers in deze sector moet worden bevorderd om een vroegtijdige diagnose en bijgevolg een vroegtijdige aanvang van de behandeling en een betere prognose mogelijk te maken. Uit de resultaten van verschillende epidemiologische studies is gebleken dat het risico van basaalcelcarcinoom een sterke positieve correlatie vertoont met blootstelling aan UV-straling en dat deze patiënten derhalve overmatige blootstelling aan de zon moeten vermijden. Ook radiotherapie moet zo mogelijk worden vermeden wegens het risico van het ontstaan en het terugkeren van basaalcelcarcinomen. Chemopreventie kan worden toegepast om huidlaesies te voorkomen. Vitamine A-analogen, zoals retinoïden of isotretinoïne, kunnen een belangrijke rol spelen bij het voorkomen of vertragen van de ontwikkeling van nieuwe basaalcelcarcinomen.
Samenvattend zijn basaalcelcarcinomen bij patiënten met GGS geassocieerd met veranderingen in het tumorsuppressiemechanisme als gevolg van mutaties in het PTCH-gen, resulterend in het sporadisch voorkomen van dergelijke tumoren, met name in relatie tot ultraviolette straling. Er zijn verschillen tussen de klinische kenmerken van basaalcelcarcinomen bij patiënten met SGG en in de algemene bevolking, voornamelijk wat betreft het aantal laesies (hoger bij SGG), de leeftijd van presentatie (lager bij SGG) en het gedrag (hogere agressiviteit en recidiefpercentage bij SGG). In ons onderzoek van 11 patiënten, presenteerde 36% zich met basaalcelcarcinomen in het gezicht. De meest algemeen aanvaarde behandeling in de literatuur is chirurgische excisie en dit was ook de behandeling die in al onze gevallen werd toegepast. In onze serie hadden 28% van de tumoren nauwe en/of gecompromitteerde histologische marges, een hoog percentage vergeleken met series in de niet-syndromische populatie. Nieuwe laesies en recidieven werden ontdekt bij 100% van de patiënten na de initiële behandeling. De bestaande gegevens in de literatuur zijn ontoereikend om wetenschappelijk gefundeerde beslissingen te nemen over de verschillende therapieën die beschikbaar zijn voor de behandeling van basaalcelcarcinoom bij SGG. Een preventieve aanpak waarbij blootstelling aan UV wordt vermeden, wordt aanbevolen.
Ethische verantwoordelijkheden
Bescherming van mens en dier. De auteurs verklaren dat voor dit onderzoek geen experimenten op mensen of dieren zijn uitgevoerd.
Gegevens vertrouwelijkheid. De auteurs verklaren dat in dit artikel geen gegevens van patiënten voorkomen.
Recht op privacy en geïnformeerde toestemming. De auteurs verklaren dat er geen patiëntgegevens in dit artikel voorkomen.
Conflict of interest
De auteurs verklaren dat zij geen belangenconflict hebben.
Bibliografie
1. Gorlin RJ, Goltz RW. Multiple nevoide basaalcel epithelioma, kaak cyste en bifide rib. Een syndroom. N Engl J Med. 1960; 262:908-12.
2. Stoelinga PJ, Peters JH, van de Staak WJ, Cohen MM. Enkele nieuwe bevindingen in het basaalcel nevus syndroom. Oral Surg Oral Med Oral Pathol. 1973; 36:686-92.
3. Totten JR. Het meervoudige nevoïde basaalcelcarcinoom syndroom. Verslag van het voorkomen ervan in vier generaties van een familie. Kanker. 1980; 46:1456-62.
4. Visioli F, Martins CA, Heitz C, Rados PV, Sant’Ana Filho M. Is het nevoïde basaalcelcarcinoom syndroom echt zo zeldzaam? Voorstel voor een onderzoeksprotocol op basis van een case serie. J Oral Maxillofac Surg. 2010; 68:903-8.
5. Evans DG, Ladusans EJ, Rimmer S, Burnell LD, Thakker N, Farndon PA. Complications of the nevoid basal cell carcinoma syndrome: results of a population based study. J Med Genet. 1993; 30:460-4.
6. Díaz-Fernández JM, Infante-Cossío P, Belmonte-Caro R, Ruiz-Laza L, García-Perla-García A, Gutiérrez-Pérez JL. Basaalcel nevus syndroom. Presentatie van zes gevallen en literatuuroverzicht. Med Oral Patol Oral Cir Bucal. 2005; 10 Suppl 1:E57-66.
7. Roewert-Huber J, Lange-Asschenfeldt B, Stockfleth E, Kerl H. Epidemiology and aetiology of basal cell carcinoma. Br J Dermatol. 2007; 157 Suppl 2:47-51.
8. Kyrgidis A, Tzellos TG, Vahtsevanos K, Triaridis S. Nieuwe concepten voor basaalcelcarcinoom. Demografische, klinische, histologische risicofactoren, en biomarkers. A systematic review of evidence regarding risk for tumor development, susceptibility for second primary and recurrence. J Surg Res. 2010; 159:545-56.
9. Pauwels C, Mazereeuw-Hautier J, Basset-Seguin N, Livideanu C, Viraben R, Paul C, et al. Topische methylaminolevulinaat fotodynamische therapie voor de behandeling van basaalcelcarcinomen bij patiënten met het basaalcelnevussyndroom verbetert de tevredenheid van de patiënt en vermindert de noodzaak van chirurgische ingrepen. J Eur Acad Dermatol Venereol. 2011; 25:861-4.
10. Micali G, de Pasquale R, Caltabiano R, Impallomeni R, Lacarrubba F. Topical imiquimod treatment of superficial and nodular basal cell carcinomas in patients affected by basal cell nevus syndrome: a preliminary report. J Dermatolog Treat. 2002; 13:123-7.
11. Chren MM, Torres JS, Stuart SE, Bertenthal D, Labrador RJ, Boscardin WJ. Recidief na behandeling van nonmelanoma huidkanker: een prospectieve cohortstudie. Arch Dermatol. 2011; 147:540-6.
12. Wallace DL, Jaffe W. Antwoord op: Komen basaalcelcarcinomen terug na volledige conventionele chirurgische excisie? R.W. Griffiths, S.K., Suvarna. J. Stone BJPS. 2005; 58:795-805. J Plast Reconstr Aesthet Surg 2006;59:1247.
13. Sherry KR, Reid LA, Wilmshurst AD. A five year review of basal cell carcinoma excisions. J Plast Reconstr Aesthet Surg. 2010; 63:1485-9.
14. Kopera D, Cerroni L, Fink-Puches R, Kerl H. Different treatment modalities for the management of a patient with the nevoid basal cell carcinoma syndrome. J Am Acad Dermatol. 1996; 34:937-9.
15. Patel SS, Cliff SH, Ward Booth P. Incomplete verwijdering van basaalcelcarcinoom: wat is de waarde van verdere chirurgie? Oral Maxillofac Surg. 2012. (Epub ahead of print).
16. Farhi D, Dupin N, Palangié A, Carlotti A, Avril MF. Incomplete excisie van basaalcelcarcinoom: percentage en geassocieerde factoren bij 362 opeenvolgende gevallen. Dermatol Surg. 2007; 33:1207-14.
17. Bogdanov-Berezovsky A, Cohen A, Glesinger R, Cagnano E, Krieger Y, Rosenberg L. Clinical and pathological findings in reexcision of incompletely excised basal cell carcinomas. Ann Plast Surg. 2001; 47:299-302.
18. Kumar P, Orton CI, McWilliam LJ, Watson S. Incidence of incomplete excision in surgically treated basal cell carcinoma: a retrospective clinical audit. Br J Plast Surg. 2000; 53:563-6.
19. Griffiths RW, Suvarna SK, Stone J. Basaalcelcarcinoom histologische klaringsmarges: een analyse van 1539 conventioneel geëxcideerde tumoren. Nog breder en nog dieper? J Plast Reconstr Aesthet Surg. 2007; 60:41-7.
20. Anthony ML. Chirurgische behandeling van nonmelanoma huidkanker. AORN J. 2000; 71:552-4. 556-8, 560-4.
21. Mosterd K, Krekels GA, Nieman FH, Ostertag JU, Essers BA, Dirksen CD, et al. Surgical excision versus Mohs’ micrographic surgery for primary and recurrent basal-cell carcinoma of the fa a prospective randomised controlled trial with 5-years’ follow-up. Lancet Oncol. 2008; 9:1149-56.
22. Galimberti G, Pontón Montaño A, Ferrario D, Kowalczuk A, Galimberti R. Mohs micrografische chirurgie voor de behandeling van basaalcelcarcinomen. Actas Dermosifiliogr. 2010; 101:853-7.