ORIGINAL
Gorlin-Goltz-szindróma: az arc bazális sejtes karcinómájának kezelése
Gorlin-Goltz-szindróma: az arc bazális sejtes karcinómájának kezelése
Rocío Gilabert Rodrígueza, Pedro Infante Cossíob, Pablo Redondo Parejob, Eusebio Torres Carranzab, Alberto García-Perla Garcíab és Domingo Sicilia Castroa
aPlasztikai és helyreállító sebészet, Hospital Universitario Virgen del Rocío, Sevilla, Spanyolország
bSzáj- és állkapocssebészeti osztály, Hospital Universitario Virgen del Rocío, Sevilla, Spanyolország
levelezési cím
Összefoglaló
Bevezetés/célkitűzés: A Gorlin-Goltz-szindróma (GGS) autoszomális dominánsan öröklődő rendellenesség, amely elsősorban daganatok, például bazálsejtes karcinómák és maxilláris keratociszták elburjánzására hajlamosít. A 9-es kromoszómán található Patched gén mutációja okozza. A GGS-ben szenvedő betegeknél előforduló bazális sejtes karcinómák általában többszörösek, klinikailag polimorf megjelenésűek, nemi predikció nélkül, néha már az élet korai szakaszában felfedezhetők, és még a napfénynek nem kitett területeket is érintik. Klinikai viselkedésük változó, bár néha nagyon agresszívek lehetnek, különösen az arcon. A bazálsejtes karcinómák viselkedésének tanulmányozása érdekében a GCS-ben szenvedő betegek körében vizsgálatot végeztünk a kórházunkban 2001 és 2011 között kezelt, a betegség kritériumainak megfelelő betegek körében.
Az anyag és a módszerek: 11 olyan beteget vontunk be a vizsgálatba, akiknél a GGG klinikai és/vagy genetikai diagnózisát állapítottuk meg. Megvizsgáltuk a megoszlást életkor és nem, a klinikai tünetek, a szövettani jellemzők, az alkalmazott sebészeti technika, a kiújulás jelenléte és a betegek fejlődése szerint.
Eredmények: A betegek 36%-ának volt bazálsejtes karcinómája az arcán. A daganatok száma betegenként 9 és 21 között mozgott. A sebészi kimetszés volt az előnyben részesített kezelés, bár minden betegnél új elváltozások és kiújulások alakultak ki, amelyek több beavatkozást igényeltek. A szövettani vizsgálat az elváltozások 28%-ában mutatta ki a tumor érintkezését vagy közelségét a műtéti határhoz.
Következtetések: A szakirodalomban nincs elegendő bizonyíték arra, hogy a bazálsejtes karcinóma kezelésére rendelkezésre álló különböző módszerek közül melyik a legmegfelelőbb kezelés az SGG-ben. Megelőző megközelítésre van szükség a napozás elkerülése érdekében.
Kulcsszavak: Gorlin-Goltz-szindróma. Nevoid bazálsejtes karcinóma szindróma. Bazális sejtes karcinóma. Queratoquiste maxilar.
ABSTRACT
Bevezetés/célkitűzés: A Gorlin-Goltz-szindróma (GGS) autoszomális dominánsan öröklődő rendellenesség, amely elsősorban daganatok, például bazális sejtes karcinómák és állkapociszták burjánzására hajlamosít. A GGS-t a 9. kromoszómán található Patched génmutáció okozza. A GGS-ben szenvedő betegeknél a bazális sejtes karcinómák általában többszörös daganatként jelentkeznek, polimorf klinikai jellemzőkkel, nem nemi predilekcióval, néha az élet korai szakaszában fordulnak elő, és még a napfénynek nem kitett területeket is érintik. A klinikai viselkedés változhat, és néha nagyon agresszív lehet, különösen az arcon. A bazálsejtes karcinómák viselkedésének tanulmányozása érdekében a GGS-betegeknél vizsgálatot végeztünk azokon a betegeken, akik megfeleltek a betegség kritériumainak, és akiket kórházunkban kezeltek a 2001 és 2011 közötti időszakban.
Anyag és módszerek: A vizsgálatba 11 olyan beteget vontunk be, akiknél klinikai és/vagy genetikai diagnózissal GGS-t állapítottunk meg. A betegeket a nem és az életkor, a klinikai szempontok, a szövettani jellemzők, az elvégzett sebészeti kezelés, a kiújulás jelenléte és a nyomon követés szerint vizsgáltuk.
Eredmények: A betegek 36%-ánál bazálsejtes karcinómát észleltek az arcon. A daganatok száma betegenként 9 és 21 között mozgott. Az előnyben részesített kezelés a sebészi kimetszés volt, bár minden betegnél új elváltozások és kiújulások alakultak ki, amelyek több beavatkozást igényeltek. A szövettani vizsgálat az elváltozások 28%-ában mutatta ki a tumor érintkezését vagy közelségét a műtéti határhoz.
Következtetések: A szakirodalomban nincs elegendő bizonyíték arra, hogy a GGS-ben a bazálsejtes karcinóma kezelésére rendelkezésre álló különböző módszerek közül melyik kezelést válasszuk. Megelőző megközelítésre van szükség a napfényexpozíció elkerülése érdekében.
Kulcsszavak: Gorlin-Goltz-szindróma. Nevoid bazálsejtes karcinóma szindróma. Bazális sejtes karcinóma. Állkapocs keratociszta.
Bevezetés
A Gorlin-Goltz-szindrómát (GGS) 1960-ban írták le a névadó szerzők, Gorlin és Goltz1. Kezdetben leírták a szindrómát jellemző triádot: többszörös bazálsejtes karcinóma, maxilláris keratociszták és kétosztatú bordák. A többek között nevoid-bazálsejtes szindróma vagy nevoid bazálsejtes karcinóma szindróma néven is ismert genetikai betegség, amely autoszomális domináns öröklődéssel, inkomplett penetranciával és változó fenotípussal jár2,3. A 9-es kromoszómán (9q22, 3-q31) elhelyezkedő tumorszupresszor gén, a Patched (PTCH) gén mutációja okozza. Becsült előfordulási gyakorisága országonként 1:57 000 és 1:164 000 között változik, az általánosan elfogadott átlagos előfordulási gyakoriság körülbelül 1:60 0004.
A GGS olyan betegség, amelyet klinikailag a többszörös daganatok kialakulására való hajlam, valamint a fejlődési rendellenességek előfordulása jellemez. A klinikai tünetek gyermek- vagy serdülőkorban jelentkeznek, és számos manifesztáció társul hozzájuk, amelyek közül a leggyakoribb a számos bazálsejtes karcinóma és a maxilláris odontogén keratociszták jelenléte. Egyéb megnyilvánulások közé tartozik a palmoplantáris hiperkeratózis, a csontrendszeri rendellenességek, az ektopikus intrakraniális meszesedés és az arc diszmorfiája (makrokefália, ajak- és szájpadhasadék és súlyos szemészeti rendellenességek)5. Az esetek körülbelül 5%-ában intellektuális deficit áll fenn. Szemészeti, urogenitális és kardiovaszkuláris problémák is előfordulhatnak6 . A rosszindulatú medulloblasztómák a GGS-es betegek 5-10%-ánál alakulnak ki, és a korai halálozás egyik lehetséges okai lehetnek. A diagnózis akkor állítható fel, ha 2 fő vagy 1 fő és 2 mellékes klinikai kritérium teljesül5 (1. táblázat). A végleges diagnosztikai teszt a PTCH gén mutációjának kimutatása.

A daganatok az SGG-ben a megváltozott pro-onkogének vagy tumorszupresszor gének következtében alakulnak ki. Ez utóbbiak szupresszor funkciót gyakorolnak a pro-onkogénekre. A bazálsejtes karcinóma esetében nem egyértelmű, hogy melyik pro-onkogén játszik szerepet. A RAS útvonal megváltozik, de nem minden esetben. A tumorszupresszor gének tekintetében úgy tűnik, hogy a p53 másodlagos szerepet játszik a tumor kialakulásában. Úgy tűnik, hogy ezeknek a betegeknek a bőrkarcinómára való hajlamát az okozza, hogy a mutációval érintett sejtek a megváltozott DNS-javító mechanizmusok miatt érzékenyebbek a napfényre. A bazálsejtes karcinóma a bőr anatómia bármely területét érinti, de főként az ultraibolya sugárzásnak kitett területeken, elsősorban az arcon, a háton és a mellkason jelenik meg. Vannak bizonyos különbségek az általános populációban és a GBS-ben szenvedő betegeknél előforduló bazálsejtes karcinómák között. Az utóbbiaknál gyakrabban fordulnak elő, megjelenésük polimorf, nincs nemi előítéletük, és a napfénynek nem kitett területeket is érinthetik. Klinikailag általában többszörös formában jelentkeznek6 , néhánytól több százig terjedő számban, és az élet korai szakaszában (akár már születéskor) megjelennek; klinikai viselkedésük változó, bár néha már a kezdetektől fogva nagyon agresszívek lehetnek, különösen az arc szintjén.
A GTS-bazális sejtkarcinóma kezelésével kapcsolatban rendelkezésre álló klinikai bizonyítékok többsége a szindrómában nem érintett betegeken végzett vizsgálatokból származik. Az általános populációban e daganatokkal kapcsolatos kiterjedt tapasztalatok miatt a legtöbb szerző ugyanazokat a terápiás intézkedéseket alkalmazza a GBS-es betegek esetében.
A tanulmány célja az volt, hogy elemezze az arc bazális sejtes karcinómájának kezelését a GBS-es betegeknél, hogy felmérje a klinikai viselkedést, valamint a diagnosztikus és terápiás kritériumokat a sevillai (Spanyolország) Universitario Virgen del Rocío Kórházban az elmúlt 10 évben GBS-szel kezelt betegek klinikai vizsgálata alapján.
Az anyagok és módszerek
A száj- és állcsontsebészeti, valamint a plasztikai és rekonstrukciós sebészeti osztályokon 2001 és 2011 között GTS-szel diagnosztizált betegek klinikai adatait vizsgálták megfigyeléses és retrospektív módon. Tizenegy, a GGS klinikai és/vagy genetikai diagnózisával rendelkező beteget vontak be a vizsgálatba, kizárva azokat, akiknek a kórtörténete a diagnózis ellenére nem volt teljes. Epidemiológiai adatokat (életkor és nem) és orvosi-sebészeti adatokat (az elváltozások száma és elhelyezkedése, szövettani diagnózis, alkalmazott műtéti technika, kiújulás és fejlődés) elemeztek. A klinikai követés időszakos vizsgálatokkal történt, átlagosan 4,5 év alatt.
Eredmények
A betegek átlagéletkora 27 év volt, többségük férfi (73%). Az esetek 45%-ában a diagnózis felállításakor az életkor kevesebb mint 20 év volt. Klinikai diagnózist 9 betegnél állítottak fel (2 fő vagy 1 fő és 2 mellékkritérium), míg 2 betegnél genetikai diagnózist állítottak fel. Három betegnek volt családi anamnézise (2. táblázat).

A klinikai jellemzők tekintetében (3. táblázat) a maxilláris keratocysta volt a leggyakoribb klinikai tünet, amely a minta 91%-ánál (10 beteg) fordult elő. Ezt követték a csontrendszeri elváltozások (63%) és a jellegzetes fasciitis (54%). A 11 betegből négynél (36%) alakult ki bazálsejtes karcinóma (4. táblázat). Az elváltozások száma betegenként 9 és 21 között mozgott, az elváltozások pontos számát egy betegnél nem jegyezték fel. Mindegyikük főként az arc területén helyezkedett el (1. és 2. ábra), majd a nyak és a hát következett. Az elváltozások sebészi kimetszését minden esetben elvégezték (3. ábra). A patológia a legtöbb esetben csomós szövettani képet mutatott, és a műtéti peremek nagy arányban érintettek voltak (az elváltozások 28%-ánál a tumor érintkezett vagy közel volt a peremhez). Minden esetben egynél több műtéti beavatkozást végeztek.
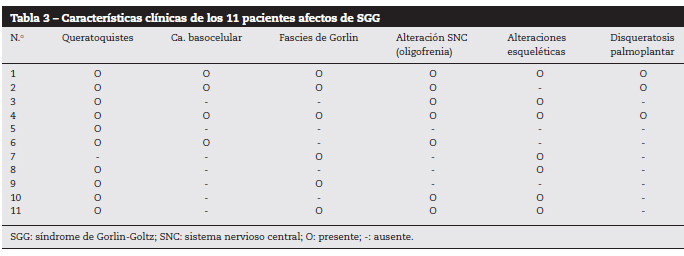

1. ábra. 6. számú beteg.
Sokszoros arcbazális sejtes karcinóma.
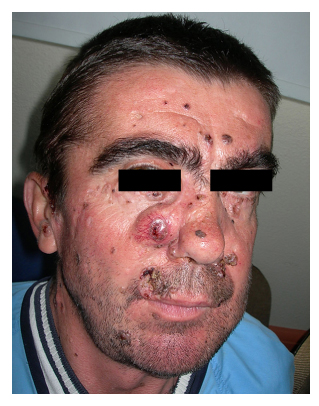
2. ábra. A 2. számú betegnél
bazális sejtes karcinóma az arcon.

3. ábra. 1. számú beteg.
A: Preoperatív kép az arcon és a nyakon lévő többszörös bazális sejtes karcinómáról.
B: Azonnali posztoperatív részlet a kimetszés után.
A 4. számú betegnél az arc alsó harmadán többszörös recidiváló bazális sejtes karcinóma alakult ki, amely agresszív kimetszést igényelt, beleértve a mandibulektómiát és azonnali rekonstrukciót 2 egymást követő szabad lebennyel (fibula osteoseptocutan és antebrachialis fasciocutan) (4. ábra). A 6. számú betegnél az állkapocscsont testén elhelyezkedő epidermoid karcinóma jelentkezett keratocystával társulva, és ennek következtében meghalt.

4. ábra. A: Visszatérő bazálsejtes karcinóma az arc alsó harmadában.
B: 3D-CT rekonstrukció, amely a csont és a perineurális érintettséget mutatja.
C: Agresszív kimetszés mandibulektómiával.
D: Komplex rekonstrukció 2 egymást követő szabad lebennyel
(osteoseptocutan fibula és antebrachialis fasciocutan a palmaris minor ínnel).
E: Posztoperatív panoráma röntgenfelvétel.
F: A páciens posztoperatív képe.
Diszkusszió
A kiindulópontként irodalmi áttekintést végeztünk az elmúlt 10 évben az SGG-vel kapcsolatban megjelent tudományos információk értékelésére, amely a téma iránti növekvő érdeklődést mutatott, főként a bőrgyógyászat, a száj- és állcsont- és arcsebészet, a fogászat és a genetika területén megjelenő folyóiratokban. A legtöbb cikk a bőrgyógyászati folyóiratokban található, valószínűleg azért, mert a bazális sejtes karcinóma az egyik leggyakoribb és leggyakrabban visszatérő elváltozás, és olyan helyen található (különösen az arcbőrön), amely jobban láthatóvá és könnyen diagnosztizálhatóvá teszi. A következő csoportba a gyakoriság sorrendjében a száj- és állkapocssebészet, a fogászat és a genetika területén megjelenő folyóiratok tartoznak. A maxilláris keratociszták a leggyakoribb elváltozások ebben a szindrómában, és gyakran a diagnózist irányító tünet.
Sorozatunkban a maxilláris keratociszta volt a leggyakoribb klinikai tünet, amint arról az irodalomban széles körben beszámoltak, 10 betegnél. Csak egy betegnél nem voltak maxilláris keratociszták, bár ennek a betegnek a fiatal kora magyarázhatja a kialakulásukhoz szükséges idő hiányát (7. beteg). Egyértelmű volt a férfiak túlsúlya, bár a szakirodalom nem ír le nemi predilekciót, így ebből a tényből nem lehet következtetéseket levonni, tekintettel a kis mintanagyságra. A magas fenotípusú SGG 4 tipikus esete (1., 2., 4. és 6. betegszám), amelyekben a legdominánsabb klinikai manifesztációk (maxilláris keratociszták és bazális sejtes karcinómák) vannak jelen. Bár a legtöbb esetben feltételezik az érintett szülő meglétét, a mi sorozatunkban ez nem így van, mivel csak 3 betegnél (27, szemben a szakirodalomban közölt 70-80%-kal) volt legalább egy általunk ismert érintett családtag (2. táblázat). A 11 SGG-s beteg közül négynél alakult ki bazálsejtes karcinóma. Ez 36%-os érintettséget jelent, ami alacsony arány a betegségre klasszikusan jellemző 90%-os gyakorisághoz képest. Fontos megjegyezni, hogy a betegek egy része fiatal korú. Bár ezeket az elváltozásokat már születéskor is leírták ebben a szindrómában, ez nem a norma, és a klinikai kifejeződéshez több éves kitettség szükséges a kockázati tényezőknek (ultraibolya sugárzás). A bazálsejtes karcinómás betegek átlagéletkora azonban ebben a sorozatban 39 év volt (a legfiatalabb 19 év).
A bazálsejtes karcinóma az egyik leggyakoribb rosszindulatú bőrdaganatnak számít, különösen az Egyenlítőhöz közeli földrajzi régiókban élő kaukázusiak körében, ahol a világos bőrűek ultraibolya sugárzásnak való kitettségével függ össze.7 Az általános populációban ez a betegség a hatodik és hetedik életévtized között fordul elő, és előfordulása az utóbbi években jelentősen megnőtt. Az általános népességben ez a betegség a hatodik és hetedik életévtized között fordul elő, és előfordulása az utóbbi években jelentősen megnőtt. A krónikus napfénynek való krónikus kitettség a bazálsejtes karcinóma fő oka, és ennek következtében az elváltozások általában a kitett testrészeken jelentkeznek: az arcon, a fülön, a nyakon, a fejbőrön, a vállon és a háton. Az ismert etiológiai tényezők közé tartozik többek között az ultraibolya sugárzás (rövid és hosszú távú), bizonyos kémiai rákkeltő anyagok (arzén és szénhidrogének), ionizáló sugárzás és krónikus irritáció. Számos szindrómás formája létezik, többek között a xeroderma pigmentosum és a bazális sejtes nevoid szindróma (BNS)8.
A bazális sejtes karcinóma kezelése BNS-ben kevéssé tanulmányozott, és főként konzervatív kezelésre vonatkozik. Pauwels és munkatársai bemutatták a fotodinamikus terápiát, mint a bazálsejtes karcinóma kezelésének lehetőségét SGG-ben szenvedő betegeknél, a műtéthez képest kedvező eredményekkel9. Micali és munkatársai elemezték a helyi imiquimod szerepét a bazálsejtes karcinóma kezelésében SGG-ben szenvedő betegeknél, és kiemelték ezt a terápiás módot, mint hatékony lehetőséget, mivel a betegek nagyszámú együttműködése miatt a többszörös sebészi kimetszéssel szemben előnyben részesítik10. Az általános populációban a bazálsejtes karcinóma kezeléséről szóló tanulmányokban a sebészeti kezelés (egyszerű kimetszés, a peremet érintő elváltozások klinikai nyomon követésével) kiemelkedik a többi terápiás lehetőség közül11-13 . Bár a bazálsejtes karcinóma viselkedése az általános populációban más, mint a GTS-ben, amíg más specifikus tanulmányok nem állnak rendelkezésre, több mint ésszerűnek tűnik, hogy az általunk szerzett széleskörű tapasztalatot ezekre a betegekre is alkalmazzuk.
A bazálsejtes karcinóma kezelése az elváltozás teljes eltávolítását jelenti, ami többféle módszerrel is elvégezhető. A sebészi kimetszés a leggyakrabban alkalmazott eljárás, és úgy tűnik, egyetértés van abban, hogy ez a legjobb megoldás, mivel a gyógyulási arány magas, különösen a kis és közepes méretű elváltozások esetében. Egyéb lehetőségeket (krioterápia, elektródasikálás és kürettálás, sugárterápia, helyi kemoterápia stb.) olyan betegeknél alkalmaznak, akiknél a műtét ellenjavallt14 , akár a daganat jellemzői (száma vagy mérete), akár a beteg általános tényezői (életkor, altatási kockázat stb.) miatt. Mivel ezek a daganatok perineurális infiltrációval és multifocalitással nagyon agresszívvá válhatnak, és különösen a kiújulásos esetekben, néha kiterjedt reszekciót tesznek szükségessé, amely komplex rekonstrukciót igénylő defektusokat hagy maga után, mint a 4. betegnél, akinél mikrovaszkularizált fibula és radiális lebeny segítségével végeztek mandibularekonstrukciót.
A bazális sejtes karcinóma sebészi eltávolítása több mint 90%-os gyógyulási arányt mutat. A műtéti peremek jól meghatározottak, és a gyógyulás akkor tekinthető gyógyultnak, ha a peremek tiszták. Mint más kezelési formák esetében is, a méret, a lokalizáció és a szövettani altípus hozzájárul az általános prognózishoz. Nincs egységes ajánlás a műtéti margók határértékére vonatkozóan. A legtöbb sebész a kis, jól körülírt elváltozások esetében legalább 3-5 mm-es szélességet választ, a nagy, agresszív elváltozások esetében pedig legalább 1 cm-t.
A kezelés ellentmondásos azon daganatok esetében, amelyeknél az anatómiai patológiai jelentés szerint a szélesség érintett. A nem szindrómás betegeken végzett különböző vizsgálatok 4 és 16,6% közötti pozitív marginális érintettségről számoltak be15-18. Sorozatunkban az elváltozások 28%-ának volt szövettanilag szoros és/vagy érintett margója, ami az általános populációban tapasztaltakhoz képest magas arány. A szakirodalom szerint a fej-nyaki régióban magasabb a marginális érintettség aránya, ami azzal magyarázható, hogy a tumorokat nehéz eltávolítani a nemes anatómiai struktúrák sérülése nélkül16,17 . A bazálsejtes karcinómában szenvedő betegek nyomon követésével végzett nagy sorozatokban a nem teljes reszekcióval eltávolított elváltozásoknál 5 év elteltével csak 25%-os kiújulási arányt figyeltek meg13. Ezekben az esetekben a konzervatív kezelés, a későbbi nyomon követés és megfigyelés tűnik a legésszerűbb megközelítésnek19,20, figyelembe véve, hogy a műtéti újbóli beavatkozás után az érintett margóknak csak 28-54%-a mutatható ki15-18. 15-18 Az SGG-ben szenvedő betegek esetében ez a nyomon követési és megfigyelési hozzáállás nagyon is tanácsosnak tűnik a szoros és/vagy pozitív szövettani határral rendelkező, perineurális kiterjedésre nem utaló tumorok esetében, valamint a feltáráshoz könnyen hozzáférhető területeken, figyelembe véve az új karcinómák szórványos megjelenésének nagy valószínűségét és multidiszciplináris jellegét is, ami hosszú távon több további műtéti beavatkozást tehet szükségessé a területen.
A Mohs-féle mikrográfiás műtét a veszélyeztetett területeken (szemhéj, orbitális perem stb.) lévő kiújuló elváltozások sebészi kezelése21. Indikált továbbá olyan daganatok esetében, amelyeket klinikai jellemzőik (szövettani altípus, rosszul meghatározott határok, kiújulásra való hajlam) vagy elhelyezkedésük miatt magas kockázatúnak minősítenek22. Előnye az eljárás módszertanán alapul, amely lehetővé teszi a műtéti peremek 100%-os ellenőrzését, mind a mélységben, mind a felszínen. Ez viszont biztosíthatja a daganat teljes reszekcióját, az egészséges szövetek maximális megőrzését és másodsorban a későbbi rekonstrukció optimalizálását.
Az SGG ugyan nem gyógyítható, de a korai diagnózis segít a multidiszciplináris megközelítésben az olyan szövődmények elkerülése érdekében, mint a napsugárzásnak való kitettség miatt megjelenő új bazális sejtes karcinómák vagy a többszörös keratociszták, amelyek elpusztíthatják az állkapcsokat. A bazálsejtes karcinóma olyan rosszindulatú daganat, amely nem ad áttétet, de súlyosan agresszív lehet, ha a bőr mélyebb rétegeibe hatol. Tekintettel arra, hogy a sebészi kimetszés a leghatékonyabb lehetőség a bazálsejtes karcinóma kezelésében az SGG-ben, fontos a megelőző orvosi megközelítés, hogy megpróbáljuk kezelni az elváltozásokat, amikor azok kis méretűek, hogy csökkentsük a műtét utáni következményeket. Bár számos szakterület rendelkezik kiterjedt tapasztalattal az SGG-vel kapcsolatban, amint azt a nagyszámú publikáció is bizonyítja, az alapellátás hiányzik ezen a területen, ezért szükség van az egészségügyi oktatás vagy a szakemberek képzésének előmozdítására ezen a területen a korai diagnózis és következésképpen a kezelés korai megkezdésének és a jobb prognózisnak a növelése érdekében. Számos epidemiológiai vizsgálat eredményei azt mutatták, hogy a bazálsejtes karcinóma kockázata szoros pozitív korrelációt mutat az UV-expozícióval, ezért ezeknek a betegeknek kerülniük kell a túlzott napozást. Hasonlóképpen, a sugárterápiát lehetőség szerint kerülni kell a bazális sejtes karcinóma kialakulásának és kiújulásának kockázata miatt. A bőrelváltozások elkerülésére kemoprevenciót lehet alkalmazni. Az A-vitamin-analógok, mint például a retinoidok vagy az izotretinoin, fontos szerepet játszhatnak az új bazálsejtes karcinómák kialakulásának megelőzésében vagy késleltetésében.
Összefoglalva, a GGS-ben szenvedő betegek bazálsejtes karcinómái a PTCH-gén mutációi miatt a tumorszuppressziós mechanizmusban bekövetkező változásokhoz kapcsolódnak, ami az ilyen tumorok szórványos előfordulását eredményezi, különösen az ultraibolya sugárzás hatására. A bazálsejtes karcinómák klinikai jellemzői között különbségek vannak az SGG-ben szenvedő betegek és az általános populáció között, főként az elváltozások száma (magasabb az SGG-ben), a megjelenési kor (alacsonyabb az SGG-ben) és a viselkedés (magasabb az agresszivitás és a kiújulási arány az SGG-ben) tekintetében. Az általunk vizsgált 11 beteg 36%-ánál az arc bazális sejtes karcinómája jelentkezett. A szakirodalomban a legszélesebb körben elfogadott kezelés a sebészi kimetszés, és ez volt az összes esetünkben alkalmazott kezelés is. A mi sorozatunkban a tumorok 28%-ának volt szoros és/vagy veszélyeztetett szövettani margója, ami magas arány a nem szindrómás populációban végzett sorozatokhoz képest. A kezdeti kezelést követően a betegek 100%-ánál észleltek új elváltozásokat és kiújulásokat. A szakirodalomban rendelkezésre álló adatok nem elegendőek ahhoz, hogy bizonyítékokon alapuló döntést hozzunk a bazálsejtes karcinóma kezelésére rendelkezésre álló különböző terápiák között. Ajánlott az UV-expozíciót megelőző, megelőző megközelítés.
Etikai felelősség
Az emberek és az állatok védelme. A szerzők kijelentik, hogy a kutatáshoz nem végeztek embereken vagy állatokon kísérleteket.
Az adatok bizalmas kezelése. A szerzők kijelentik, hogy ebben a cikkben nem szerepelnek betegadatok.
A magánélethez való jog és a tájékozott beleegyezés. A szerzők kijelentik, hogy ebben a cikkben nem szerepelnek betegadatok.
Érdekütközés
A szerzők kijelentik, hogy nincs érdekellentét.
Bibliográfia
1. Gorlin RJ, Goltz RW. Többszörös naevoid bazális sejtes epithelioma, állkapocsciszta és kétoldali borda. Egy szindróma. N Engl J Med. 1960; 262:908-12.
2. Stoelinga PJ, Peters JH, van de Staak WJ, Cohen MM. A bazális sejtes naevus szindróma néhány új eredménye. Oral Surg Oral Med Oral Pathol. 1973; 36:686-92.
3. Totten JR. A többszörös naevoid bazálsejtes karcinóma szindróma. Egy család négy generációjánál történt előfordulásáról szóló jelentés. Rák. 1980; 46:1456-62.
4. Visioli F, Martins CA, Heitz C, Rados PV, Sant’Ana Filho M. Tényleg olyan ritka a nevoid bazálsejtes karcinóma szindróma? Javaslat vizsgálati protokollra egy esetsorozat alapján. J Oral Maxillofac Surg. 2010; 68:903-8.
5. Evans DG, Ladusans EJ, Rimmer S, Burnell LD, Thakker N, Farndon PA. A nevoid bazálsejtes karcinóma szindróma szövődményei: egy populáción alapuló vizsgálat eredményei. J Med Genet. 1993; 30:460-4.
6. Díaz-Fernández JM, Infante-Cossío P, Belmonte-Caro R, Ruiz-Laza L, García-Perla-García A, Gutiérrez-Pérez JL. Bazális sejtes naevus szindróma. Hat eset bemutatása és irodalmi áttekintés. Med Oral Patol Oral Cir Bucal. 2005; 10 Suppl 1:E57-66.
7. Roewert-Huber J, Lange-Asschenfeldt B, Stockfleth E, Kerl H. A bazálsejtes karcinóma epidemiológiája és etiológiája. Br J Dermatol. 2007; 157 Suppl 2:47-51.
8. Kyrgidis A, Tzellos TG, Vahtsevanos K, Triaridis S. A bazális sejtes karcinóma új koncepciói. Demográfiai, klinikai, szövettani kockázati tényezők és biomarkerek. A tumor kialakulásának kockázatára, a második primerre és a kiújulásra való hajlamra vonatkozó bizonyítékok szisztematikus áttekintése. J Surg Res. 2010; 159:545-56.
9. Pauwels C, Mazereeuw-Hautier J, Basset-Seguin N, Livideanu C, Viraben R, Paul C, et al. Topikus metil-aminolevulinát fotodinamikus terápia a bazális sejtes karcinómák kezelésére bazális sejtes naevus szindrómás betegeknél javítja a betegek elégedettségét és csökkenti a sebészeti beavatkozások szükségességét. J Eur Acad Dermatol Venereol. 2011; 25:861-4.
10. Micali G, de Pasquale R, Caltabiano R, Impallomeni R, Lacarrubba F. Felületes és csomós bazális sejtes karcinómák topikális imikimod kezelése bazális sejtes naevus szindrómában szenvedő betegeknél: előzetes jelentés. J Dermatolog Treat. 2002; 13:123-7.
11. Chren MM, Torres JS, Stuart SE, Bertenthal D, Labrador RJ, Boscardin WJ. Recurrence after treatment of nonmelanoma skin cancer: a prospective cohort study. Arch Dermatol. 2011; 147:540-6.
12. Wallace DL, Jaffe W. Reply to: Do basal cell carcinomas recidive after complete conventional surgical excision? R.W. Griffiths, S.K., Suvarna. J. Stone BJPS. 2005; 58:795-805. J Plast Reconstr Aesthet Surg 2006;59:1247.
13. Sherry KR, Reid LA, Wilmshurst AD. A bazálsejtes karcinóma kimetszéseinek ötéves áttekintése. J Plast Reconstr Aesthet Surg. 2010; 63:1485-9.
14. Kopera D, Cerroni L, Fink-Puches R, Kerl H. Különböző kezelési módok a nevoid bazálsejtes karcinóma szindrómában szenvedő beteg kezelésében. J Am Acad Dermatol. 1996; 34:937-9.
15. Patel SS, Cliff SH, Ward Booth P. A bazálsejtes karcinóma nem teljes eltávolítása: mi az értéke a további műtéteknek? Oral Maxillofac Surg. 2012. (Epub ahead of print).
16. Farhi D, Dupin N, Palangié A, Carlotti A, Avril MF. A bazálsejtes karcinóma nem teljes kimetszése: arány és kapcsolódó tényezők 362 egymást követő esetben. Dermatol Surg. 2007; 33:1207-14.
17. Bogdanov-Berezovsky A, Cohen A, Glesinger R, Cagnano E, Krieger Y, Rosenberg L. Klinikai és patológiai leletek a hiányosan kimetszett bazális sejtes karcinómák újbóli kimetszésénél. Ann Plast Surg. 2001; 47:299-302.
18. Kumar P, Orton CI, McWilliam LJ, Watson S. A hiányos kimetszés előfordulása sebészileg kezelt bazálsejtes karcinómában: retrospektív klinikai ellenőrzés. Br J Plast Surg. 2000; 53:563-6.
19. Griffiths RW, Suvarna SK, Stone J. Basalioma szövettani clearance margins: 1539 konvencionálisan kimetszett tumor elemzése. Még szélesebb és mélyebb? J Plast Reconstr Aesthet Surg. 2007; 60:41-7.
20. Anthony ML. A nem melanoma bőrrák sebészi kezelése. AORN J. 2000; 71:552-4. 556-8, 560-4.
21. Mosterd K, Krekels GA, Nieman FH, Ostertag JU, Essers BA, Dirksen CD, et al. Surgical excision versus Mohs’ micrographic surgery for primary and recurrent basal-cell carcinoma of the fa a prospective randomized controlled trial with 5-years’ follow-up. Lancet Oncol. 2008; 9:1149-56.
22. Galimberti G, Pontón Montaño A, Ferrario D, Kowalczuk A, Galimberti R. Mohs mikrográfiás sebészet a bazális sejtes karcinóma kezelésében. Actas Dermosifiliogr. 2010; 101:853-7.