ORIGINAL
Syndrome de Gorlin-Goltz : prise en charge du carcinome basocellulaire facial
Syndrome de Gorlin-Goltz : gestion du carcinome basocellulaire facial
Rocío Gilabert Rodrígueza, Pedro Infante Cossíob, Pablo Redondo Parejob, Eusebio Torres Carranzab, Alberto García-Perla Garcíab et Domingo Sicilia Castroa
aService de chirurgie plastique et reconstructive, Hospital Universitario Virgen del Rocío, Séville, Espagne
bService de chirurgie orale et maxillo-faciale, Hospital Universitario Virgen del Rocío, Séville, Espagne
Adresse pour la correspondance
Sommaire
Introduction/Objectif : Le syndrome de Gorlin-Goltz (SGG) est une maladie héréditaire autosomique dominante qui prédispose principalement à la prolifération de tumeurs telles que les carcinomes basocellulaires et les kératocystes maxillaires. Les carcinomes basocellulaires qui apparaissent chez les patients atteints de SGG sont généralement multiples, d’aspect clinique polymorphe, sans prédilection pour le sexe, parfois détectés tôt dans la vie et affectant même les zones non exposées au soleil. Leur comportement clinique est variable, bien qu’ils puissent parfois être très agressifs, notamment au niveau du visage. Afin d’étudier le comportement des carcinomes basocellulaires chez les patients atteints de GCS, une étude a été menée sur les patients traités dans notre hôpital entre 2001 et 2011 et répondant aux critères de la maladie.
Matériel et méthodes : 11 patients avec un diagnostic clinique et/ou génétique de GGG ont été inclus. Nous avons étudié la répartition selon l’âge et le sexe, les manifestations cliniques, les caractéristiques histologiques, la technique chirurgicale utilisée, la présence de récidive et l’évolution des patients.
Résultats : 36% des patients avaient des carcinomes basocellulaires sur le visage. Le nombre de tumeurs par patient variait de 9 à 21. L’excision chirurgicale était le traitement privilégié, bien que tous les patients aient développé de nouvelles lésions et des récidives nécessitant plusieurs interventions. L’étude histologique a révélé un contact ou une proximité de la tumeur avec les marges chirurgicales dans 28% des lésions.
Conclusions : Il n’y a pas suffisamment de preuves dans la littérature pour déterminer le traitement de choix parmi les différentes méthodes disponibles pour la gestion du carcinome basocellulaire dans le SGG. Une approche préventive évitant l’exposition au soleil est nécessaire.
Mots clés : syndrome de Gorlin-Goltz. Le syndrome du carcinome basocellulaire névoïde. Carcinome basocellulaire. Queratoquiste maxilaire.
ABSTRACT
Introduction/objectif : Le syndrome de Gorlin Goltz (SGG) est une maladie héréditaire autosomique dominante qui prédispose principalement à la prolifération de tumeurs, telles que les carcinomes basocellulaires et les kératocystes maxillaires. Les carcinomes basocellulaires chez les patients atteints de la maladie se présentent généralement sous la forme de tumeurs multiples, avec des caractéristiques cliniques polymorphes, sans prédilection pour le sexe, survenant parfois à un stade précoce de la vie et affectant même des zones non exposées au soleil. Le comportement clinique peut varier, et peut parfois être très agressif, notamment au niveau du visage. Afin d’étudier le comportement des carcinomes basocellulaires chez les patients atteints de GGS, une étude a été réalisée sur les patients qui répondaient aux critères de la maladie et qui ont été traités dans notre hôpital dans la période entre 2001 et 2011.
Matériel et méthodes : L’étude a inclus 11 patients ayant un diagnostic clinique et/ou génétique de SGG. Les patients ont été étudiés selon le sexe et l’âge, les aspects cliniques, les caractéristiques histologiques, le traitement chirurgical fourni, la présence de récidive et le suivi.
Résultats : Des carcinomes basocellulaires ont été observés sur le visage chez 36% des patients. Le nombre de tumeurs par patient variait entre 9 et 21. Le traitement privilégié était l’excision chirurgicale, bien que tous les patients aient développé de nouvelles lésions et des récidives qui ont nécessité plusieurs interventions. L’étude histologique a révélé un contact ou une proximité de la tumeur avec les marges chirurgicales dans 28% des lésions.
Conclusions : Il n’y a pas suffisamment de preuves dans la littérature pour déterminer le traitement de choix parmi les différentes méthodes disponibles pour la gestion du carcinome basocellulaire dans le GGS. Une approche préventive est nécessaire pour éviter l’exposition au soleil.
Mots clés : syndrome de Gorlin-Goltz. Syndrome du carcinome basocellulaire névoïde. Carcinome basocellulaire. Kératocyste de la mâchoire.
Introduction
Le syndrome de Gorlin-Goltz (SGG) a été décrit en 1960 par ses auteurs éponymes, Gorlin et Goltz1. Ils ont initialement décrit la triade qui caractérise le syndrome : carcinomes basocellulaires multiples, kératocystes maxillaires et côtes bifides. Également connu sous le nom de syndrome des cellules basales nævoïdes ou de syndrome du carcinome basocellulaire nævoïde, entre autres, on sait maintenant qu’il s’agit d’une maladie génétique à transmission autosomique dominante, à pénétrance incomplète et à phénotype variable2,3. Elle est due à une mutation du gène Patched (PTCH), un gène suppresseur de tumeur situé sur le chromosome 9 (9q22, 3-q31). Sa prévalence estimée varie de 1:57 000 à 1:164 000 selon les pays, avec une prévalence moyenne généralement admise d’environ 1:60 0004.
Le SGG est une maladie caractérisée cliniquement par une prédisposition au développement de multiples néoplasmes, ainsi que par l’apparition d’anomalies du développement. L’apparition clinique se produit dans l’enfance ou l’adolescence et s’accompagne de l’association de plusieurs manifestations, la plus courante étant la présence de nombreux carcinomes basocellulaires et de kératocystes odontogènes maxillaires. Les autres manifestations comprennent l’hyperkératose palmoplantaire, les anomalies du squelette, les calcifications intracrâniennes ectopiques et la dysmorphie faciale (macrocéphalie, fente labiale et palatine et anomalies oculaires graves)5. Un déficit intellectuel est présent dans environ 5 % des cas. Des problèmes oculaires, génito-urinaires et cardiovasculaires peuvent également être présents6 . Les médulloblastomes malins se développent chez 5 à 10 % des patients atteints de SGG et peuvent être une cause potentielle de décès précoce. Le diagnostic est établi lorsque 2 critères cliniques majeurs ou 1 critère majeur et 2 critères mineurs sont réunis5 (tableau 1). Le test de diagnostic définitif consiste à mettre en évidence une mutation du gène PTCH.

Les tumeurs apparaissent dans le SGG à la suite d’une altération des pro-oncogènes ou des gènes suppresseurs de tumeurs. Ces derniers exercent une fonction suppressive sur les pro-oncogènes. Dans le cas du carcinome basocellulaire, on ne sait pas exactement quel pro-oncogène est impliqué. La voie RAS est altérée mais pas dans tous les cas. En ce qui concerne les gènes suppresseurs de tumeurs, il semble que le p53 joue un rôle secondaire dans le développement de cette tumeur. La prédisposition de ces patients aux carcinomes cutanés semble être due au fait que les cellules affectées par la mutation sont plus sensibles à la lumière du soleil en raison de mécanismes de réparation de l’ADN altérés. Les carcinomes basocellulaires affectent n’importe quelle zone de l’anatomie cutanée mais apparaissent principalement dans les zones exposées aux rayons ultraviolets, notamment le visage, le dos et la poitrine. Il existe certaines différences entre les carcinomes basocellulaires survenant dans la population générale et chez les patients atteints de SGB. Chez ces derniers, ils sont plus souvent nombreux, d’aspect polymorphe, sans prédilection pour le sexe et peuvent même toucher des zones non exposées au soleil. Ils se présentent généralement cliniquement sous des formes multiples6, en nombre allant de quelques uns à des centaines, apparaissant tôt dans la vie (même à la naissance) ; leur comportement clinique est variable, bien qu’ils puissent parfois être très agressifs d’emblée, surtout au niveau du visage.
La plupart des preuves cliniques disponibles sur la gestion du carcinome basocellulaire dans le SGT proviennent d’études menées chez des patients non affectés par le syndrome. En raison de la grande expérience de ces tumeurs dans la population générale, la plupart des auteurs appliquent les mêmes mesures thérapeutiques aux patients atteints de SGB.
L’objectif de cette étude était d’analyser la prise en charge du carcinome basocellulaire facial chez les patients atteints de SGB afin d’évaluer le comportement clinique et les critères diagnostiques et thérapeutiques sur la base d’une étude clinique des patients traités par SGB au cours des 10 dernières années à l’Hospital Universitario Virgen del Rocío de Séville (Espagne).
Matériels et méthodes
Les dossiers cliniques des patients diagnostiqués avec un SGT entre 2001 et 2011 vus dans les services de chirurgie orale et maxillo-faciale et de chirurgie plastique et reconstructive ont été étudiés de manière observationnelle et rétrospective. Onze patients ayant reçu un diagnostic clinique et/ou génétique de SGG ont été inclus, en excluant ceux dont l’histoire clinique était incomplète malgré le diagnostic. Les données épidémiologiques (âge et sexe) et les données médico-chirurgicales (nombre et localisation des lésions, diagnostic histopathologique, technique chirurgicale utilisée, présence de récidive et évolution) ont été analysées. Le suivi clinique s’est fait par des contrôles périodiques avec une moyenne de 4,5 ans.
Résultats
L’âge moyen des patients était de 27 ans, la majorité étant des hommes (73%). Dans 45% des cas, l’âge au moment du diagnostic était inférieur à 20 ans. Un diagnostic clinique a été posé chez 9 patients (2 critères majeurs ou 1 critère majeur et 2 critères mineurs), tandis que 2 patients ont eu un diagnostic génétique. Trois patients avaient des antécédents familiaux (tableau 2).

En termes de caractéristiques cliniques (tableau 3), le kératocyste maxillaire était le signe clinique le plus fréquent, présent chez 91% de l’échantillon (10 patients). Elle était suivie par des altérations du squelette (63 %) et une fasciite caractéristique (54 %). Quatre des 11 patients (36 %) ont développé des carcinomes basocellulaires (tableau 4). Le nombre de lésions par patient variait de 9 à 21, le nombre exact de lésions n’ayant pas été enregistré chez un patient. Toutes étaient principalement localisées dans la région du visage (fig. 1 et 2), puis dans le cou et le dos. Une excision chirurgicale des lésions a été réalisée dans tous les cas (fig. 3). L’examen pathologique a révélé une histologie nodulaire dans la plupart des cas et une forte proportion de marges chirurgicales étaient touchées (28% des lésions présentaient un contact ou une proximité de la tumeur avec la marge). Dans tous les cas, plus d’une intervention chirurgicale a été effectuée.
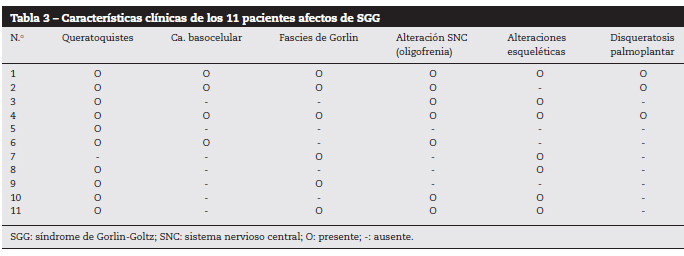

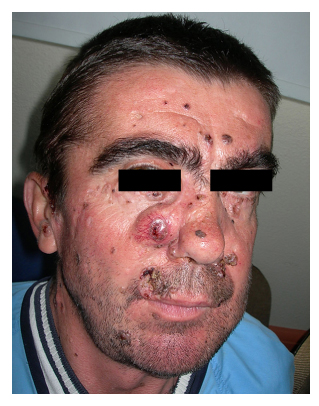
Figure 1. Numéro de patient 6.
Multiples carcinomes basocellulaires du visage.
Figure 2. Patient numéro 2 montrant
un carcinome basocellulaire sur la joue.

Figure 3. Patient numéro 1.
A : Image préopératoire de multiples carcinomes basocellulaires sur le visage et le cou.
B : Détail postopératoire immédiat après excision.
Le patient numéro 4 a développé de multiples carcinomes basocellulaires récurrents sur le tiers inférieur du visage nécessitant une excision agressive incluant une mandibulectomie et une reconstruction immédiate avec 2 lambeaux libres séquentiels (ostéoseptocutané du péroné et fasciocutané antébrachial) (fig. 4). Le patient numéro 6 présentait un carcinome épidermoïde situé sur le corps mandibulaire en association avec un kératocyste, et en est décédé.

Figure 4. A : Carcinomes basocellulaires récurrents dans le tiers inférieur du visage.
B : Reconstruction 3D-CT montrant l’os et l’implication périneurale.
C : Excision agressive avec mandibulectomie.
D : Reconstruction complexe avec 2 lambeaux libres séquentiels
(ostéoseptocutané du péroné et fasciocutané antébrachial avec tendon du palmaris mineur).
E : Radiographie panoramique postopératoire.
F : Image postopératoire du patient.
Discussion
Comme point de départ, une revue de la littérature a été effectuée pour évaluer les informations scientifiques publiées sur le SGG au cours des 10 dernières années, ce qui a révélé un intérêt croissant pour le sujet, principalement dans les revues des domaines de la dermatologie, de la chirurgie orale et maxillo-faciale, de la dentisterie et de la génétique. Le plus grand nombre d’articles est regroupé dans les revues de dermatologie, peut-être parce que les carcinomes basocellulaires sont l’une des lésions les plus fréquentes et les plus récurrentes et qu’ils se trouvent dans une localisation (notamment sur la peau du visage) qui les rend plus visibles et plus faciles à diagnostiquer. Le groupe suivant de revues, par ordre de fréquence, est celui des revues de chirurgie orale et maxillo-faciale, de dentisterie et de génétique. Les kératocystes maxillaires sont les lésions les plus fréquentes dans ce syndrome et sont souvent le symptôme directeur qui oriente le diagnostic.
Dans notre série, comme largement rapporté dans la littérature, le kératocyste maxillaire était le signe clinique le plus fréquent présent chez 10 patients. Un seul patient n’avait pas de kératocystes maxillaires, bien que le jeune âge de ce patient puisse expliquer le manque de temps pour leur développement (patient numéro 7). Il y avait une nette prédominance d’hommes, bien qu’aucune prédilection pour le sexe ne soit décrite dans la littérature, de sorte qu’aucune conclusion ne peut être tirée de ce fait étant donné la petite taille de l’échantillon. Il y a 4 cas typiques de SGG à haute expression phénotypique (numéros de patients 1, 2, 4 et 6) dans lesquels nous pouvons voir que les manifestations cliniques les plus prédominantes (kératocystes maxillaires et carcinomes basocellulaires) sont présentes. Bien que l’on suppose un parent atteint dans la plupart des cas, ce n’est pas le cas dans notre série, où seuls 3 patients (27 par rapport aux 70-80% rapportés dans la littérature) ont au moins un membre de la famille atteint qui nous est connu (tableau 2). Quatre des 11 patients atteints de SGG ont développé des carcinomes basocellulaires. Cela représente 36% d’implication, un pourcentage faible par rapport à la fréquence de 90% considérée classiquement pour cette maladie. Il est important de noter le jeune âge de certains des patients. Bien que ces lésions aient été décrites dans ce syndrome dès la naissance, ce n’est pas la norme et plusieurs années d’exposition aux facteurs de risque (rayonnement ultraviolet) sont nécessaires pour l’expression clinique. Cependant, l’âge moyen des patients atteints de carcinome basocellulaire dans cette série était de 39 ans (19 ans le plus jeune).
Le carcinome basocellulaire est considéré comme l’une des tumeurs cutanées malignes les plus fréquentes, en particulier chez les Caucasiens dans les régions géographiques proches de l’équateur où il est associé à l’exposition aux rayons ultraviolets chez les individus à la peau claire.7 Dans la population générale, cette maladie survient entre la sixième et la septième décennie de vie et son incidence a considérablement augmenté ces dernières années. Dans la population générale, cette maladie survient entre la sixième et la septième décennie de la vie et son incidence a considérablement augmenté ces dernières années. L’exposition chronique au soleil est la principale cause du carcinome basocellulaire et, par conséquent, les lésions apparaissent généralement sur les parties exposées du corps : visage, oreilles, cou, cuir chevelu, épaules et dos. Les facteurs étiologiques connus sont l’exposition aux rayons ultraviolets (à court et à long terme), certains agents chimiques cancérigènes (arsenic et hydrocarbures), les rayonnements ionisants et les irritations chroniques, entre autres. Il existe plusieurs formes syndromiques, dont le xeroderma pigmentosum et le syndrome névrotique basocellulaire (SNB), entre autres8.
La prise en charge du carcinome basocellulaire dans le SNB est peu étudiée et fait principalement référence à un traitement conservateur. Pauwels et al. ont présenté la thérapie photodynamique comme une option pour le traitement du carcinome basocellulaire chez les patients atteints de SGG avec des résultats favorables par rapport à la chirurgie9. Micali et al. ont analysé le rôle de l’imiquimod topique pour le traitement du carcinome basocellulaire chez les patients atteints de SGG et ont souligné que cette modalité thérapeutique était une option efficace en raison de la grande coopération des patients qui la préfèrent aux excisions chirurgicales multiples10. Dans les études sur la prise en charge du carcinome basocellulaire dans la population générale, le traitement chirurgical (excision simple avec suivi clinique des lésions avec atteinte des marges) se distingue des autres options thérapeutiques11-13. Bien que le comportement du carcinome basocellulaire dans la population générale soit différent de celui du SGT, jusqu’à ce que d’autres études spécifiques soient disponibles, il semble plus que raisonnable d’appliquer la vaste expérience dont nous disposons à ces patients.
Le traitement des carcinomes basocellulaires implique l’ablation complète de la lésion, qui peut être réalisée par plusieurs méthodes. L’excision chirurgicale est la procédure la plus couramment utilisée et il semble y avoir un consensus sur le fait qu’il s’agit de la meilleure option étant donné son taux de guérison élevé, en particulier pour les lésions de petite et moyenne taille. D’autres options (cryothérapie, électrodessiccation et curetage, radiothérapie, chimiothérapie topique, etc.) sont utilisées chez les patients pour lesquels la chirurgie est contre-indiquée14, soit en raison des caractéristiques de la tumeur (nombre ou taille), soit en raison de facteurs généraux liés au patient (âge, risque anesthésique, etc.). Comme ces tumeurs peuvent devenir très agressives avec une infiltration périneurale et une multifocalité, et surtout en cas de récidive, elles peuvent parfois nécessiter des résections étendues qui laissent des défauts nécessitant des reconstructions complexes, comme cela s’est produit chez le patient 4, chez qui une reconstruction mandibulaire a été réalisée avec un lambeau de fibula et radial microvascularisé.
L’ablation chirurgicale du carcinome basocellulaire a un taux de guérison de plus de 90%. Les marges chirurgicales sont bien définies, la guérison étant considérée comme acquise si les marges sont claires. Comme pour les autres formes de traitement, la taille, la localisation et le sous-type histologique contribuent au pronostic global. Il n’existe pas de recommandation uniforme sur la limite des marges chirurgicales. La plupart des chirurgiens choisissent une marge d’au moins 3 à 5 mm en surface et en profondeur pour les petites lésions bien circonscrites et de 1 cm ou plus pour les grandes lésions agressives.
La prise en charge est controversée dans les tumeurs pour lesquelles le rapport d’anatomopathologie indique que les marges sont atteintes. Différentes études chez des patients non syndromiques ont rapporté une implication positive des marges entre 4 et 16,6%15-18. Dans notre série, 28% des lésions avaient des marges histologiquement proches et/ou impliquées, un taux élevé comparé à ceux rapportés dans la population générale. La littérature suggère que la région de la tête et du cou présente un taux plus élevé d’atteinte des marges, ce qui peut s’expliquer par la difficulté d’enlever les tumeurs sans endommager les structures anatomiques nobles16,17. Dans de grandes séries avec suivi de patients atteints de carcinomes basocellulaires, seul un taux de récidive de 25 % à 5 ans a été observé dans les lésions avec résection incomplète13. Une gestion conservatrice avec un suivi et une observation ultérieurs semble être l’approche la plus judicieuse dans ces cas19,20, sachant qu’après une réintervention chirurgicale, seuls 28 à 54 % des marges affectées sont démontrées15-18. 15-18 Chez les patients atteints de SGG, cette attitude de suivi et d’observation semble fortement conseillée pour les tumeurs présentant des marges histologiques proches et/ou positives sans signe d’extension périneurale et dans des zones facilement accessibles à l’exploration, compte tenu également de la forte probabilité d’apparition sporadique de nouveaux carcinomes et de leur multidisciplinarité, qui peuvent nécessiter à long terme plusieurs interventions chirurgicales supplémentaires dans la zone.
La chirurgie micrographique de Mohs est le traitement chirurgical de choix pour les lésions récurrentes dans les zones compromises (paupières, rebords orbitaux, etc.)21. Elle est également indiquée pour les tumeurs dont les caractéristiques cliniques (sous-type histologique, frontières mal définies, tendance à la récidive) ou la localisation les classent comme à haut risque22. Son avantage repose sur la méthodologie de la procédure, qui permet de contrôler à 100% les marges chirurgicales, tant en profondeur qu’en surface. Cela permet à son tour d’assurer une résection complète de la tumeur, de garantir une préservation maximale des tissus sains et, accessoirement, d’optimiser la reconstruction ultérieure.
Bien que le SGG ne puisse pas être guéri, un diagnostic précoce permet de proposer une approche multidisciplinaire pour éviter des complications telles que l’apparition de nouveaux carcinomes basocellulaires en raison de l’exposition aux rayonnements solaires ou de kératocystes multiples pouvant détruire les mâchoires. Le carcinome basocellulaire est une tumeur maligne qui ne provoque pas de métastases mais qui peut être sérieusement agressive si elle s’infiltre dans les couches profondes de la peau. Étant donné que l’excision chirurgicale est l’option la plus efficace dans la gestion du carcinome basocellulaire dans le SGG, il est important d’avoir une approche médicale préventive pour essayer de traiter les lésions lorsqu’elles sont de petite taille afin de réduire les séquelles post-chirurgicales. Bien que plusieurs spécialités aient une grande expérience des SGG, comme en témoigne le grand nombre de publications, les soins primaires sont absents dans ce domaine, d’où la nécessité de promouvoir l’éducation sanitaire ou la formation des professionnels de ce secteur afin d’augmenter le diagnostic précoce et, par conséquent, l’initiation précoce du traitement et l’amélioration du pronostic. Les résultats de plusieurs études épidémiologiques ont indiqué que le risque de carcinome basocellulaire présente une forte corrélation positive avec l’exposition aux UV et que ces patients doivent donc éviter une exposition excessive au soleil. De même, la radiothérapie doit être évitée si possible en raison du risque d’apparition et de récidive des carcinomes basocellulaires. La chimioprévention peut être utilisée pour éviter les lésions cutanées. Les analogues de la vitamine A, tels que les rétinoïdes ou l’isotrétinoïne, peuvent jouer un rôle important dans la prévention ou le retardement du développement de nouveaux carcinomes basocellulaires.
En résumé, les carcinomes basocellulaires chez les patients atteints de SGG sont associés à des altérations du mécanisme de suppression des tumeurs dues à des mutations du gène PTCH, ce qui entraîne la survenue sporadique de ces tumeurs, en particulier en relation avec le rayonnement ultraviolet. Il existe des différences entre les caractéristiques cliniques des carcinomes basocellulaires chez les patients atteints de SGG et dans la population générale, principalement en termes de nombre de lésions (plus élevé chez les SGG), d’âge de présentation (plus bas chez les SGG) et de comportement (agressivité et taux de récidive plus élevés chez les SGG). Dans notre examen de 11 patients, 36% présentaient des carcinomes basocellulaires sur le visage. Le traitement le plus largement accepté dans la littérature est l’excision chirurgicale et c’est également le traitement utilisé dans tous nos cas. Dans notre série, 28% des tumeurs avaient des marges histologiques étroites et/ou compromises, un taux élevé comparé aux séries de la population non syndromique. De nouvelles lésions et des récidives ont été détectées chez 100 % des patients après le traitement initial. Les données existantes dans la littérature sont insuffisantes pour prendre des décisions fondées sur des preuves parmi les différentes thérapies disponibles pour la gestion du carcinome basocellulaire dans le SGG. Une approche préventive évitant l’exposition aux UV est recommandée.
Responsabilités éthiques
Protection des humains et des animaux. Les auteurs déclarent qu’aucune expérience sur des humains ou des animaux n’a été réalisée pour cette recherche.
Confidentialité des données. Les auteurs déclarent qu’aucune donnée de patient n’apparaît dans cet article.
Droit à la vie privée et au consentement éclairé. Les auteurs déclarent qu’aucune donnée de patient n’apparaît dans cet article.
Conflit d’intérêt
Les auteurs déclarent ne pas avoir de conflit d’intérêt.
Bibliographie
1. Gorlin RJ, Goltz RW. Épithélioma basocellulaire névoïde multiple, kyste de la mâchoire et côte bifide. Un syndrome. N Engl J Med. 1960 ; 262:908-12.
2. Stoelinga PJ, Peters JH, van de Staak WJ, Cohen MM. Quelques nouvelles découvertes dans le syndrome du naevus basocellulaire. Oral Surg Oral Med Oral Pathol. 1973 ; 36:686-92.
3. Totten JR. Le syndrome du carcinome basocellulaire névoïde multiple. Rapport sur son apparition dans quatre générations d’une famille. Le cancer. 1980 ; 46:1456-62.
4. Visioli F, Martins CA, Heitz C, Rados PV, Sant’Ana Filho M. Is nevoid basal cell carcinoma syndrome really so rare ? Proposition d’un protocole d’investigation basé sur une série de cas. J Oral Maxillofac Surg. 2010 ; 68:903-8.
5. Evans DG, Ladusans EJ, Rimmer S, Burnell LD, Thakker N, Farndon PA. Complications du syndrome du carcinome basocellulaire névoïde : résultats d’une étude basée sur la population. J Med Genet. 1993 ; 30:460-4.
6. Díaz-Fernández JM, Infante-Cossío P, Belmonte-Caro R, Ruiz-Laza L, García-Perla-García A, Gutiérrez-Pérez JL. Le syndrome du nævus basocellulaire. Présentation de six cas et revue de la littérature. Med Oral Patol Oral Cir Bucal. 2005 ; 10 Suppl 1:E57-66.
7. Roewert-Huber J, Lange-Asschenfeldt B, Stockfleth E, Kerl H. Épidémiologie et étiologie du carcinome basocellulaire. Br J Dermatol. 2007 ; 157 Suppl 2:47-51.
8. Kyrgidis A, Tzellos TG, Vahtsevanos K, Triaridis S. Nouveaux concepts pour le carcinome basocellulaire. Facteurs de risque démographiques, cliniques, histologiques et biomarqueurs. Une revue systématique des preuves concernant le risque de développement de la tumeur, la susceptibilité à une seconde primaire et la récidive. J Surg Res. 2010 ; 159:545-56.
9. Pauwels C, Mazereeuw-Hautier J, Basset-Seguin N, Livideanu C, Viraben R, Paul C, et al. La thérapie photodynamique topique à l’aminolévulinate de méthyle pour la gestion des carcinomes basocellulaires chez les patients atteints du syndrome du naevus basocellulaire améliore la satisfaction du patient et réduit le besoin de procédures chirurgicales. J Eur Acad Dermatol Venereol. 2011 ; 25:861-4.
10. Micali G, de Pasquale R, Caltabiano R, Impallomeni R, Lacarrubba F. Traitement topique à l’imiquimod des carcinomes basocellulaires superficiels et nodulaires chez les patients affectés par le syndrome du naevus basocellulaire : un rapport préliminaire. J Dermatolog Treat. 2002 ; 13:123-7.
11. Chren MM, Torres JS, Stuart SE, Bertenthal D, Labrador RJ, Boscardin WJ. Récidive après traitement du cancer de la peau sans mélanome : une étude de cohorte prospective. Arch Dermatol. 2011 ; 147:540-6.
12. Wallace DL, Jaffe W. Réponse à : Les carcinomes basocellulaires récidivent-ils après une excision chirurgicale conventionnelle complète ? R.W. Griffiths, S.K., Suvarna. J. Stone BJPS. 2005 ; 58:795-805 ; J Plast Reconstr Aesthet Surg 2006;59:1247.
13. Sherry KR, Reid LA, Wilmshurst AD. Un examen de cinq ans des excisions de carcinome basocellulaire. J Plast Reconstr Aesthet Surg. 2010 ; 63:1485-9.
14. Kopera D, Cerroni L, Fink-Puches R, Kerl H. Différentes modalités de traitement pour la gestion d’un patient atteint du syndrome de carcinome basocellulaire névoïde. J Am Acad Dermatol. 1996 ; 34:937-9.
15. Patel SS, Cliff SH, Ward Booth P. Ablation incomplète d’un carcinome basocellulaire : quelle est la valeur d’une chirurgie supplémentaire ? Oral Maxillofac Surg. 2012. (Epub avant impression).
16. Farhi D, Dupin N, Palangié A, Carlotti A, Avril MF. Excision incomplète du carcinome basocellulaire : taux et facteurs associés parmi 362 cas consécutifs. Dermatol Surg. 2007 ; 33:1207-14.
17. Bogdanov-Berezovsky A, Cohen A, Glesinger R, Cagnano E, Krieger Y, Rosenberg L. Résultats cliniques et pathologiques dans la réexcision de carcinomes basocellulaires incomplètement excisés. Ann Plast Surg. 2001 ; 47:299-302.
18. Kumar P, Orton CI, McWilliam LJ, Watson S. Incidence de l’excision incomplète dans les carcinomes basocellulaires traités chirurgicalement : un audit clinique rétrospectif. Br J Plast Surg. 2000 ; 53:563-6.
19. Griffiths RW, Suvarna SK, Stone J. Marges de dégagement histologiques du carcinome basocellulaire : une analyse de 1539 tumeurs excisées conventionnellement. Plus large encore et plus profond ? J Plast Reconstr Aesthet Surg. 2007 ; 60:41-7.
20. Anthony ML. Traitement chirurgical du cancer de la peau sans mélanome. AORN J. 2000 ; 71:552-4. 556-8, 560-4.
21. Mosterd K, Krekels GA, Nieman FH, Ostertag JU, Essers BA, Dirksen CD, et al. Excision chirurgicale contre chirurgie micrographique de Mohs pour le carcinome basocellulaire primaire et récurrent du fa un essai contrôlé randomisé prospectif avec un suivi de 5 ans. Lancet Oncol. 2008 ; 9:1149-56.
22. Galimberti G, Pontón Montaño A, Ferrario D, Kowalczuk A, Galimberti R. Chirurgie micrographique de Mohs pour le traitement du carcinome basocellulaire. Actas Dermosifiliogr. 2010 ; 101:853-7.