US Pharm. 2015;40(12):HS5-HS11.
ABSTRACT: Cirros är en heterogen diagnos som påverkar leverfunktionen, inklusive metabolism och clearance av läkemedel, men den exakta effekten är fortfarande oklar. Det finns missuppfattningar och betydande praxisvariationer bland sjukvårdspersonal när det gäller användning av smärtstillande läkemedel hos patienter med leverdysfunktion. Baserat på begränsade data om säkerhet och effekt är paracetamol det föredragna analgetikumet hos patienter med leversjukdom som inte dricker aktivt, och det kan doseras upp till 2-3 g/dag. Icke-steroida antiinflammatoriska läkemedel (NSAID) bör undvikas på grund av deras biverkningar i form av nedsatt njurfunktion, vätskeretention och ökad blödningsrisk. Opioider ska användas med försiktighet och initieras med produkter med omedelbar frisättning i låga doser med förlängda intervall och noggrann övervakning. Alla smärtstillande läkemedel ska titreras noggrant för att uppnå säker och adekvat smärtlindring hos patienter med nedsatt leverfunktion.
Cirrhos definieras som permanent leverfibros sekundärt till skada eller skada. Det är en heterogen diagnos som resulterar i varierande grad av nodulbildning, organdysfunktion, komplikationer och betydande morbiditet och mortalitet. Orsaker till cirros är bland annat alkoholmissbruk, hepatit B och C, cancer och icke-alkoholisk steato-hepatit.1 ”Kronisk leversjukdom och cirros” som huvuddiagnos stod för mer än 101 000 sjukhusinläggningar 2010.2 År 2013 rapporterades det som den främsta dödsorsaken hos personer i åldrarna 25-64 år och den 12:e främsta dödsorsaken i alla åldrar, vilket resulterade i över 36 000 dödsfall.2
Tyvärr kan dessa siffror vara underskattade på grund av diagnostiska begränsningar i ICD-koderna (International Classification of Diseases), som inte tar hänsyn till cirrosrelaterade komplikationer. En studie tyder på att antalet leverrelaterade dödsfall kan vara så mycket som dubbelt så högt som vad som för närvarande rapporteras av CDC.3
Hälsovårdspersonal är bekant med leverns viktiga roll i metabolismen och clearance av många läkemedel. Cirros kan leda till utveckling av portohepatiska shuntar, vilket i slutändan minskar den förstapassmetabolism som sker med många orala läkemedel. Minskad albuminproduktion kan också leda till ökade fria läkemedelskoncentrationer av starkt proteinbundna läkemedel. Man tror i allmänhet att när leverdysfunktion fortskrider försämras läkemedelseliminationen; patienter med kronisk hepatit eller levercancer kan dock, i avsaknad av cirros, endast ha en liten förändring i läkemedelsclearance.4 Det är fortfarande oklart i vilken utsträckning cirros påverkar läkemedelsdispositionen.
Vidare vissa läkemedel har specifika njurjusteringsparametrar, men det kan hända att hepatiska dosjusteringar inte är lättillgängliga. Många studier har utvärderat farmakokinetik och patienternas analgetiska serumnivåer, som inte nödvändigtvis korrelerar med patientens svar. Andra tillgängliga studier har främst fokuserat på hepatit C, även om många patienter utvecklar leverdysfunktion och cirros sekundärt av andra orsaker. Child-Pugh-poäng, som inte brukar beräknas i praktiken, styr ofta doseringen, men de resulterande rekommendationerna kan fortfarande vara vaga utan tydlig vägledning för klinisk tillämpning. Hanteringen av patienterna kan kompliceras ytterligare av samtidig njurfunktionsnedsättning, oavsett om den är relaterad till leversjukdom, t.ex. hepatorenalt syndrom, eller en annan orsak.4
Analgetikaanvändning vid cirros
Smärtbehandling är ofta en utmaning för hälso- och sjukvårdspersonalen, men den förblir en mycket viktig komponent för att tillhandahålla högkvalitativ patientvård och är en vanlig faktor för patienternas tillfredsställelse.5 En hög prevalens av smärta har konstaterats bland patienter med kronisk leversjukdom, rapporterad mellan 32 % och 77 %.6-8 Smärta och opioidbaserade smärtregimer har visat sig vara betydande prediktorer för sjukvårdsanvändning bland leversjuka patienter.8
En retrospektiv genomgång visade att 77 % av patienterna före levertransplantationen (n = 108) rapporterade kroppslig smärta, där mer än en tredjedel angav flera ställen.7 Smärtan rapporterades ha påverkat arbete, sömn, rörlighet, aptit, glädje och humör. Ungefär 90 % rapporterade att de fått farmakologisk behandling, men endast 33 % upplevde lindring. Kortverkande opioider skrevs ut i 40 % av fallen, och 32 % av patienterna rapporterade att de fått fem eller fler smärtstillande läkemedel utskrivna. Författarna drog slutsatsen att smärta hos patienter med leversjukdom i slutskedet (ESLD) är mycket vanligt, påverkar funktionaliteten och är ofta underbehandlad, trots de många farmakologiska terapier som förskrivs.7
Polyfarmaci föreslogs som ett vanligt tillvägagångssätt för smärtbehandling, möjligen på grund av att överförsiktiga förskrivare använder mycket låga doser av flera läkemedel i stället för noggrann titrering och optimering av färre medel.7 Polyfarmaci ökar kostnaderna, försvårar förståelsen av medlens effekt, skapar terapeutiska överlappningar och ökar den inneboende risken för läkemedelsinteraktioner och biverkningar. Smärthantering vid cirros utgör ett komplext område för farmakoterapi med unika överväganden av förändrad leverpatofysiologi och en fin balans mellan adekvat smärtlindring och undvikande av betydande potentiella biverkningar.7
Acetaminofen
Det anses allmänt att acetaminofen bör undvikas hos leverdysfunktionspatienter på grund av dess välkända hepatotoxicitetsrisk vid överdosering. Denna risk är direkt relaterad till mättnad av andra metaboliska vägar och utarmning av glutation (GSH)-depåer.5 Ungefär 5 % av paracetaminofen metaboliseras av CYP450-enzymer (främst 2E1, samt 1A3 och 3A4) till den reaktiva metaboliten N-acetyl-p-benzookinonimin (NAPQI). I närvaro av GSH konjugeras NAPQI och utsöndras renalt. När GSH inte är tillgängligt ackumuleras NAPQI och orsakar hepatocytnekros och apoptos.
Alkoholister kan utveckla en CYP2E1-induktion på grund av kroniskt alkoholintag och har minskade GSH-nivåer på grund av undernäring. Sådana fysiologiska förändringar kan leda till att dessa patienter löper ökad risk för acetaminofeninducerad leverskada. Följaktligen finns det farhågor om att alla cirrospatienter har lägre GSH-nivåer och ökad risk för hepatotoxicitet med paracetamol. Även om en förlängd halveringstid har dokumenterats hos cirrhospatienter finns det inga prospektiva långtidsstudier för att utvärdera säkerheten hos paracetamol. Vissa studier tyder på att leverskador är sällsynta vid lämplig dosering och att paracetaminofen tolereras väl vid stabil kronisk leversjukdom upp till 4 g/dag, utan tecken på ökad CYP-aktivitet eller kritiskt utarmade GSH-depåer.5,9,10
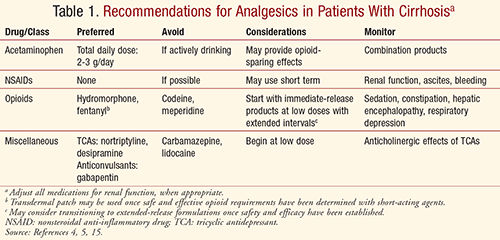
Totala dagliga paracetaminofen-doser på 2-3 g rekommenderas för både kort- och långtidsanvändning hos cirrhospatienter som inte aktivt dricker alkohol, baserat på expertutlåtande.4,5 I motsats till den allmänna uppfattningen anses paracetamol vara det föredragna medlet vid leverdysfunktion när det hålls inom en total daglig doseringsgräns, men bör undvikas hos patienter som aktivt dricker alkohol.4,11,12 IV paracetamol är kontraindicerat vid allvarlig leverfunktionsnedsättning och allvarlig aktiv leversjukdom.13
Nonsteroida antiinflammatoriska läkemedel (NSAID)
Icirrotiska patienter förväntas förändringar i metabolism och biotillgänglighet med NSAID på grund av betydande CYP-metabolism och proteinbindning.5 Oron för cirrhospatienter gäller dock i första hand de fysiologiska effekterna av NSAID. Dessa läkemedel hämmar prostaglandinsyntesen, vilket leder till minskat njurblodflöde och glomerulär filtrationshastighet (GFR) och försämrad natrium- och vattenutsöndring i njurarna, vilket kan förvärra ascites och öka risken för hepatorenalt syndrom hos cirrhospatienter.4 NSAID är kända för att orsaka gastrointestinal irritation, ulceration och perforation och öka patienternas totala blödningsrisk på grund av att de hämmar trombosan A2-produktionen i trombocyterna.4,5 På grund av trombocytopeni, minskad syntes av koagulationsfaktorer och esofagusvaricer i samband med portal hypertension kan cirrhospatienter löpa en högre risk för blödning, vilket kan vara livshotande.4 Av dessa skäl bör NSAID undvikas vid cirros.
Opioider
Opioider är den vanligaste läkemedelsklassen för analgesi, särskilt måttlig och svår smärta eller smärta som inte lindras av paracetamol och NSAID. Opioider kan bidra till betydande komplikationer vid cirros, inklusive utlösande av encefalopati, vilket motiverar försiktighet vid användning.5 Det är rimligt att komma ihåg att opioideffekter kan upphävas med naloxon, medan komplikationer av obehandlad eller underbehandlad smärta kan vara betydande.14 Opioider kan vara nödvändiga efter att lämpliga icke-farmakologiska och icke-opioida behandlingar har gett otillräckliga resultat.7
Oxidation är den viktigaste metaboliska vägen för opioider (ofta via CYP-enzymer), med undantag för morfin, och anses påverkas av leverdysfunktion.4,15 Oxidationen är minskad vid leversjukdom, vilket leder till minskad läkemedelsclearance och/eller ökad oral biotillgänglighet med minskad first-pass-metabolism. Medan glukuronidering tros påverkas mindre av lätt till måttlig leverdysfunktion kan den vara betydande vid allvarlig sjukdom.4 Med dessa överväganden i åtanke anses vissa opioider vara säkra, effektiva och att föredra framför NSAID vid måttlig till svår smärtbehandling med användning av reducerade doser och förlängda intervaller. På grund av vaga rekommendationer lämnas beslutet dock ofta till behandlarens kliniska bedömning.15 Långverkande medel kan övervägas först efter att säker och effektiv dosering av kortverkande medel har fastställts.5
Tramadol: Tramadol genomgår mer än 80 % levermetabolism.4 Även om det har förväntats ge mindre smärtlindring hos cirrotiska patienter på grund av minskad biotransformation har detta inte setts i kliniska studier.4 I en studie noterades en signifikant skillnad i toppkoncentrationen (Cmax) och topptiden (Tmax), clearance reducerad till hälften och en elimineringshalveringstid på upp till 3 gånger kontrollen hos 20 patienter med levermissbildande sjukdomar jämfört med 10 friska kontroller.16 Författarna rekommenderar att doseringsintervallet förlängs, och anser att tramadol 50 mg var 12:e timme är säkert och effektivt. Andra har rekommenderat 25 mg var 8:e timme vid leverdysfunktion.5 Läkemedelsinformationsresurser, t.ex. Lexicomp, rekommenderar 50 mg var 12:e timme för cirrospatienter och anger att produkten med förlängd frisättning inte ska användas till patienter med allvarlig (Child-Pugh klass C) leverdysfunktion.17
Tramadol kan vara fördelaktigt vid svårhanterlig smärta på grund av dess partiella hämning av serotoninåterupptag och aktivitet på perifera smärtvägar.5 Försiktighet bör iakttas med tramadol hos patienter med anfallshistoria och i kombination med andra serotonerga läkemedel, på grund av dess effekt att sänka anfallströskeln respektive möjlig utveckling av serotonergt syndrom. Dosen och frekvensen av tramadol bör också minskas i enlighet med njurfunktionen.17
Hydrokodon och oxykodon: Hydrokodon och oxykodon är beroende av CYP2D6 och 3A4 för metabolism till sina mer potenta metaboliter, hydromorfon respektive oxymorfon.5 Den analgetiska effekten av dessa läkemedel kan vara mindre potent hos patienter med leverdysfunktion på grund av minskad omvandling till deras aktiva metaboliter, samtidigt som minskat clearance och förlängd halveringstid kan ge fler oönskade effekter.4,5 Det rekommenderas att påbörja behandlingen med lägre doser och förlängda intervaller, med tillräckligt lång tid mellan doserna för att undvika ackumulering och titrering enligt patientens svar. Försiktighet bör iakttas med kombinationsprodukter av paracetamol (t.ex. Vicodin, Percocet) och man bör se till att den totala dagliga paracetamoldosen ligger inom den rekommenderade gränsen på 2 till 3 g/dag från alla källor.5
Morfin: Morfin anses ha en hög hepatisk extraktion vid förstapassmetabolism, vilket gör att det endast är 30-40 % biotillgängligt efter oral dosering hos friska patienter.4,5 Morfin metaboliseras av levern till morfin-6-glukuronid (aktiv metabolit) och morfin-3-glukuronid (inaktiv metabolit med potentiella neurotoxiska effekter), som sedan rensas renalt. Med minskad förstapassmetabolism hos cirrotiska patienter är morfin sannolikt mer biotillgängligt och lägre orala doser rekommenderas.4,5,15 Studier har genomgående visat minskad clearance och en förlängd halveringstid för morfin hos cirrotiska patienter. Det har rekommenderats att öka doseringsintervallet med så mycket som det dubbla för att undvika läkemedelsackumulering, både vid intravenös och oral administrering.5 Morfin bör undvikas vid nedsatt njurfunktion, inklusive hepatorenalt syndrom, på grund av betydande ackumulering av dess metaboliter och risk för neurotoxicitet.4
Hydromorfon: Vissa studier rapporterar ett Cmax som ökade upp till fyra gånger efter en enda omedelbar dos av hydromorfon hos patienter med måttlig leversjukdom, på grund av minskad first-pass-metabolism vid leverdysfunktion och hög hepatisk extraktion.4 Det har rekommenderats att börja med lägre doser men bibehålla ett liknande doseringsintervall.4,5 Farmakokinetiken för hydromorfon har inte studerats hos patienter med allvarlig leversjukdom. Hydromorfons clearance verkar vara relativt opåverkad, särskilt av njurdysfunktion. Det har dock föreslagits att hydromorfon inte ska användas vid hepatorenalt syndrom på grund av den observerade risken för ackumulering av dess neuroexcitatoriska metabolit, hydromorfon-3-glukuronid.4
Fentanyl: Även om fentanyl är starkt proteinbundet tros det inte påverkas av cirros.4,5,15 Fentanyl kan tolereras bättre hos cirrotiska patienter, eftersom det inte har några toxiska metaboliter.4 Fentanyl är dock kanske inte det lämpligaste medlet på grund av dess mycket höga potens och andra kliniska scenarier (t.ex, akut smärta, öppenvårdshantering och behovet av oral administrering).15
Användningen av transdermala fentanylplåster har av vissa författare rekommenderats som förstahandsalternativ för svårhanterlig smärta, men detta är kontroversiellt eftersom cirrhospatienter har visat sig ha förhöjda Cmax-koncentrationer och area under kurvan (AUC) vid användning av plåstren, 35 % respektive 73 %.4,5,18 Det är viktigt att komma ihåg att användningen av ett fentanylplåster endast bör övervägas när opioidbehovet har fastställts genom titrering av kortverkande opioider.15 Det rekommenderas att inleda med 50 % av den vanliga dosen vid lätt till måttligt nedsatt leverfunktion och att undvika användning vid allvarligt nedsatt leverfunktion.18 Fentanyl anses vara ett bra alternativ vid nedsatt njurfunktion, och intravenös administrering kan övervägas vid hepatorenalt syndrom, eftersom det är en av de opioider som påverkas minst av njurdysfunktion.4,5
Meperidin: I dagens praxis används meperidin sällan för analgesi på grund av risken för kramper med ackumulering av dess normperidinmetabolit. Även om normeperidinkoncentrationerna kan vara lägre på grund av minskad CYP-aktivitet hos dessa patienter finns det en ökad biotillgänglighet relaterad till minskad proteinbindning och fördröjd clearance, och metaboliten kan fortfarande ackumuleras.4,5,15 Meperidin bör undvikas vid cirros.
Kodein: Hos friska patienter är kodeins analgetiska effekt varierande på grund av CYP2D6 fenotypisk variation, vilket påverkar omvandlingen till morfin. Hos patienter med leverdysfunktion kan kodeins serumnivåer vara mer varierande på grund av minskad CYP-aktivitet, vilket orsakar minskad analgetisk effekt.4,5,15 På grund av en allmän brist på studier på cirrhotiska patienter rekommenderas inte kodein.
Metadon: För behandling av opioidberoende används ofta metadon. Läkemedlet innebär många utmaningar med sin betydande interindividuella variabilitet i biotillgänglighet, proteinbindning och långa halveringstid.4,5,15 Det metaboliseras huvudsakligen av CYP3A4.15 Ackumulering kan förekomma vid upprepad dosering vid allvarlig leverdysfunktion, och plasmakoncentrationerna kan vara förhöjda vid akut alkoholintag.4 Användningen av metadon för analgesi hos patienter med leversjukdom har inte studerats; därför rekommenderas det inte för denna användning hos dessa patienter.4 Fördelarna med övervakade metadonunderhållsprogram för opioidberoende, t.ex. heroinmissbruk, kan dock uppväga de potentiella riskerna.5
Buprenorfin: Oral administrering av buprenorfin, en partiell mu-opioidagonist, resulterar i omfattande förstapassmetabolism och dålig analgetisk effekt, medan sublingual administrering gör det möjligt för cirka 50 % till 55 % av läkemedlet att undvika inaktivering av CYP3A4.4,15 Tyvärr finns det för närvarande inga studier om buprenorfin för att avgöra om dosjusteringar behövs eller om farmakokinetiken förblir oförändrad vid leverfunktionsnedsättning. Hepatit har rapporterats vid användning av buprenorfin hos patienter med befintlig leverdysfunktion. Av dessa skäl bör buprenorfin användas med försiktighet hos patienter med leversjukdom.
Diverse
Lidokain: Användning av topiska lidokainplåster är ett vanligt övervägande för lokaliserad smärtkontroll. Även om oralt lidokain anses ha en hög hepatisk extraktion med förstapassmetabolism, hittades ingen litteratur som diskuterar farmakokinetik eller användning av lidokainplåster för smärtlindring hos cirrhotiska patienter19 . Smärta vid leverdysfunktion kan vara diffus och/eller associerad med ascites, vilket begränsar indikationen för topiska lidokainplåster.7 På grund av bristen på evidens och möjlig toxicitet bör lidokain användas med försiktighet hos patienter med leverdysfunktion och endast för lokaliserad smärta.
Tricykliska antidepressiva medel (TCA): TCAs har länge varit den viktigaste grunden för behandling av neuropatisk smärta.5 TCAs genomgår förstapassmetabolism och renal utsöndring. Dessa medel är välkända för sina antikolinerga effekter, som cirrhotiska patienter kan vara mer mottagliga för. Förstoppning är ett betydande problem som kan påskynda hepatisk encefalopati hos dessa patienter. Dessa läkemedel bör användas med försiktighet och endast vid behov. Om de används kan nortriptylin och desipramin vara att föredra på grund av lägre styrka och mindre sedering, takykardi och ortostatisk hypotension. Det rekommenderas att börja med låga doser vid leversjukdom och titrera långsamt baserat på patientens svar.4
Antikonvulsiva medel: Antikonvulsiva medel spelar också en roll i behandlingen av neuropatisk smärta (via modulering av neurotransmittorer), men dessa läkemedel metaboliseras vanligen av levern och utsöndras renalt.5 Lägre doser och förlängda intervaller kan vara nödvändiga hos cirrhotiska patienter. Karbamazepin är förknippat med hepatotoxicitet och bör undvikas hos patienter med leverdysfunktion. Gabapentin är det föredragna medlet eftersom det inte metaboliseras hepatiskt och inte heller är proteinbundet, men bör justeras i enlighet med njurfunktionen.4
Sammanfattning och rekommendationer
Med alla patienter måste smärtbehandlingen individualiseras baserat på fördelar kontra risker med noggrann övervakning av smärtlindring och biverkningar. Smärtbehandlingen bör innefatta ett multidisciplinärt tillvägagångssätt med farmakologiska, beteendemässiga, psykologiska och fysiska interventioner för att uppnå bästa resultat och optimera livskvaliteten, på ett säkert och effektivt sätt. Behandlare måste alltid vara uppmärksamma på den ökade risken för läkemedelsinducerad leverskada hos patienter med befintlig leversjukdom, inklusive cirros.5 Med de farmakokinetiska och biverkningsprofilerna för olika smärtstillande läkemedel i åtanke bör behandlare överväga de rekommendationer som sammanfattas i TABELL 1 för att uppnå en säker och adekvat smärtkontroll hos cirrotiska patienter.