US Pharm. 2015;40(12):HS5-HS11.
ABSTRACT: Cirrose is een heterogene diagnose die van invloed is op de leverfunctie, waaronder het metabolisme en de klaring van geneesmiddelen, maar het precieze effect blijft onduidelijk. Er bestaan misvattingen en aanzienlijke praktijkvariabiliteit onder zorgverleners over het gebruik van analgetica bij patiënten met leverdisfunctie. Op basis van beperkte gegevens over veiligheid en werkzaamheid is acetaminofen het pijnstillende middel bij uitstek bij patiënten met leveraandoeningen die niet actief drinken, en kan het worden gedoseerd tot 2 à 3 g/dag. Niet-steroïde anti-inflammatoire geneesmiddelen (NSAID’s) moeten worden vermeden vanwege de nadelige effecten van nierinsufficiëntie, vochtretentie en een verhoogd bloedingsrisico. Opioïden moeten met voorzichtigheid worden gebruikt en worden gestart met producten met onmiddellijke afgifte in lage doses met verlengde intervallen en nauwgezette controle. Alle pijnmedicatie moet zorgvuldig worden getitreerd om een veilige en adequate pijnstilling te bereiken bij patiënten met leverfunctiestoornissen.
Cirrose wordt gedefinieerd als permanente leverfibrose secundair aan beschadiging of letsel. Het is een heterogene diagnose, die varieert in de mate van knobbelvorming, orgaanfunctiestoornissen, complicaties en aanzienlijke morbiditeit en mortaliteit. Oorzaken van cirrose zijn onder meer alcoholmisbruik, hepatitis B en C, kanker en niet-alcoholische steato-hepatitis.1 “Chronische leverziekte en cirrose” als primaire diagnose was goed voor meer dan 101.000 ziekenhuisopnames in 2010.2 In 2013 werd het gerapporteerd als een belangrijke doodsoorzaak bij mensen in de leeftijd van 25 tot 64 jaar, en de 12e doodsoorzaak voor alle leeftijden, resulterend in meer dan 36.000 sterfgevallen.2
Helaas kunnen deze aantallen worden onderschat als gevolg van de beperkingen van de diagnostische criteria van de International Classification of Diseases (ICD)-codes, die geen rekening houden met cirrose-gerelateerde complicaties. Eén studie suggereert dat het aantal levergerelateerde sterfgevallen misschien wel twee keer zo hoog is als wat momenteel door de CDC wordt gemeld.3
Zorgverleners zijn bekend met de vitale rol van de lever in het metabolisme en de klaring van veel geneesmiddelen. Cirrose kan leiden tot de ontwikkeling van portohepatische shunts, waardoor het first-pass metabolisme dat bij veel orale geneesmiddelen optreedt, uiteindelijk afneemt. Een verminderde albumineproductie kan ook leiden tot verhoogde vrije-stofconcentraties van sterk eiwitgebonden geneesmiddelen. Over het algemeen wordt aangenomen dat naarmate de leverfunctiestoornis voortschrijdt, de eliminatie van geneesmiddelen wordt verstoord; bij patiënten met chronische hepatitis of leverkanker, die geen levercirrose hebben, kan de klaring van geneesmiddelen echter slechts in geringe mate veranderen.4 Het blijft onduidelijk in hoeverre levercirrose de dispositie van geneesmiddelen beïnvloedt.
Weliswaar bestaan er voor bepaalde geneesmiddelen specifieke nieraanpassingsparameters, maar leverdoseringsaanpassingen zijn mogelijk niet direct beschikbaar. Veel studies hebben de farmacokinetiek en de serumspiegels van pijnstillers bij patiënten geëvalueerd, die niet noodzakelijk correleren met de respons van de patiënt. Andere beschikbare onderzoeken zijn voornamelijk gericht op hepatitis C, hoewel veel patiënten leverdisfunctie en levercirrose ontwikkelen als gevolg van andere oorzaken. Child-Pugh-scores, die in de praktijk niet vaak worden berekend, sturen vaak de dosering, maar de daaruit voortvloeiende aanbevelingen kunnen nog steeds vaag zijn zonder duidelijke richtsnoeren voor klinische toepassing. De behandeling van patiënten kan verder worden bemoeilijkt door gelijktijdige nierinsufficiëntie, ongeacht of deze verband houdt met de leverziekte, zoals het hepatorenaal syndroom, of met een andere oorzaak.4
Analgeticumgebruik bij Cirrose
Pijnbestrijding is vaak een uitdaging voor beroepsbeoefenaren in de gezondheidszorg, maar het blijft een zeer belangrijk onderdeel van het verlenen van hoogwaardige zorg aan patiënten en is een veel voorkomende factor in de tevredenheid van patiënten.5 Er is een hoge prevalentie van pijn vastgesteld bij patiënten met chronische leveraandoeningen, die varieert van 32% tot 77%.6-8 Pijn en opioïden gebaseerde pijnregimes blijken significante voorspellers te zijn van het gebruik van gezondheidszorg door patiënten met leveraandoeningen.8
Een retrospectief onderzoek toonde aan dat 77% van de patiënten met een levertransplantatie (n = 108) lichamelijke pijn meldde, waarbij meer dan een derde aangaf op meerdere plaatsen pijn te hebben.7 De pijn beïnvloedde naar verluidt het werk, de slaap, de mobiliteit, de eetlust, het genot en de stemming. Ongeveer 90% gaf aan farmacologische therapie te krijgen, maar slechts 33% merkte verlichting. Kortwerkende opioïden werden in 40% van de gevallen voorgeschreven, en 32% van de patiënten gaf aan vijf of meer pijnmedicijnen voorgeschreven te krijgen. De auteurs concludeerden dat pijn bij patiënten met leveraandoeningen in het eindstadium (ESLD) veel voorkomt, de functionaliteit beïnvloedt en vaak niet voldoende wordt behandeld, ondanks de vele voorgeschreven farmacologische therapieën.7
Polyfarmacie werd gesuggereerd als een veel voorkomende aanpak van pijnbestrijding, mogelijk als gevolg van overvoorzichtige voorschrijvers die zeer lage doses van verschillende medicijnen gebruiken in plaats van zorgvuldige titratie en optimalisatie van minder middelen.7 Polyfarmacie verhoogt de kosten, bemoeilijkt het inzicht in de werkzaamheid van middelen, creëert therapeutische duplicaties, en verhoogt het inherente risico van interacties tussen geneesmiddelen en bijwerkingen. Pijnbestrijding bij cirrose is een complex gebied van farmacotherapie met unieke overwegingen van veranderde leverpathofysiologie en een fijne balans tussen adequate pijnstilling en het vermijden van belangrijke potentiële bijwerkingen.7
Acetaminophen
Algemeen wordt aangenomen dat acetaminophen moet worden vermeden bij patiënten met leverdisfunctie vanwege het bekende risico op hepatotoxiciteit bij overdosering. Dit risico houdt rechtstreeks verband met de verzadiging van andere metabolische routes en de uitputting van de voorraad glutathion (GSH).5 Ongeveer 5% van acetaminofen wordt gemetaboliseerd door CYP450-enzymen (voornamelijk 2E1, maar ook 1A3 en 3A4) tot de reactieve metaboliet N-acetyl-p-benzochinon-imine (NAPQI). In aanwezigheid van GSH wordt NAPQI geconjugeerd en renaal uitgescheiden. Wanneer GSH niet beschikbaar is, stapelt NAPQI zich op en veroorzaakt hepatocytennecrose en apoptose.
Alcoholisten kunnen een CYP2E1-inductie ontwikkelen als gevolg van chronische alcoholinname en hebben verlaagde GSH-spiegels door ondervoeding. Dergelijke fysiologische veranderingen kunnen ertoe leiden dat deze patiënten een verhoogd risico lopen op door acetaminofen veroorzaakte leverschade. Bijgevolg bestaat de bezorgdheid dat alle cirrosepatiënten lagere GSH-spiegels en een verhoogd risico op hepatotoxiciteit met acetaminofen hebben. Hoewel bij cirrosepatiënten een verlengde halfwaardetijd is gedocumenteerd, zijn er geen prospectieve langetermijnstudies beschikbaar om de veiligheid van acetaminofen te evalueren. Sommige studies suggereren dat leverschade zeldzaam is bij een juiste dosering en dat acetaminofen goed wordt verdragen bij stabiele chronische leverziekte tot 4 g/dag, zonder aanwijzingen voor verhoogde CYP-activiteit of kritisch uitgeputte GSH-voorraden.5,9,10
Totale dagelijkse doses acetaminofen van 2 tot 3 g worden aanbevolen voor zowel korte- als langetermijngebruik bij cirrotische patiënten die niet actief alcohol drinken, gebaseerd op de mening van deskundigen.4,5 In tegenstelling tot wat vaak wordt gedacht, wordt acetaminofen beschouwd als het middel van voorkeur bij leverdisfunctie wanneer het binnen een totale dagelijkse doseringslimiet wordt gehouden, maar moet het worden vermeden bij patiënten die actief alcohol drinken.4,11,12 IV-acetaminofen is gecontra-indiceerd bij ernstige leverfunctiestoornis en ernstige actieve leverziekte.13
Nonsteroïde anti-inflammatoire geneesmiddelen (NSAID’s)
Bij cirrotische patiënten zijn veranderingen in het metabolisme en de biologische beschikbaarheid te verwachten bij NSAID’s vanwege het significante CYP-metabolisme en de eiwitbinding.5 De zorg voor cirrotische patiënten heeft echter vooral betrekking op de fysiologische effecten van NSAID’s. Deze geneesmiddelen remmen de prostaglandinesynthese, wat leidt tot een verminderde nierdoorbloeding en glomerulaire filtratiesnelheid (GFR) en een verminderde niernatrium- en wateruitscheiding, waardoor ascites kan verergeren en het risico van het hepatorenaal syndroom bij cirrosepatiënten kan toenemen.4 Van NSAID’s is bekend dat ze gastro-intestinale irritatie, ulceratie en perforatie veroorzaken en het algehele risico van patiënten op bloedingen verhogen door remming van de tromboxaan A2-produktie van bloedplaatjes.4,5 Door trombocytopenie, verminderde synthese van stollingsfactoren en slokdarmvarices die gepaard gaan met portale hypertensie, lopen cirrosepatiënten een hoger risico op bloedingen, die levensbedreigend kunnen zijn.4 Om deze redenen moeten NSAID’s bij cirrose worden vermeden.
Opioïden
Opioïden zijn de meest gebruikte klasse geneesmiddelen voor analgesie, met name matige en ernstige pijn of pijn die niet wordt verlicht door acetaminofen en NSAID’s. Opioïden kunnen bijdragen tot aanzienlijke complicaties bij cirrose, waaronder het precipiteren van encefalopathie, zodat voorzichtigheid bij het gebruik ervan gerechtvaardigd is.5 Het is redelijk om in gedachten te houden dat de effecten van opioïden kunnen worden teruggedraaid met naloxon, terwijl de complicaties van onbehandelde of onderbehandelde pijn aanzienlijk kunnen zijn.14 Opioïden kunnen nodig zijn nadat geschikte niet-farmacologische en niet-opioïde behandelingen onvoldoende resultaat hebben opgeleverd.7
Oxidatie is de belangrijkste metabolische route voor opioïden (vaak via CYP-enzymen), behalve voor morfine, en wordt geacht te worden beïnvloed door leverdisfunctie.4,15 Oxidatie wordt verminderd bij leveraandoeningen, wat leidt tot een verminderde klaring van het geneesmiddel en/of een verhoogde orale biologische beschikbaarheid met verminderd first-pass-metabolisme. Terwijl glucuronidatie minder wordt beïnvloed door milde tot matige leverdisfunctie, kan het aanzienlijk zijn bij ernstige ziekte.4 Met deze overwegingen in het achterhoofd worden bepaalde opioïden beschouwd als veilig, effectief en te verkiezen boven NSAID’s voor matige tot ernstige pijnbestrijding met gebruik van verlaagde doses en langere intervallen. Vanwege de vage aanbevelingen wordt de beslissing echter vaak overgelaten aan het klinische oordeel van de arts.15 Langwerkende middelen kunnen pas worden overwogen nadat een veilige en effectieve dosering van kortwerkende middelen is vastgesteld.5
Tramadol: Tramadol ondergaat meer dan 80% van het levermetabolisme.4 Hoewel werd verwacht dat het minder pijnstilling zou geven bij cirrotische patiënten als gevolg van verminderde biotransformatie, is dit niet waargenomen in klinische studies.4 Eén studie noteerde een significant verschil in de piekconcentratie (Cmax) en piektijd (Tmax), een met de helft verminderde klaring en een eliminatiehalfwaardetijd tot 3 keer de controle bij 20 patiënten met levermaligniteiten in vergelijking met 10 gezonde controles.16 De auteurs bevelen aan het doseringsinterval te verlengen, waarbij zij tramadol 50 mg om de 12 uur veilig en effectief achten. Anderen hebben 25 mg om de 8 uur aanbevolen bij leverdysfunctie.5 Geneesmiddeleninformatiebronnen, zoals Lexicomp, bevelen 50 mg om de 12 uur aan voor cirrosepatiënten en verklaren dat het product met verlengde afgifte niet mag worden gebruikt bij patiënten met ernstige (Child-Pugh klasse C) leverdysfunctie.17
Tramadol kan gunstig zijn bij hardnekkige pijn door de gedeeltelijke remming van serotonine heropname en activiteit op perifere pijnbanen.5 Voorzichtigheid is geboden met tramadol bij patiënten met een aanvalsgeschiedenis en in combinatie met andere serotonerge medicatie, vanwege het effect van respectievelijk verlaging van de aanvalsdrempel en mogelijke ontwikkeling van het serotoninesyndroom. De dosis en de frequentie van tramadol moeten ook worden verlaagd overeenkomstig de nierfunctie.17
Hydrocodon en oxycodon: Hydrocodon en oxycodon zijn afhankelijk van CYP2D6 en 3A4 voor het metabolisme naar hun krachtiger metabolieten, respectievelijk hydromorfon en oxymorfon.5 Het analgetische effect van deze medicatie kan minder krachtig zijn bij patiënten met leverdisfunctie als gevolg van verminderde conversie naar hun actieve metabolieten, terwijl verminderde klaring en verlengde halfwaardetijd meer ongewenste effecten kunnen veroorzaken.4,5 Het wordt aanbevolen om de therapie te beginnen met lagere doses en langere intervallen, waarbij voldoende tijd tussen de doses moet worden gegeven om accumulatie te voorkomen en te titreren op basis van de respons van de patiënt. Voorzichtigheid is geboden bij combinatieproducten met acetaminofen (bijv. Vicodin, Percocet), waarbij ervoor gezorgd moet worden dat de totale dagelijkse dosis acetaminofen van alle bronnen binnen de aanbevolen limiet van 2 tot 3 g/dag blijft.5
Morfine: Morfine wordt geacht een hoge hepatische extractie te hebben op het first-pass metabolisme, waardoor het slechts 30% tot 40% biobeschikbaar is na orale dosering bij gezonde patiënten.4,5 Morfine wordt door de lever gemetaboliseerd tot morfine-6-glucuronide (actieve metaboliet) en morfine-3-glucuronide (inactieve metaboliet met potentiële neurotoxische effecten), die vervolgens renaal worden geklaard. Door het verminderde first-pass metabolisme bij cirrotische patiënten is morfine waarschijnlijk beter biologisch beschikbaar en worden lagere orale doses aanbevolen.4,5,15 Onderzoeken hebben consequent een verminderde klaring en een verlengde halfwaardetijd voor morfine bij cirrotische patiënten aangetoond. Er is aanbevolen het doseringsinterval te verdubbelen om accumulatie van het geneesmiddel te voorkomen, zowel bij IV- als orale toediening.5 Morfine moet worden vermeden bij nierinsufficiëntie, inclusief het hepatorenaal syndroom, vanwege de significante accumulatie van de metabolieten en het risico op neurotoxiciteit.4
Hydromorfoon: Sommige onderzoeken melden een tot viermaal verhoogde Cmax na een enkele dosis hydromorfoon met onmiddellijke afgifte bij patiënten met een matige leveraandoening, als gevolg van een verminderd first-pass metabolisme bij leverdisfunctie en een hoge hepatische extractie.4 Er is aanbevolen om met lagere doses te beginnen, maar een vergelijkbaar doseringsinterval aan te houden.4,5 De farmacokinetiek voor hydromorfoon is niet bestudeerd bij patiënten met een ernstige leveraandoening. De klaring van hydromorfoon lijkt relatief ongevoelig te zijn, vooral bij nierdisfunctie. Er is echter gesuggereerd om hydromorfoon niet te gebruiken bij het hepatorenaal syndroom vanwege het waargenomen risico van accumulatie van de neuroexciterende metaboliet hydromorfoon-3-glucuronide.4
Fentanyl: Hoewel fentanyl sterk eiwitgebonden is, wordt aangenomen dat het niet wordt beïnvloed door cirrose.4,5,15 Fentanyl wordt mogelijk beter verdragen bij cirrotische patiënten, omdat het geen toxische metabolieten heeft.4 Fentanyl is echter mogelijk niet het meest geschikte middel vanwege de zeer hoge potentie en andere klinische scenario’s (bijv, acute pijn, ambulante behandeling en de noodzaak van orale toediening).15
Het gebruik van transdermale fentanylpleisters is door sommige auteurs aanbevolen als eerstelijnsoptie voor hardnekkige pijn, maar dit is controversieel omdat bij cirrosepatiënten verhoogde Cmax-concentraties en oppervlakte onder de curve (AUC) zijn gevonden bij gebruik van de pleisters, respectievelijk 35% en 73%.4,5,18 Het is belangrijk om te onthouden dat het gebruik van een fentanylpleister alleen moet worden overwogen nadat de behoefte aan opioïden is vastgesteld door titratie van kortwerkende opioïden.15 Het wordt aanbevolen om te starten met 50% van de gebruikelijke dosis bij lichte tot matige leverinsufficiëntie en het gebruik te vermijden bij ernstige leverinsufficiëntie.18 Fentanyl wordt beschouwd als een goede optie bij een nierfunctiestoornis, en bij het hepatorenaal syndroom kan intraveneuze toediening worden overwogen, aangezien het een van de opioïden is die het minst wordt beïnvloed door nierdisfunctie.4,5
Meperidine: In de huidige praktijk wordt meperidine zelden gebruikt voor analgesie vanwege het risico op epileptische aanvallen als gevolg van de ophoping van de metaboliet normeperidine. Hoewel de normeperidineconcentraties lager kunnen zijn als gevolg van verminderde CYP-activiteit bij deze patiënten, is er een verhoogde biologische beschikbaarheid als gevolg van verminderde eiwitbinding en vertraagde klaring, en kan de metaboliet zich nog steeds ophopen.4,5,15 Meperidine moet worden vermeden bij cirrose.
Codeïne: Bij gezonde patiënten is het pijnstillende effect van codeïne variabel als gevolg van de fenotypische variatie van CYP2D6, waardoor de omzetting in morfine wordt beïnvloed. Bij patiënten met leverdisfunctie kunnen de serumspiegels van codeïne variabeler zijn als gevolg van verminderde CYP-activiteit, waardoor het pijnstillende effect afneemt.4,5,15 Vanwege een algemeen gebrek aan studies bij cirrotische patiënten wordt codeïne niet aanbevolen.
Methadon: Voor de behandeling van opioïdafhankelijkheid wordt vaak methadon gebruikt. Het middel levert veel problemen op door de aanzienlijke interindividuele variabiliteit in biologische beschikbaarheid, eiwitbinding en lange halfwaardetijd.4,5,15 Het wordt voornamelijk gemetaboliseerd door CYP3A4.15 Er kan accumulatie optreden bij herhaalde toediening bij ernstige leverdisfunctie, en plasmaconcentraties kunnen worden verhoogd door acute inname van alcohol.4 Het gebruik van methadon voor analgesie bij patiënten met leveraandoeningen is niet onderzocht; daarom wordt het niet aanbevolen voor dit gebruik bij deze patiënten.4 De voordelen van gecontroleerde methadon-onderhoudsprogramma’s voor opioïdenverslaving, zoals heroïnemisbruik, kunnen echter opwegen tegen de potentiële risico’s.5
Buprenorfine: Orale toediening van buprenorfine, een partiële mu opioïde agonist, resulteert in uitgebreid first-pass metabolisme en een slecht analgetisch effect, terwijl sublinguale toediening ongeveer 50% tot 55% van het geneesmiddel aan inactivering door CYP3A4 kan onttrekken.4,15 Helaas zijn er momenteel geen studies naar buprenorfine beschikbaar om te bepalen of dosisaanpassingen nodig zijn of dat de farmacokinetiek ongewijzigd blijft bij leverfunctiestoornissen. Bij gebruik van buprenorfine bij patiënten met reeds bestaande leverfunctiestoornissen is hepatitis gemeld. Om deze redenen moet buprenorfine met voorzichtigheid worden gebruikt bij patiënten met leveraandoeningen.
Diversen
Lidocaïne: Plaatselijk gebruik van lidocaïnepleisters wordt vaak overwogen voor plaatselijke pijnbestrijding. Hoewel orale lidocaïne geacht wordt een hoge hepatische extractie te hebben met first-pass metabolisme, is er geen literatuur gevonden waarin de farmacokinetiek of het gebruik van lidocaïne pleisters voor pijnbestrijding bij cirrotische patiënten wordt besproken.19 Pijn bij leverdisfunctie kan diffuus zijn en/of gepaard gaan met ascites, waardoor de indicatie voor topische lidocaïnepleisters beperkt is.7 Vanwege het gebrek aan bewijs en de mogelijke toxiciteit moet lidocaïne met voorzichtigheid worden gebruikt bij patiënten met leverdisfunctie en alleen voor gelokaliseerde pijn.
Tricyclische Antidepressiva (TCA’s): TCA’s zijn lange tijd de steunpilaar van de neuropathische pijntherapie geweest.5 TCA’s ondergaan een first-pass metabolisme en renale excretie. Deze middelen staan bekend om hun anticholinerge effecten, waarvoor cirrotische patiënten gevoeliger kunnen zijn. Constipatie is een belangrijk punt van zorg, dat bij deze patiënten hepatische encefalopathie kan doen ontstaan. Deze medicatie dient met voorzichtigheid en alleen indien noodzakelijk te worden gebruikt. Bij gebruik kunnen nortriptyline en desipramine de voorkeur krijgen vanwege de lagere potentie en minder sedatie, tachycardie en orthostatische hypotensie. Het wordt aanbevolen om bij leveraandoeningen met lage doses te beginnen en langzaam te titreren op basis van de respons van de patiënt.4
Anticonvulsiva: Anticonvulsiva spelen ook een rol bij de neuropathische pijnbestrijding (via neurotransmittermodulatie), maar deze geneesmiddelen worden doorgaans door de lever gemetaboliseerd en renaal uitgescheiden.5 Bij cirrotische patiënten kunnen lagere doses en langere intervallen noodzakelijk zijn. Carbamazepine wordt in verband gebracht met hepatotoxiciteit en moet worden vermeden bij patiënten met leverdisfunctie. Gabapentine verdient de voorkeur, omdat het niet hepatisch gemetaboliseerd of eiwitgebonden is, maar moet worden aangepast aan de nierfunctie.4
Samenvatting en aanbevelingen
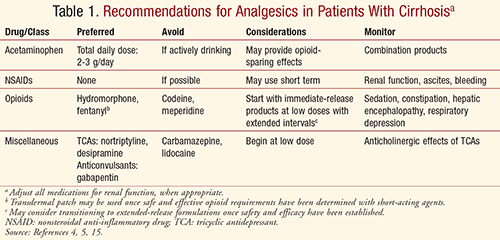
Bij alle patiënten moet de pijnbestrijding worden geïndividualiseerd op basis van voordelen versus risico’s, waarbij de pijnstilling en de bijwerkingen nauwlettend in de gaten moeten worden gehouden. Pijnbestrijding moet een multidisciplinaire aanpak van farmacologische, gedragsmatige, psychologische en lichamelijke interventies omvatten om de beste resultaten te bereiken en de kwaliteit van leven veilig en effectief te optimaliseren. Beoefenaars moeten altijd bedacht zijn op een verhoogd risico op leverschade door geneesmiddelen bij patiënten met reeds bestaande leveraandoeningen, waaronder cirrose.5 Met het oog op de farmacokinetische en bijwerkingenprofielen van verschillende analgetische medicatie moeten beoefenaars de aanbevelingen in tabel 1 in acht nemen om een veilige en adequate pijnbestrijding bij cirrotische patiënten te bereiken.