US Pharm. 2015;40(12):HS5-HS11.
ABSTRACT: Ciroza este un diagnostic eterogen care are un impact asupra funcției hepatice, inclusiv asupra metabolismului și clearance-ului medicamentelor, dar efectul exact rămâne neclar. Există concepții greșite și o variabilitate semnificativă a practicii în rândul profesioniștilor din domeniul sănătății în ceea ce privește utilizarea analgezicelor la pacienții cu disfuncție hepatică. Pe baza datelor limitate privind siguranța și eficacitatea, paracetamolul este analgezicul preferat la pacienții cu afecțiuni hepatice care nu beau în mod activ și poate fi dozat până la 2 până la 3 g/zi. Medicamentele antiinflamatoare nesteroidiene (AINS) trebuie evitate din cauza efectelor lor adverse de insuficiență renală, retenție de lichide și risc crescut de sângerare. Opioidele trebuie utilizate cu prudență și inițiate cu produse cu eliberare imediată în doze mici, cu intervale prelungite și monitorizare atentă. Toate analgezicele trebuie titrate cu atenție pentru a obține o ameliorare sigură și adecvată a durerii la pacienții cu insuficiență hepatică.
Ciroza este definită ca fibroză hepatică permanentă secundară unei leziuni sau leziuni. Este un diagnostic eterogen, rezultând în grade diferite de formare a nodulilor, disfuncție de organ, complicații și morbiditate și mortalitate semnificative. Cauzele cirozei includ abuzul de alcool, hepatita B și C, cancerul și steato-hepatita non-alcoolică.1 „Boala hepatică cronică și ciroza” ca diagnostic primar a reprezentat peste 101.000 de internări în spital în 2010.2 În 2013, a fost raportată ca principala cauză de deces la persoanele cu vârste cuprinse între 25 și 64 de ani și a 12-a cauză de deces pentru toate vârstele, ceea ce a dus la peste 36.000 de decese.2
Din păcate, aceste cifre pot fi subestimate din cauza limitărilor criteriilor de diagnostic ale codurilor din Clasificarea internațională a bolilor (ICD), care nu iau în considerare complicațiile legate de ciroză. Un studiu sugerează că numărul deceselor legate de ficat poate fi de două ori mai mare decât cel raportat în prezent de CDC.3
Profesioniștii din domeniul sănătății sunt familiarizați cu rolul vital al ficatului în metabolismul și eliminarea multor medicamente. Ciroza poate duce la dezvoltarea de șunturi portohepatice, scăzând în cele din urmă metabolismul de primă trecere care are loc cu multe medicamente orale. Scăderea producției de albumină poate duce, de asemenea, la creșterea concentrațiilor de medicamente libere ale medicamentelor puternic legate de proteine. În general, se consideră că, pe măsură ce disfuncția hepatică progresează, eliminarea medicamentelor este afectată; cu toate acestea, pacienții cu hepatită cronică sau cancer hepatic, în absența cirozei, pot avea doar o mică modificare a clearance-ului medicamentelor.4 Rămâne neclar în ce măsură ciroza afectează dispoziția medicamentelor.
În timp ce anumite medicamente au parametri specifici de ajustare renală, ajustările dozelor hepatice pot să nu fie disponibile cu ușurință. Multe studii au evaluat farmacocinetica și nivelurile serice analgezice ale pacienților, care nu se corelează neapărat cu răspunsul pacientului. Alte studii disponibile s-au axat în principal pe hepatita C, deși mulți pacienți dezvoltă disfuncții hepatice și ciroză secundară altor cauze. Scorurile Child-Pugh, care nu sunt calculate în mod obișnuit în practică, direcționează adesea dozajul, dar recomandările rezultate pot fi încă vagi, fără o îndrumare clară pentru aplicarea clinică. Managementul pacienților poate fi complicat și mai mult de insuficiența renală concomitentă, fie că este legată de boala hepatică, cum ar fi sindromul hepatorenal, sau de o altă cauză.4
Utilizarea analgezicelor în ciroză
Managementul durerii este adesea o provocare pentru profesioniștii din domeniul sănătății, dar rămâne o componentă foarte importantă în asigurarea unei îngrijiri de calitate pentru pacienți și este un factor comun în ceea ce privește satisfacția pacienților.5 S-a constatat o prevalență ridicată a durerii în rândul pacienților cu afecțiuni hepatice cronice, raportată între 32% și 77%.6-8 S-a constatat că durerea și regimurile analgezice pe bază de opioide sunt factori predictivi semnificativi ai utilizării asistenței medicale în rândul pacienților cu afecțiuni hepatice.8
O analiză retrospectivă a constatat că 77% dintre pacienții înainte de transplantul hepatic (n = 108) au raportat dureri corporale, mai mult de o treime dintre aceștia indicând mai multe localizări.7 Durerea a afectat, conform rapoartelor, munca, somnul, mobilitatea, pofta de mâncare, plăcerea și starea de spirit. Aproximativ 90% au raportat că au primit tratament farmacologic; cu toate acestea, doar 33% au perceput o ameliorare. Opioidele cu acțiune scurtă au fost prescrise în 40% din cazuri, iar 32% dintre pacienți au raportat că li s-au prescris cinci sau mai multe medicamente pentru durere. Autorii au concluzionat că durerea la pacienții cu boli hepatice în stadiu terminal (ESLD) este foarte frecventă, are impact asupra funcționalității și este adesea subtratată, în ciuda numeroaselor terapii farmacologice prescrise.7
Polifarmacia a fost sugerată ca fiind o abordare comună a gestionării durerii, posibil din cauza prescriptorilor prea precauți care utilizează doze foarte mici de mai multe medicamente, mai degrabă decât o titrare atentă și o optimizare a unui număr mai mic de agenți.7 Polifarmacia crește costurile, complică înțelegerea eficacității agenților, creează dublări terapeutice și crește riscul inerent de interacțiuni medicamentoase și efecte adverse. Managementul durerii în ciroză prezintă un domeniu complex al farmacoterapiei, cu considerații unice privind fiziopatologia hepatică modificată și un echilibru fin între ameliorarea adecvată a durerii și evitarea efectelor adverse potențiale semnificative.7
Acetaminofen
Se crede în mod obișnuit că acetaminofenul ar trebui evitat la pacienții cu disfuncție hepatică din cauza riscului său bine cunoscut de hepatotoxicitate în caz de supradozaj. Acest risc este direct legat de saturarea altor căi metabolice și de epuizarea depozitelor de glutation (GSH). 5 Aproximativ 5% din paracetamol este metabolizat de enzimele CYP450 (predominant 2E1, precum și 1A3 și 3A4) în metabolitul reactiv N-acetil-p-benzochinonă imină (NAPQI). În prezența GSH, NAPQI este conjugat și excretat renal. Când GSH nu este disponibil, NAPQI se acumulează și provoacă necroza și apoptoza hepatocitelor.
Alcoolicii pot dezvolta o inducție a CYP2E1 din cauza ingestiei cronice de alcool și au niveluri scăzute de GSH din cauza malnutriției. Astfel de modificări fiziologice pot face ca acești pacienți să fie supuși unui risc crescut de leziuni hepatice induse de paracetamol. În consecință, există îngrijorarea că toți pacienții cu ciroză au niveluri mai scăzute de GSH și un risc crescut de hepatotoxicitate cu paracetamol. Deși a fost documentat un timp de înjumătățire prelungit la pacienții cu ciroză, nu sunt disponibile studii prospective pe termen lung pentru a evalua siguranța paracetamolului. Unele studii sugerează că leziunile hepatice sunt rare în cazul unei doze adecvate și că paracetamolul este bine tolerat în boala hepatică cronică stabilă până la 4 g/zi, fără dovezi de creștere a activității CYP sau de epuizare critică a rezervelor de GSH.5,9,10
Dosarele zilnice totale de paracetamol de 2 până la 3 g sunt recomandate atât pentru utilizarea pe termen scurt, cât și pe termen lung la pacienții cirotici care nu consumă alcool în mod activ, pe baza opiniei experților.4,5 Contrar credinței comune, paracetamolul este considerat agentul preferat în disfuncția hepatică atunci când este menținut în limita dozei zilnice totale, dar trebuie evitat la pacienții care consumă alcool în mod activ.4,11,12 Paracetamolul intravenos este contraindicat în insuficiența hepatică severă și în boala hepatică activă severă.13
Medicamente antiinflamatoare nesteroidiene (AINS)
La pacienții cirotici, sunt de așteptat modificări ale metabolismului și biodisponibilității cu AINS din cauza metabolismului semnificativ al CYP și a legării la proteine.5 Cu toate acestea, preocuparea pentru pacienții cu ciroză se referă în primul rând la efectele fiziologice ale AINS. Aceste medicamente inhibă sinteza prostaglandinelor, ceea ce duce la scăderea fluxului sanguin renal și a ratei de filtrare glomerulară (GFR), precum și la afectarea excreției renale de sodiu și apă, ceea ce poate agrava ascita și crește riscul de sindrom hepatorenal la pacienții cu ciroză.4 Se știe că AINS provoacă iritații, ulcerații și perforații gastrointestinale și cresc riscul general de sângerare al pacienților datorită inhibării producției tromboxanului A2 de către tromboxanii plachetare.4,5 Din cauza trombocitopeniei, a scăderii sintezei factorilor de coagulare și a varicelor esofagiene asociate cu hipertensiunea portală, pacienții cu ciroză pot prezenta un risc mai mare de sângerare, care poate pune în pericol viața.4 Din aceste motive, AINS trebuie evitate în ciroză.
Opioidele
Opioidele sunt cea mai frecventă clasă de medicamente pentru analgezie, în special pentru durerea moderată și severă sau pentru durerea care nu este ameliorată de paracetamol și AINS. Opioidele pot contribui la complicații semnificative în cazul cirozei, inclusiv la precipitarea encefalopatiei, ceea ce justifică prudența în utilizarea lor.5 Este rezonabil să se țină cont de faptul că efectele opioidelor pot fi inversate cu naloxonă, în timp ce complicațiile durerii netratate sau insuficient tratate pot fi semnificative.14 Opioidele pot fi necesare după ce tratamentele nonfarmacologice și neopioide adecvate au dat rezultate inadecvate.7
Oxidarea este calea metabolică majoră pentru opioide (adesea prin intermediul enzimelor CYP), cu excepția morfinei, și se consideră că este afectată de disfuncția hepatică.4,15 Oxidarea este redusă în cazul bolilor hepatice, ceea ce duce la scăderea clearance-ului medicamentului și/sau la creșterea biodisponibilității orale cu reducerea metabolismului de primă trecere. Deși se consideră că glucuronidarea este mai puțin afectată de disfuncția hepatică ușoară până la moderată, aceasta poate fi semnificativă în cazul unei afecțiuni severe.4 Ținând cont de aceste considerente, anumite opioide sunt considerate a fi sigure, eficiente și preferate în locul AINS pentru tratamentul durerii moderate până la severe, cu utilizarea unor doze reduse și intervale prelungite. Cu toate acestea, din cauza recomandărilor vagi, decizia este adesea lăsată la aprecierea clinică a practicianului.15 Agenții cu durată lungă de acțiune pot fi luați în considerare numai după ce se determină dozarea sigură și eficientă a agenților cu durată scurtă de acțiune.5
Tramadol: Tramadolul este supus unui metabolism hepatic în proporție de peste 80%.4 Deși se aștepta ca acesta să ofere mai puțină ameliorare a durerii la pacienții cirotici din cauza biotransformării reduse, acest lucru nu a fost observat în studiile clinice.4 Un studiu a observat o diferență semnificativă în ceea ce privește concentrația maximă (Cmax) și timpul de vârf (Tmax), clearance-ul redus la jumătate și un timp de înjumătățire prin eliminare de până la 3 ori mai mare decât cel de control la 20 de pacienți cu malignitate hepatică comparativ cu 10 controale sănătoase.16 Autorii recomandă prelungirea intervalului de dozare, considerând tramadol 50 mg la fiecare 12 ore sigur și eficient. Alții au recomandat 25 mg la fiecare 8 ore în disfuncția hepatică.5 Resursele de informare despre medicamente, cum ar fi Lexicomp, recomandă 50 mg la fiecare 12 ore pentru pacienții cu ciroză și precizează că produsul cu eliberare prelungită nu trebuie utilizat la pacienții cu disfuncție hepatică severă (Child-Pugh clasa C).17
Tramadolul poate fi benefic în durerea intratabilă datorită inhibării parțiale a recaptării serotoninei și a activității sale pe căile periferice ale durerii.5 Trebuie utilizată prudență cu tramadolul la pacienții cu antecedente de convulsii și în asociere cu alte medicamente serotoninergice, datorită efectului său de scădere a pragului convulsivant și, respectiv, a posibilei apariții a sindromului serotoninergic. De asemenea, doza și frecvența tramadolului trebuie reduse în funcție de funcția renală. 17
Hidrocodonă și oxicodonă: Hidrocodona și oxicodona depind de CYP2D6 și 3A4 pentru metabolizarea în metaboliții lor mai puternici, hidromorfonă și, respectiv, oximorfonă.5 Efectul analgezic al acestor medicamente poate fi mai puțin puternic la pacienții cu disfuncție hepatică din cauza scăderii conversiei în metaboliții lor activi, în timp ce clearance-ul scăzut și timpul de înjumătățire prelungit pot produce mai multe efecte nedorite.4,5 Se recomandă inițierea tratamentului cu doze mai mici și intervale prelungite, permițând un timp adecvat între doze pentru a evita acumularea și titrând în funcție de răspunsul pacientului. Trebuie utilizată prudență în cazul produselor combinate cu paracetamol (de exemplu, Vicodin, Percocet), asigurându-se că doza zilnică totală de paracetamol se încadrează în limita recomandată de 2 până la 3 g/zi din toate sursele.5
Morfină: Se consideră că morfina are o extracție hepatică ridicată la metabolismul de primă trecere, ceea ce face ca aceasta să aibă o biodisponibilitate de numai 30% până la 40% în urma administrării pe cale orală la pacienții sănătoși.4,5 Morfina este metabolizată de ficat în morfină-6-glucuronidă (metabolit activ) și morfină-3-glucuronidă (metabolit inactiv cu potențiale efecte neurotoxice), care sunt apoi eliminate pe cale renală. Cu un metabolism de prim pasaj redus la pacienții cirotici, morfina este probabil mai biodisponibilă și se recomandă doze orale mai mici.4,5,15 Studiile au arătat în mod constant o scădere a clearance-ului și un timp de înjumătățire prelungit pentru morfină la pacienții cirotici. S-a recomandat creșterea intervalului de dozare de până la dublu pentru a evita acumularea medicamentului, atât în cazul administrării intravenoase, cât și în cazul administrării orale.5 Morfina trebuie evitată în insuficiența renală, inclusiv în cazul sindromului hepatorenal, din cauza acumulării semnificative a metaboliților săi și a riscului de neurotoxicitate.4
Hidromorfonă: Unele studii raportează o Cmax crescută de până la patru ori după o singură doză de hidromorfonă cu eliberare imediată la pacienții cu afecțiuni hepatice moderate, datorită scăderii metabolismului de prim pasaj în cazul disfuncției hepatice și a extracției hepatice ridicate.4 S-a recomandat începerea cu doze mai mici, dar menținerea unui interval de dozare similar.4,5 Farmacocinetica pentru hidromorfonă nu a fost studiată la pacienții cu afecțiuni hepatice severe. Clearance-ul hidromorfonului pare să fie relativ neafectat, în special de disfuncția renală. Cu toate acestea, s-a sugerat ca hidromorfonul să nu fie utilizat în sindromul hepatorenal din cauza riscului observat de acumulare a metabolitului său neuroexcitator, hidromorfon-3-glucuronida.4
Fentanil: Deși fentanilul este puternic legat de proteine, se crede că nu este afectat de ciroză.4,5,15 Fentanilul poate fi mai bine tolerat la pacienții cirotici, deoarece nu are metaboliți toxici.4 Cu toate acestea, fentanilul poate să nu fie cel mai potrivit agent din cauza potenței sale foarte mari și a altor scenarii clinice (de ex, durerea acută, gestionarea în ambulatoriu și necesitatea administrării pe cale orală).15
Utilizarea plasturilor transdermici de fentanil a fost recomandată ca opțiune de primă linie pentru durerea intratabilă de către unii autori, dar acest lucru este controversat, deoarece s-a constatat că pacienții cu ciroză au prezentat concentrații Cmax și o arie sub curbă (AUC) ridicate la utilizarea plasturilor, de 35 % și, respectiv, 73 %.4,5,18 Este important de reținut că utilizarea unui plasture de fentanil trebuie luată în considerare numai după ce nevoile de opioide au fost determinate prin titrarea opioidelor cu acțiune scurtă.15 Se recomandă inițierea la 50% din doza obișnuită în cazul insuficienței hepatice ușoare până la moderate și evitarea utilizării în cazul insuficienței hepatice severe.18 Fentanilul este considerat o opțiune bună în insuficiența renală, iar administrarea IV poate fi luată în considerare în sindromul hepatorenal, deoarece este unul dintre opioidele cel mai puțin afectate de disfuncția renală.4,5
Meperidina: În practica curentă, meperidina este rar utilizată pentru analgezie din cauza riscului de convulsii prin acumularea metabolitului său normeperidină. Deși concentrațiile de normeperidină pot fi mai mici datorită scăderii activității CYP la acești pacienți, există o biodisponibilitate crescută legată de scăderea legăturii cu proteinele și clearance-ul întârziat, iar metabolitul se poate totuși acumula.4,5,15 Meperidina trebuie evitată în ciroză.
Codeină: La pacienții sănătoși, efectul analgezic al codeinei este variabil din cauza variației fenotipice a CYP2D6, care afectează conversia în morfină. La pacienții cu disfuncție hepatică, nivelurile serice ale codeinei pot fi mai variabile din cauza scăderii activității CYP, determinând diminuarea efectului analgezic.4,5,15 Din cauza lipsei generale de studii la pacienții cirotici, codeina nu este recomandată.
Methadona: Pentru gestionarea dependenței de opioide, metadona este adesea utilizată. Medicamentul prezintă multe provocări, având în vedere variabilitatea sa interindividuală semnificativă în ceea ce privește biodisponibilitatea, legarea la proteine și timpul de înjumătățire lung.4,5,15 Este metabolizat predominant de CYP3A4.15 Acumularea poate apărea la doze repetate în cazul disfuncțiilor hepatice severe, iar concentrațiile plasmatice pot fi ridicate prin ingestia acută de alcool.4 Utilizarea metadonei pentru analgezie la pacienții cu afecțiuni hepatice nu a fost studiată; prin urmare, nu este recomandată pentru această utilizare la acești pacienți.4 Cu toate acestea, beneficiile programelor monitorizate de întreținere cu metadonă pentru dependența de opioide, cum ar fi abuzul de heroină, pot depăși riscurile potențiale.5
Buprenorfină: Administrarea orală a buprenorfinei, un agonist parțial al opioidelor mu, are ca rezultat un metabolism extins de primă trecere și un efect analgezic slab, în timp ce administrarea sublinguală permite ca aproximativ 50% până la 55% din medicament să evite inactivarea de către CYP3A4.4,15 Din păcate, studiile privind buprenorfina nu sunt disponibile în prezent pentru a determina dacă sunt necesare ajustări ale dozei sau dacă farmacocinetica rămâne neschimbată în insuficiența hepatică. Au fost raportate cazuri de hepatită la utilizarea buprenorfinei la pacienții cu disfuncție hepatică preexistentă. Din aceste motive, buprenorfina trebuie utilizată cu prudență la pacienții cu afecțiuni hepatice.
Diverse
Lidocaină: Utilizarea plasturelui topic de lidocaină este o considerație comună pentru controlul durerii localizate. Deși se consideră că lidocaina orală are o extracție hepatică ridicată cu metabolism de primă trecere, nu s-a găsit literatură care să discute farmacocinetica sau utilizarea plasturilor de lidocaină pentru controlul durerii la pacienții cirotici.19 Durerea în disfuncția hepatică poate fi difuză și/sau asociată cu ascită, ceea ce limitează indicația pentru plasturii cu lidocaină topică.7 Din cauza lipsei de dovezi și a posibilei toxicități, lidocaină trebuie utilizată cu prudență la pacienții cu disfuncție hepatică și numai pentru durere localizată.
Antidepresive triciclice (TCA): TCA-urile au fost mult timp pilonul principal al terapiei durerii neuropatice.5 TCA-urile sunt supuse metabolismului de prim pasaj și excreției renale. Acești agenți sunt bine cunoscuți pentru efectele lor anticolinergice, la care pacienții cirotici pot fi mai sensibili. Constipația este o preocupare semnificativă, care poate precipita encefalopatia hepatică la acești pacienți. Aceste medicamente trebuie utilizate cu prudență și numai dacă este necesar. În cazul în care sunt utilizate, nortriptilina și desipramină pot fi preferate datorită potenței mai mici și mai puțin sedare, tahicardie și hipotensiune ortostatică. Se recomandă începerea cu doze mici în boala hepatică și titrarea lentă în funcție de răspunsul pacientului. 4
Anticonvulsivante: Anticonvulsivantele joacă, de asemenea, un rol în managementul durerii neuropatice (prin modularea neurotransmițătorilor), dar aceste medicamente sunt frecvent metabolizate de ficat și excretate renal.5 La pacienții cirotici pot fi necesare doze mai mici și intervale prelungite. Carbamazepina este asociată cu hepatotoxicitate și trebuie evitată la pacienții cu disfuncții hepatice. Gabapentina este agentul preferat, deoarece nu este metabolizată hepatic și nici nu este legată de proteine, dar trebuie ajustată în funcție de funcția renală.4
Rezumat și recomandări
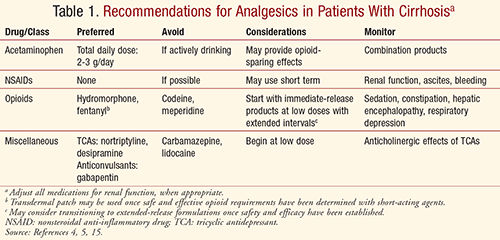
La toți pacienții, tratamentul durerii trebuie individualizat pe baza beneficiilor versus riscuri, cu o monitorizare atentă a ameliorării durerii și a efectelor adverse. Managementul durerii trebuie să implice o abordare multidisciplinară a intervențiilor farmacologice, comportamentale, psihologice și fizice pentru a obține cele mai bune rezultate și a optimiza calitatea vieții, în mod sigur și eficient. Practicienii trebuie să fie întotdeauna atenți la potențialul crescut de leziuni hepatice induse de medicamente la pacienții cu afecțiuni hepatice preexistente, inclusiv ciroză.5 Având în vedere profilurile farmacocinetice și de efecte adverse ale diferitelor medicamente analgezice, practicienii ar trebui să ia în considerare recomandările rezumate în TABELUL 1 pentru a obține un control sigur și adecvat al durerii la pacienții cirotici.
.