US Pharm. 2015;40(12):HS5-HS11.
ABSTRACT: La cirrosi è una diagnosi eterogenea che ha un impatto sulla funzione epatica, compreso il metabolismo e la clearance dei farmaci, ma l’effetto esatto rimane poco chiaro. Esistono idee sbagliate e una significativa variabilità nella pratica tra gli operatori sanitari per quanto riguarda l’uso di analgesici in pazienti con disfunzioni epatiche. Sulla base di dati limitati di sicurezza ed efficacia, l’acetaminofene è l’analgesico preferito nei pazienti con malattia epatica che non stanno bevendo attivamente, e può essere dosato fino a 2 o 3 g/giorno. I farmaci antinfiammatori non steroidei (FANS) devono essere evitati a causa dei loro effetti avversi di insufficienza renale, ritenzione di liquidi e aumento del rischio di sanguinamento. Gli oppioidi devono essere usati con cautela e iniziati con prodotti a rilascio immediato a basse dosi con intervalli prolungati e stretto monitoraggio. Tutti i farmaci per il dolore devono essere titolati con attenzione per ottenere un sollievo dal dolore sicuro e adeguato nei pazienti con insufficienza epatica.
La cirrosi è definita come una fibrosi epatica permanente secondaria a danni o lesioni. Si tratta di una diagnosi eterogenea, che comporta vari gradi di formazione di noduli, disfunzioni d’organo, complicazioni e morbilità e mortalità significative. Le cause della cirrosi includono l’abuso di alcol, l’epatite B e C, il cancro e l’epatite steatica non alcolica.1 “Malattia epatica cronica e cirrosi” come diagnosi primaria ha rappresentato più di 101.000 ricoveri ospedalieri nel 2010.2 Nel 2013, è stata riportata come una delle principali cause di morte nelle persone di età compresa tra 25 e 64 anni, e la dodicesima causa di morte per tutte le età, causando oltre 36.000 decessi.2
Purtroppo, questi numeri possono essere sottostimati a causa delle limitazioni dei criteri diagnostici dei codici ICD (International Classification of Diseases), che non tengono conto delle complicazioni legate alla cirrosi. Uno studio suggerisce che le morti legate al fegato potrebbero essere il doppio di quelle attualmente riportate dal CDC.3
I fornitori di assistenza sanitaria conoscono bene il ruolo vitale del fegato nel metabolismo e nell’eliminazione di molti farmaci. La cirrosi può portare allo sviluppo di shunt portoepatici, diminuendo in definitiva il metabolismo di primo passaggio che si verifica con molti farmaci orali. La diminuzione della produzione di albumina può anche provocare un aumento delle concentrazioni di farmaci legati alle proteine. Generalmente si pensa che con il progredire della disfunzione epatica, l’eliminazione dei farmaci sia compromessa; tuttavia, i pazienti con epatite cronica o cancro epatico, in assenza di cirrosi, possono avere solo un piccolo cambiamento nella clearance dei farmaci.4 Non è ancora chiaro in che misura la cirrosi influenzi la disposizione dei farmaci.
Mentre alcuni farmaci hanno specifici parametri di regolazione renale, gli aggiustamenti della dose epatica possono non essere facilmente disponibili. Molti studi hanno valutato la farmacocinetica e i livelli sierici degli analgesici dei pazienti, che non sono necessariamente correlati alla risposta del paziente. Altri studi disponibili si sono concentrati principalmente sull’epatite C, anche se molti pazienti sviluppano disfunzioni epatiche e cirrosi secondarie ad altre cause. I punteggi di Child-Pugh, che non sono comunemente calcolati nella pratica, spesso indirizzano il dosaggio, ma le raccomandazioni risultanti possono essere ancora vaghe senza una chiara guida per l’applicazione clinica. La gestione dei pazienti può essere ulteriormente complicata dalla concomitante compromissione renale, sia essa legata alla malattia epatica, come la sindrome epatorenale, o ad un’altra causa.4
Uso di analgesici nella cirrosi
La gestione del dolore è spesso una sfida per gli operatori sanitari, ma rimane una componente molto importante per fornire cure di qualità al paziente ed è un fattore comune nella soddisfazione del paziente.5 Un’alta prevalenza di dolore è stata riscontrata tra i pazienti con malattia cronica del fegato, segnalata tra il 32% e il 77%.6-8 Il dolore e i regimi antidolorifici a base di oppioidi sono risultati essere significativi fattori predittivi dell’utilizzo dell’assistenza sanitaria tra i pazienti con malattia del fegato.8
Una revisione retrospettiva ha rilevato che il 77% dei pazienti pretrapianto di fegato (n = 108) ha riportato dolore corporeo, con più di un terzo che ha indicato più sedi.7 Il dolore ha riferito di aver influito su lavoro, sonno, mobilità, appetito, piacere e umore. Circa il 90% ha riferito di aver ricevuto una terapia farmacologica; tuttavia, solo il 33% ha percepito sollievo. Gli oppioidi a breve durata d’azione sono stati prescritti nel 40% dei casi, e il 32% dei pazienti ha riferito di aver ricevuto cinque o più farmaci per il dolore. Gli autori hanno concluso che il dolore nei pazienti con malattia epatica allo stadio terminale (ESLD) è molto comune, ha un impatto sulla funzionalità ed è spesso sottotrattato, nonostante le numerose terapie farmacologiche prescritte.7
La polifarmacia è stata suggerita come un approccio comune alla gestione del dolore, probabilmente dovuto a prescrittori troppo prudenti che usano dosi molto basse di diversi farmaci piuttosto che un’attenta titolazione e ottimizzazione di un minor numero di agenti.7 La polifarmacia aumenta i costi, complica la comprensione dell’efficacia degli agenti, crea duplicazioni terapeutiche e aumenta il rischio intrinseco di interazioni tra farmaci e di effetti avversi. La gestione del dolore nella cirrosi presenta un’area complessa della farmacoterapia con considerazioni uniche sulla patofisiologia epatica alterata e un sottile equilibrio tra un adeguato sollievo dal dolore e la prevenzione di potenziali effetti avversi significativi.7
Acetaminofene
Si ritiene comunemente che l’acetaminofene debba essere evitato nei pazienti con disfunzioni epatiche a causa del suo ben noto rischio di epatotossicità nel sovradosaggio. Questo rischio è direttamente collegato alla saturazione di altre vie metaboliche e all’esaurimento delle riserve di glutatione (GSH).5 Circa il 5% dell’acetaminofene viene metabolizzato dagli enzimi CYP450 (prevalentemente 2E1, ma anche 1A3 e 3A4) nel metabolita reattivo N-acetil-p-benzochinone immina (NAPQI). In presenza di GSH, il NAPQI viene coniugato ed escreto per via renale. Quando il GSH non è disponibile, il NAPQI si accumula e causa la necrosi e l’apoptosi degli epatociti.
Gli alcolisti possono sviluppare un’induzione del CYP2E1 a causa dell’ingestione cronica di alcol e avere livelli di GSH diminuiti a causa della malnutrizione. Tali cambiamenti fisiologici possono far sì che questi pazienti siano a maggior rischio di lesioni epatiche indotte da acetaminofene. Di conseguenza, esiste la preoccupazione che tutti i pazienti con cirrosi abbiano livelli di GSH più bassi e un aumentato rischio di epatotossicità con l’acetaminofene. Sebbene sia stata documentata un’emivita prolungata nei pazienti con cirrosi, non sono disponibili studi prospettici a lungo termine per valutare la sicurezza dell’acetaminofene. Alcuni studi suggeriscono che il danno epatico è raro con un dosaggio appropriato e che l’acetaminofene è ben tollerato nella malattia epatica cronica stabile fino a 4 g/giorno, senza evidenza di aumento dell’attività del CYP o di esaurimento critico delle riserve di GSH.5,9,10
Dosi giornaliere totali di acetaminofene da 2 a 3 g sono raccomandate per l’uso sia a breve che a lungo termine in pazienti cirrotici che non bevono attivamente alcol, sulla base del parere degli esperti.4,5 Contrariamente alla credenza comune, l’acetaminofene è considerato l’agente preferito nelle disfunzioni epatiche se mantenuto entro un limite di dosaggio giornaliero totale, ma dovrebbe essere evitato nei pazienti che bevono attivamente alcolici.4,11,12 L’acetaminofene per via endovenosa è controindicato nell’insufficienza epatica grave e nella malattia epatica attiva grave.13
Farmaci antinfiammatori non steroidei (FANS)
Nei pazienti cirrotici, ci si aspettano alterazioni del metabolismo e della biodisponibilità con i FANS a causa del significativo metabolismo del CYP e del legame proteico.5 Tuttavia, la preoccupazione per i pazienti con cirrosi riguarda principalmente gli effetti fisiologici dei FANS. Questi farmaci inibiscono la sintesi delle prostaglandine portando a una diminuzione del flusso sanguigno renale e della velocità di filtrazione glomerulare (GFR) e a un’alterata escrezione renale di sodio e acqua, che può peggiorare l’ascite e aumentare il rischio di sindrome epatorenale nei pazienti con cirrosi.4 I FANS sono noti per causare irritazione gastrointestinale, ulcerazione e perforazione e aumentare il rischio complessivo di sanguinamento dei pazienti a causa dell’inibizione della produzione di trombossano A2 nelle piastrine.4,5 A causa della trombocitopenia, della diminuzione della sintesi dei fattori di coagulazione e delle varici esofagee associate all’ipertensione portale, i pazienti con cirrosi possono essere a più alto rischio di sanguinamento, che può essere pericoloso per la vita.4 Per queste ragioni, i FANS dovrebbero essere evitati nella cirrosi.
Opioidi
Gli oppioidi sono la classe di farmaci più comune per l’analgesia, in particolare il dolore moderato e grave o il dolore non alleviato da acetaminofene e FANS. Gli oppioidi possono contribuire a complicazioni significative con la cirrosi, compresa la precipitazione dell’encefalopatia, garantendo cautela nel loro uso.5 È ragionevole tenere a mente che gli effetti degli oppioidi possono essere invertiti con il naloxone, mentre le complicazioni del dolore non trattato o sottotrattato possono essere significative.14 Gli oppioidi possono essere necessari dopo che trattamenti non farmacologici e non oppioidi appropriati hanno prodotto risultati inadeguati.7
L’ossidazione è la principale via metabolica per gli oppioidi (spesso attraverso gli enzimi CYP), tranne che per la morfina, ed è considerata influenzata dalla disfunzione epatica.4,15 L’ossidazione è ridotta nelle malattie epatiche, portando a una diminuita clearance del farmaco e/o a una maggiore biodisponibilità orale con un ridotto metabolismo di primo passaggio. Mentre si ritiene che la glucuronidazione sia meno influenzata da una disfunzione epatica da lieve a moderata, essa può essere significativa in caso di malattia grave.4 Con queste considerazioni in mente, alcuni oppioidi sono considerati sicuri, efficaci e preferiti ai FANS per la gestione del dolore da moderato a grave con l’uso di dosi ridotte e intervalli prolungati. Tuttavia, a causa delle vaghe raccomandazioni, la decisione è spesso lasciata al giudizio clinico del medico.15 Gli agenti ad azione prolungata possono essere considerati solo dopo aver determinato un dosaggio sicuro ed efficace degli agenti ad azione breve.5
Tramadolo: Il tramadolo subisce un metabolismo epatico superiore all’80%.4 Mentre ci si aspettava che fornisse meno sollievo dal dolore nei pazienti cirrotici a causa della diminuita biotrasformazione, questo non è stato visto negli studi clinici.4 Uno studio ha notato una differenza significativa nella concentrazione di picco (Cmax) e nel tempo di picco (Tmax), una clearance ridotta della metà e un’emivita di eliminazione fino a 3 volte il controllo in 20 pazienti affetti da malignità epatica rispetto a 10 controlli sani.16 Gli autori raccomandano di prolungare l’intervallo di dosaggio, considerando il tramadolo 50 mg ogni 12 ore sicuro ed efficace. Altri hanno raccomandato 25 mg ogni 8 ore nelle disfunzioni epatiche.5 Le risorse informative sui farmaci, come Lexicomp, raccomandano 50 mg ogni 12 ore per i pazienti con cirrosi e dichiarano che il prodotto a rilascio prolungato non deve essere usato nei pazienti con disfunzioni epatiche gravi (Child-Pugh classe C).17
Il tramadolo può essere utile nel dolore intrattabile grazie alla sua parziale inibizione della ricaptazione della serotonina e all’attività sulle vie periferiche del dolore.5 Si deve usare cautela con il tramadolo nei pazienti con storia di crisi e in combinazione con altri farmaci serotoninergici, a causa del suo effetto di abbassamento della soglia delle crisi e del possibile sviluppo della sindrome da serotonina, rispettivamente. La dose e la frequenza del tramadolo devono anche essere ridotte secondo la funzione renale.17
Idrocodone e ossicodone: L’idrocodone e l’ossicodone dipendono dal CYP2D6 e 3A4 per il metabolismo nei loro metaboliti più potenti, idromorfone e ossimorfone, rispettivamente.5 L’effetto analgesico di questi farmaci può essere meno potente nei pazienti con disfunzione epatica a causa della diminuita conversione nei loro metaboliti attivi, mentre la diminuita clearance e la prolungata emivita possono produrre più effetti indesiderati.4,5 Si raccomanda di iniziare la terapia con dosi più basse e intervalli prolungati, permettendo un tempo adeguato tra le dosi per evitare l’accumulo e titolando secondo la risposta del paziente. Si deve usare cautela con i prodotti di combinazione di acetaminofene (per esempio, Vicodin, Percocet), assicurandosi che la dose totale giornaliera di acetaminofene sia entro il limite raccomandato di 2 o 3 g/giorno da tutte le fonti.5
Morfina: Si ritiene che la morfina abbia un’elevata estrazione epatica sul metabolismo di primo passaggio, rendendola biodisponibile solo dal 30% al 40% dopo la somministrazione orale in pazienti sani.4,5 La morfina viene metabolizzata dal fegato in morfina-6-glucuronide (metabolita attivo) e morfina-3-glucuronide (metabolita inattivo con potenziali effetti neurotossici), che vengono poi eliminati per via renale. Con un metabolismo di primo passaggio ridotto nei pazienti cirrotici, la morfina è probabilmente più biodisponibile e si raccomandano dosi orali più basse.4,5,15 Gli studi hanno costantemente dimostrato una clearance ridotta e un’emivita prolungata della morfina nei pazienti cirrotici. È stato raccomandato di aumentare l’intervallo di dosaggio fino al doppio per evitare l’accumulo del farmaco, sia nella somministrazione endovenosa che orale.5 La morfina dovrebbe essere evitata nella compromissione renale, inclusa la sindrome epatorenale, a causa del significativo accumulo dei suoi metaboliti e del rischio di neurotossicità.4
Idromorfone: Alcuni studi riportano una Cmax aumentata fino a quattro volte dopo una singola dose a rilascio immediato di idromorfone in pazienti con malattia epatica moderata, a causa della diminuzione del metabolismo di primo passaggio nella disfunzione epatica e dell’elevata estrazione epatica.4 È stato raccomandato di iniziare con dosi inferiori ma di mantenere un intervallo di dosaggio simile.4,5 La farmacocinetica dell’idromorfone non è stata studiata in pazienti con malattia epatica grave. La clearance dell’idromorfone sembra essere relativamente poco influenzata, in particolare dalla disfunzione renale. Tuttavia, è stato suggerito che l’idromorfone non sia usato nella sindrome epatorenale a causa del rischio osservato di accumulo del suo metabolita neuroeccitatorio, hydromorphone-3-glucuronide.4
Fentanyl: Sebbene il fentanyl sia fortemente legato alle proteine, si pensa che non sia influenzato dalla cirrosi.4,5,15 Il fentanyl può essere meglio tollerato nei pazienti cirrotici, poiché non ha metaboliti tossici.4 Tuttavia, il fentanyl potrebbe non essere l’agente più appropriato a causa della sua potenza molto elevata e di altri scenari clinici (ad es, dolore acuto, gestione ambulatoriale e necessità di somministrazione orale).15
L’uso di cerotti transdermici di fentanil è stato raccomandato come opzione di prima linea per il dolore intrattabile da alcuni autori, ma questo è controverso in quanto i pazienti con cirrosi hanno trovato concentrazioni Cmax e area sotto la curva (AUC) elevate quando si usano i cerotti, rispettivamente del 35% e 73%.4,5,18 È importante ricordare che l’uso di un cerotto di fentanil deve essere preso in considerazione solo dopo che il fabbisogno di oppioidi è stato determinato dalla titolazione degli oppioidi a breve durata d’azione.15 Si raccomanda di iniziare al 50% della dose abituale nella compromissione epatica lieve-moderata e di evitare l’uso nella compromissione epatica grave.18 Il fentanyl è considerato una buona opzione nella compromissione renale, e la somministrazione per via endovenosa può essere considerata nella sindrome epatorenale, poiché è uno degli oppioidi meno colpiti dalla disfunzione renale.4,5
Meperidina: Nella pratica corrente, la meperidina è usata raramente per l’analgesia a causa del rischio di convulsioni con l’accumulo del suo metabolita normeperidina. Anche se le concentrazioni di normeperidina possono essere inferiori a causa della diminuita attività del CYP in questi pazienti, c’è un aumento della biodisponibilità legato alla diminuzione del legame proteico e alla clearance ritardata, e il metabolita può ancora accumularsi.4,5,15 La meperidina dovrebbe essere evitata nella cirrosi.
Codeina: Nei pazienti sani, l’effetto analgesico della codeina è variabile a causa della variazione fenotipica del CYP2D6, che influenza la conversione in morfina. Nei pazienti con disfunzioni epatiche, i livelli sierici della codeina possono essere più variabili a causa della diminuita attività del CYP, causando una diminuzione dell’effetto analgesico.4,5,15 A causa di una generale mancanza di studi nei pazienti cirrotici, la codeina non è raccomandata.
Metadone: Per la gestione della dipendenza da oppioidi, il metadone è spesso usato. Il farmaco presenta molte sfide con la sua significativa variabilità interindividuale nella biodisponibilità, nel legame proteico e nella lunga emivita.4,5,15 È metabolizzato prevalentemente dal CYP3A4.15 L’accumulo può verificarsi con dosi ripetute in gravi disfunzioni epatiche e le concentrazioni plasmatiche possono essere elevate dall’ingestione acuta di alcol.4 L’uso del metadone per l’analgesia in pazienti con malattia epatica non è stato studiato; pertanto, non è raccomandato per questo uso in questi pazienti.4 Tuttavia, i benefici dei programmi di mantenimento del metadone monitorati per la dipendenza da oppioidi, come l’abuso di eroina, possono superare i potenziali rischi.5
Buprenorfina: La somministrazione orale di buprenorfina, un agonista parziale degli oppioidi mu, comporta un esteso metabolismo di primo passaggio e uno scarso effetto analgesico, mentre la somministrazione sublinguale permette a circa il 50%-55% del farmaco di evitare l’inattivazione da parte del CYP3A4.4,15 Purtroppo, gli studi sulla buprenorfina non sono attualmente disponibili per determinare se sono necessari aggiustamenti della dose o se la farmacocinetica rimane invariata nella compromissione epatica. L’epatite è stata riportata con l’uso di buprenorfina in pazienti con disfunzioni epatiche preesistenti. Per queste ragioni, la buprenorfina deve essere usata con cautela nei pazienti con malattia epatica.
Varie
Lidocaina: L’uso di cerotti di lidocaina topica è una considerazione comune per il controllo del dolore localizzato. Anche se si ritiene che la lidocaina orale abbia un’elevata estrazione epatica con metabolismo di primo passaggio, non è stata trovata alcuna letteratura che discuta la farmacocinetica o l’uso di cerotti alla lidocaina per la gestione del dolore in pazienti cirrotici.19 Il dolore nella disfunzione epatica può essere diffuso e/o associato ad ascite, limitando l’indicazione per i cerotti di lidocaina topici.7 A causa della mancanza di prove e della possibile tossicità, la lidocaina dovrebbe essere usata con cautela nei pazienti con disfunzione epatica e solo per il dolore localizzato.
Antidepressivi triciclici (TCA): I TCA sono stati a lungo il pilastro della terapia del dolore neuropatico.5 I TCA subiscono il metabolismo di primo passaggio e l’escrezione renale. Questi agenti sono noti per i loro effetti anticolinergici, ai quali i pazienti cirrotici possono essere più suscettibili. La costipazione è una preoccupazione significativa, che può precipitare l’encefalopatia epatica in questi pazienti. Questi farmaci devono essere usati con cautela e solo se necessario. Se usati, la nortriptilina e la desipramina possono essere preferiti a causa della minore potenza e meno sedazione, tachicardia e ipotensione ortostatica. Si raccomanda di iniziare a basse dosi nella malattia epatica e titolare lentamente in base alla risposta del paziente.4
Anticonvulsivi: Anche gli anticonvulsivanti giocano un ruolo nella gestione del dolore neuropatico (attraverso la modulazione dei neurotrasmettitori), ma questi farmaci sono comunemente metabolizzati dal fegato ed escreti per via renale.5 Dosi più basse e intervalli prolungati possono essere necessari nei pazienti cirrotici. La carbamazepina è associata a epatotossicità e dovrebbe essere evitata nei pazienti con disfunzioni epatiche. Il gabapentin è l’agente preferito, poiché non è metabolizzato a livello epatico né legato alle proteine, ma deve essere regolato in base alla funzione renale.4
Sommario e raccomandazioni
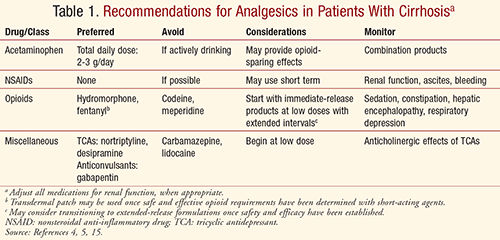
Con tutti i pazienti, la gestione del dolore deve essere individualizzata sulla base dei benefici rispetto ai rischi con un attento monitoraggio del sollievo dal dolore e degli effetti avversi. La gestione del dolore dovrebbe coinvolgere un approccio multidisciplinare di interventi farmacologici, comportamentali, psicologici e fisici per ottenere i migliori risultati e ottimizzare la qualità della vita, in modo sicuro ed efficace. Gli operatori devono sempre essere consapevoli del maggiore potenziale di danno epatico indotto dai farmaci nei pazienti con malattia epatica preesistente, compresa la cirrosi.5 Tenendo presente i profili farmacocinetici e gli effetti avversi dei vari farmaci analgesici, gli operatori devono considerare le raccomandazioni riassunte nella TABELLA 1 per ottenere un controllo sicuro e adeguato del dolore nei pazienti cirrotici.