- Introduction
- Anyagok és módszerek
- Befogadási kritériumok
- Petefészek-stimuláció és petesejt-nyerés
- Embrióátültetési szabályzat
- Primer kimeneteli mérések és statisztikai elemzés
- Eredmények
- Oocita és embrió paraméterek
- Pregnancy Outcomes and Cumulative Live Birth Rate (CLBR)
- Diszkusszió
- Következtetés
- Adatok hozzáférhetősége
- Etikai nyilatkozat
- A szerzők hozzájárulása
- Finanszírozás
- Érdekütközésre vonatkozó nyilatkozat
- Köszönet
Introduction
A közelmúltban egy új rendszert, a POSEIDON kritériumokat fejlesztették ki az asszisztált reprodukciós technológiával (ART) kezelt, alacsony prognózisú meddőségi betegek osztályozására (1). Ez egy hasznos rendszer a csökkent petefészek tartalékkal vagy gyenge petefészekválaszt mutató (POR) betegek azonosítására és osztályozására, útmutatást nyújtva ezen betegek diagnosztizálásához és kezeléséhez (2). Négy alcsoportot javasoltak kvantitatív és kvalitatív paraméterek alapján, beleértve az életkort, a petefészek tartalék biomarkereket és a petefészekválaszt. Az új kritériumok a POR részletesebb rétegzésének bevezetésével jelentősen csökkentették a bolognai kritériumoknak megfelelő betegek heterogenitását (3), ami a POR-populáción belül megkülönböztethet olyan betegalcsoportokat, amelyek azonosíthatók és részesülhetnek specifikus beavatkozásokban (4). Bár létrehozták a POSEIDON-kritériumokat, valamint az egyes betegalcsoportokra javasolt néhány konkrét kezelési ajánlást (5), még mindig nincs elegendő bizonyíték a POSEIDON-kritériumokban használt paraméterek érvényességének alátámasztására, valamint a különböző alcsoportok kimenetelének értékelésére.
A POSEIDON-kritériumok alapján felállított négy csoport közül az 1. csoport kétségkívül a legjobb prognózisú csoport, tekintettel a fiatalabb életkorra és a normális petefészek tartalékra, míg a 4. csoport a legrosszabb prognózisú az előrehaladott életkor és a csökkent petefészek tartalék miatt. Érdekes kérdés azonban, hogy ki érne el jobb terhességi eredményt, az idősebb nők (2. csoport) normális petefészek tartalékkal, vagy a fiatal nők (3. csoport) csökkent petefészek tartalékkal. A kumulatív élveszületési arányszámot (CLBR) az IVF-kezelés sikerének előnyösebb mérőszámának tekintik (6). Eddig nagyon kevés beszámoló született a POSEIDON-kritériumok által meghatározott négy betegcsoport CLBR-jéről.
A betegek jellemzőit és prognózisát fel kell használni a klinikai kezelési stratégiák kidolgozásához. E tanulmány célja az alacsony prognózisú betegek jellemzése a kezelési döntések meghozatalának megkönnyítése érdekében. Ebben a tanulmányban a POSEIDON-kritériumok által meghatározott betegcsoportok kiindulási jellemzőit és kimenetelét elemeztük, és az IVF-kezelésben részesülő, alacsony prognózisú betegek esetében az IVF-kezelésben részesülő betegek elsődleges kimeneti mérőszámaként az egy aspirációs in vitro fertilizációs (IVF)/intracitoplazmatikus spermiuminjekciós (ICSI) ciklusból származó CLBR-t javasoltuk (7).
Anyagok és módszerek
Ez a retrospektív vizsgálat 18 455 friss aspirált IVF-ciklust foglalt magában, amelyeket 2014 januárjától 2017 januárjáig a mi központunkban lefagyasztott embrióátültetés követett. Az élveszületés eredményét legalább 2 évig, 2019 januárjáig követtük nyomon. A vizsgálatot az Északnyugati Női és Gyermekkórház Humán asszisztált reprodukciós technológia klinikai alkalmazásával foglalkozó etikai bizottsága hagyta jóvá (No. 2018002). Az etikai bizottság jóváhagyta ezt a tanulmányt, amely eltekintett a tájékozott beleegyezés beszerzésének szükségességétől. Minden kutatást a vonatkozó irányelveknek és előírásoknak megfelelően végeztünk.
Befogadási kritériumok
A betegeket a POSEIDON-kritériumok szerint kategorizáltuk:
alacsony prognózisú betegek
1. csoport (n = 879 ciklus): csoport (n = 482 ciklus): életkor < 35 év, antralis tüszőszám (AFC) ≥ 5, az előző ciklusban kinyert petesejtek száma ≤ 9;
2. csoport (n = 482 ciklus): csoport (n = 858 ciklus): ≥ 35 éves kor, AFC≥5, az előző ciklusban kinyert petesejtek száma ≤ 9;
3. csoport (n = 858 ciklus): csoport (n = 1 306 ciklus): Életkor < 35, AFC < 5;
4. csoport (n = 1 306 ciklus):
Nem alacsony prognózisú betegek
5. csoport (n = 664 ciklus): ≥ 35 éves kor, AFC < 5;
5. csoport (n = 664 ciklus): AFC ≥ 5, korábbi petefészek-stimuláció > 9 petesejt;
6. csoport (n = 13708 ciklus): AFC ≥ 5, nincs korábbi petefészek-stimuláció.
A folyamatábra és az adatfeldolgozási eljárás az 1. ábrán látható. A betegek demográfiai és alapjellemzőit az 1. táblázat tartalmazza.
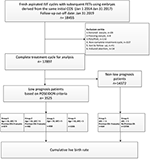
1. ábra. Folyamatábra és adatfeldolgozás.
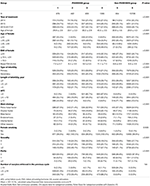
1. táblázat. Demográfiai adatok és kiindulási jellemzők.
Petefészek-stimuláció és petesejt-nyerés
A petefészek-stimuláció (OS) protokollját a nők életkora, testtömegindexe (BMI), bazális tüszőstimuláló hormon (FSH) és antralis tüszőszám (AFC) alapján egyénileg határozták meg. Az IVF-páciensek 94,33%-a kapott rekombináns és/vagy vizeletből származó gonadotropinokat (rFSH/hMG) GnRH-agonista protokollban vagy GnRH-antagonista protokollban, amelyet IVF vagy ICSI követett. A csökkent petefészek tartalékkal rendelkező nők esetében enyhe stimulációs protokollt vagy luteális fázisú petefészek-stimulációt vagy természetes ciklust alkalmaztak. Humán menopauzális gonadotropint (hMG, Li Zhu, Kína) adtak az enyhe ovulációs protokollban vagy a sanghaji protokollban a betegek stimulációra adott válaszának megfelelően. Humán koriongonadotropint (hCG) 4000-10 000 NE vagy rekombináns hCG-t (r-hCG, MerckSerono S.p.A.) 250μg-ot adtak, amikor 2-3 tüsző elérte a 17 mm-es vagy annál nagyobb méretet. Harminchat órával később a petesejtek kinyerését transzvaginális ultrahanggal irányított aspirációval végeztük. Az egyes csoportok petefészek-stimulációs paramétereit a 2. táblázat tartalmazza.

Táblázat. A petefészek-stimuláció paraméterei.
Embrióátültetési szabályzat
A petesejtfeldolgozási és embriófejlesztési eljárásokat, valamint az embrió pontozási rendszert korábbi cikkeinkben ismertettük (8, 9). Az 1-3. osztályú embriókat a 3. napon felhasználható embrióknak, az 1-2. osztályú embriókat pedig jó minőségű embrióknak tekintettük. Minden friss embrióátültetést (ET) a 3. vagy az 5. napon végeztünk. Azokban az esetekben, amikor a 3. napon elegendő számú (≥ 3-4) jó minőségű embrió volt, az 5. napon blasztociszta-transzfert végeztek. Az átültetett embriókon kívül a betegek extra embrióit a 3. napon vagy a blasztociszta stádiumban (5-6. nap) vitrifikálták. Az 1-3. osztályú hasadási stádiumú embriókat a 3. napon és a 4CC feletti Gardner-pontszámmal rendelkező blasztocisztákat kriokonzerválták (Cryo-top, nyílt rendszer, Kuwayama). A módszereket és a fagyasztott ET-eljárást részletesen ismertetjük a csoportunk korábbi verifikációs tanulmányában (8, 9). Ha a friss ciklusban a beültetés nem sikerült, a fagyasztott-felengedett embrió transzfer (FET) a megmaradt üvegezett embriók vagy blasztociszták felhasználásával történt. A 35 év alatti, jó minőségű embriókkal rendelkező betegeket egy embrió transzferre ösztönözték. Az egy embrió átültetésének politikáját alkalmazták azoknál a betegeknél is, akiknél a méh rendellenes volt (pl. heges méh, méh rendellenesség) és/vagy más, az ikerterhességgel ellentétes esetekben. Progeszteron intramuszkuláris injekciót (60 mg/nap) adtak a luteális fázis támogatására a petesejtek kinyerésének napjától a negatív béta-hCG szérum vagy a terhesség 8. hetéig.
Primer kimeneteli mérések és statisztikai elemzés
Az elsődleges kimeneti eredmény a kumulatív élveszületés (CLB) volt, amelyet úgy definiáltak, mint legalább egy élveszületés, amely a kinyerhető petesejtek számához viszonyítva a friss ET vagy az azt követő FET ciklusban egy aspirált ART-ciklusból ered. A CLBR kiszámításának számlálója a FET-ekben elért élveszületések és a friss ciklusokban elért élveszületések összege volt. Csak az első szülést vették figyelembe az elemzésben, ha egy páciens több szülést is elért. A CLBR-t a terminológiai meghatározásnak megfelelően a transzvaginális petesejt-aspirációnkénti kumulatív élveszületésként határoztuk meg (7, 10) Egy kezelési ciklus egy petesejtnyerésnek minősült. Egy teljes kezelési ciklus olyan kezelési ciklust jelentett, amely elérte az élveszületést, vagy olyan kezelési ciklust, amely nem érte el az élveszületést az összes átültetett embrióval. A kumulatív élveszületési arányt ebben a vizsgálatban a teljes kezelési ciklus alapján számoltuk ki, így a nem teljes kezelési ciklusban részesülő betegeket (n = 337) kizártuk.
Az adatok feldolgozását és a statisztikai elemzést az EmpowerStats szoftver (www.empowerstats.com) és az R statisztikai szoftvercsomagok segítségével végeztük. A CLBR esélyhányadosának (OR) értékeléséhez a különböző betegcsoportokban többváltozós regressziós modellt hoztunk létre, amelyben a potenciális zavaró tényezők voltak a változók, és korrigáltuk a kezelés éve, a női BMI, a meddőség típusa, a meddőség időtartama, a graviditás, a paritás, a fő etiológia, az OS protokoll, a gonadotropin típusa és az FSH kezdő dózisa alapján. A betegeket 3 éven keresztül vették fel, amelynek során az IVF-eljárást felülvizsgálták. Az e tényező okozta torzítás kiküszöbölése érdekében a kumulatív élveszületési arányt a kezelés évével korrigálták. A női BMI, a meddőség típusa, a meddőség időtartama, a graviditás, a paritás és a fő etiológia a tapasztalatok vagy az irodalom alapján a terhességet és az élveszületést befolyásoló fontos tényezők voltak. Az OS protokoll, a gonadotropin típusa és az FSH kezdő dózisa a legfontosabb mutatók, amelyek befolyásolják a kinyert petesejtek számát és végső soron az élveszületések kumulatív esélyét.
Eredmények
Oocita és embrió paraméterek

3. táblázat. Oociták és embriók paraméterei és CLBR-ek.
Pregnancy Outcomes and Cumulative Live Birth Rate (CLBR)
Az oociták és embriók számának csoportonkénti eloszlási mintázatával összhangban a CLBR-ek a legmagasabbtól a legalacsonyabbig terjedő sorrendben 44 volt.6% az 1. csoportban (n = 879), 35,5% a 3. csoportban (n = 858), 24,5% a 2. csoportban (n = 482) és 12,7% a 4. csoportban (n = 1306). Többváltozós regressziós elemzést végeztünk az 1., 2. táblázatban leírt, zavaró tényezőként ható változókkal. A CLBR korrigált esélyhányadosait (OR) 95%-os konfidenciaintervallumaikkal (CI) a 4. táblázatban mutattuk be. A nem kiigazított eredmények tendenciájával összhangban a CLBR a 3. csoportban (OR 0,9, 95% CI 0,7-1,2, p = 0,615) kissé alacsonyabb, az 5. csoportban (OR 1,3, 95% CI 0,9-1,7, p = 0,111) pedig kissé magasabb volt, mint a CLBR az 1. csoportban, szignifikáns statisztikai különbség nélkül. A CLBR a 2. csoportban szignifikánsan alacsonyabb volt, mint az 1. csoportban (OR 0,6, 95% CI 0,4-0,8, p = 0,004), és a CLBR a 4. csoportban volt a legalacsonyabb (OR 0,4, 95% CI 0,3-0,6, p < 0,001) az 1. csoporthoz képest. Az 5. táblázat a friss transzfer vagy FET szerinti terhességi eredményeket mutatja az alacsony prognózisú betegeknél. A beültetési arányok az idős csoportokban (2. és 4. csoport) szignifikánsan alacsonyabbak voltak, mint a fiatal csoportokban (1. és 3. csoport).

4. táblázat. Logisztikus regressziós elemzés a CLBR-ekre.

Táblázat. Terhességi eredmények transzferenként friss és fagyasztott embrió transzferenként az alacsony prognózisú betegeknél.
A 2. ábra a kulcsfontosságú események trenddiagramját mutatta az alacsony prognózisú betegeknél. A 2. és a 3. csoport között az embrióátültetést követően a trendvonalak kereszteződése volt tapasztalható. A 2. csoportba tartozó betegeknél (életkor ≥35; AFC ≥ 5) magasabb AFC, több visszanyert petesejt, több embrió és több jó minőségű embrió volt, de csökkent a beültetési arány és a CLBR. Ezzel szemben, bár a 3. csoportba tartozó betegeknél (életkor < 35 év; AFC < 5) kevesebb petesejt és embrió volt, a CLBR magasabbnak bizonyult, mint a 2. csoportban. A POSEIDON-kritériumok alapján meghatározott alacsony prognózisú betegek 4 csoportjának SWOT-elemzése a 3. ábrán látható.
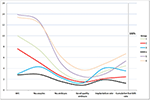
2. ábra. A kulcsfontosságú események trenddiagramja alacsony prognózisú betegeknél. A trendvonalak keresztezése a 2. csoport (piros) és a 3. csoport (kék) között az embrióátültetés után. Az X tengely az AFC átlagos számát, az oociták számát, az embriók számát, a jó minőségű embriók számát, a beültetés arányát és a kumulatív élveszületés arányát mutatja. A bal oldali Y tengely az első négy változó számát (n), a jobb oldali Y tengely pedig az utolsó két változó arányát (%) jelöli.

3. ábra. A POSEIDON-kritériumok alapján meghatározott alacsony prognózisú betegek 4 csoportjának SWOT-elemzése.
Diszkusszió
A POSEIDON-kritériumok alapján meghatározott populációban végzett retrospektív vizsgálat fő megállapítása, hogy a CLBR az 1. csoportban volt a legmagasabb, majd a 3. és a 2. csoportban, és a 4. csoportban a legalacsonyabb. Eredményeink szerint a CLBR a rossz petefészek tartalékkal rendelkező fiatal nők (3. csoport) esetében valamivel alacsonyabb volt, mint a jó petefészek tartalékkal rendelkező, korábban alacsonyan reagáló fiatal nők esetében (1. csoport). Bár a 2. csoportba tartozó betegek (életkor ≥ 35 év; AFC ≥ 5) jobb petefészek tartalékkal, több petesejttel és több embrióval rendelkeztek, a CLBR és a beültetési arány fordítva alacsonyabb volt, mint a 3. csoportba tartozó, rosszabb petefészek tartalékkal, kevesebb petesejttel és kevesebb embrióval rendelkező betegeknél. Ez a megállapítás megkönnyítheti az alacsony prognózisú betegek kezelési stratégiáinak kidolgozását.
Az innovatív POSEIDON-kritériumok célja az alacsony prognózisú betegek azonosítása és rétegzése négy különböző csoportba a nő életkora, az AFC és az előző ciklusban adott petefészekválasz alapján (4). A 2. csoportba tartozó betegeket jó petefészek tartalék és előrehaladott életkor jellemezte, pontosan ellentétben a 3. csoportba tartozó, rossz petefészek tartalékkal rendelkező, de fiatalabb életkorú betegekkel. Vizsgálatok (11-13) kimutatták, hogy a CLBR a kinyert petesejtek számával együtt nő, még az előrehaladott korú nők esetében is (14). Azt sugallták, hogy a kinyert petesejtek száma nagyon fontos változó, amely független kapcsolatban áll a CLBR-rel. A 2. csoportba tartozó, nagyobb számú petesejtet nyert betegek prognózisa várhatóan jobb volt, mint a 3. csoportba tartozó betegeké, mivel a 2. csoportba tartozó betegeknél több embriót lehetett átültetni. A CLBR és a beültetési arány azonban fordítottan magasabb volt a 2. csoportban, mint a 3. csoportban.
Eredményeink összhangban vannak a korábbi tanulmányokkal (15, 16) a petefészek tartalék és a terhesség kimenetelének összefüggéséről. Chang és munkatársai (15) azt találták, hogy az idősebb nőknél alacsonyabb volt a normális megtermékenyülés, a hasadás, a jó minőségű embriók, a beágyazódás és a terhesség aránya, mint a csökkent petefészek tartalékkal rendelkező fiatalabb nőknél. Ennek elsődleges oka az öregedő petesejtnek a terhesség kimenetelére gyakorolt kedvezőtlen hatása (alacsony beültetési arány és magas terhességvesztési arány) volt a kromoszóma-rendellenességek (17) és a citoplazma diszfunkció (18) miatt. A termékenység öregedéssel járó csökkenése az oocita mennyiségét és minőségét egyaránt érinti. A beültetés és a vetélés összefügg az oociták minőségével, de nem feltétlenül a petefészek tartalékával (16). A 2. csoportban a megfelelő petefészek tartalék növelné annak lehetőségét, hogy több petesejtet és embriót kapjunk a transzferhez, ugyanakkor a magasabb aneuploidia arány alacsony beültetési arányhoz és magas vetélési arányhoz vezetne.
A 2. csoportba tartozó betegek kezelése tekintetében nagyobb figyelmet kell fordítani a petesejtek minőségét javító stratégiák kidolgozására, mint a petesejtek mennyiségére vagy az embriók mennyiségére. Mivel a 2. csoportban a 3. napon több embriót érnek el, az embriók tenyésztése a blasztociszta stádiumig a transzferhez jó lehetőség. Az 5-6. napi embriókban alacsonyabb a szegmentális aneuploidia aránya (19) és magasabb a beültetésre való életképesség (20), mint a 2-3. napi embriókban. Az aneuploidia preimplantációs genetikai vizsgálata (PGT-A) szintén előnyös az előrehaladott korú nők számára az euploid embrió kiválasztásához a transzferhez (21). Az optimális petefészek-stimulációs kezelés a petesejtek minőségének javítása érdekében (22, 23) alternatív lehetőség lehet. A tüszőfejlődés javítására olyan kiegészítőkkel próbálkoztak, mint a dehidroepiandroszteron (24), bár nincs elegendő bizonyíték arra, hogy ezekben a betegekben való alkalmazásukat alátámasszák.
A 3. csoportba tartozó betegek (életkor < 35 év; AFC < 5) petefészek tartalékkal rendelkeztek, akik várhatóan rossz válaszadók voltak, rossz terhességi kimenetellel. Érdekes módon a 3. csoportban a petesejt-kibocsátási arány (145,3% AFC-nként kinyert petesejt) szignifikánsan magasabb volt, mint a többi csoportban, bár az FSH kezdő dózisát nem növelték szignifikánsan (2. táblázat). Ez arra utalt, hogy az antralis tüszők gonadotropinra adott válasza elérte a határát, ezért a napi gonadotropinadagok további növelése nem jár további előnyökkel az oocitaszám tekintetében (25). A petefészkek FSH-ra való érzékenységének értékelése kulcsfontosságú az IVF sikerességi arányának javításához ezeknél az alacsony prognózisú betegeknél, és új kezelési perspektívák megnyitásához (26). A 3. csoportban az AFC-nkénti magas petesejt-kibocsátási arány szintén alátámasztotta a 300 NE rFSH maximális napi dózisára vonatkozó jelentett ajánlást (5). A 3. csoportba tartozó betegek esetében több erőfeszítést kell tenni az oociták számának növelésére, mivel a klinikai terhesség kimenetele megnyugtató, ha már sikerült oocitákat szerezni.
Az 5. csoportba tartozó betegek a nem alacsony prognózisú betegek voltak, akiknek jó volt a petefészekválaszuk (több mint 9 oocita az előző visszanyerés során), azonban e betegek többségénél az előző IVF-ciklusban nem sikerült az élveszületés. Összehasonlítva egy másik, nem alacsony prognózisú, első IVF-kezelésben részesülő beteggel (6. csoport), bár az 5. csoportba tartozó betegeknél több AFC és több visszanyert petesejt volt, az embriófejlődés és a terhesség kimenetele rosszabb volt, mint a 6. csoportban. Ezért a jó petefészekválaszú első IVF-páciensek kudarca a későbbi IVF-kezelés rossz prognózisa lehet.
A meddőség leggyakoribb oka a meddőség, a meddő nők mintegy 10,8-78,3%-át teszi ki Kínában (27, 28). A tubális faktor főként a tubus elzáródását és a peritoneális patológiát jelenti, amely összenövéseket okoz, és amelyet hysterosalpingográfiával és laparoszkópiával diagnosztizáltak. A tubális faktoros meddőség leggyakoribb okaként a kismedencei gyulladásos betegséget (PID), a salpingitist és az endometriózist jelölték meg (29). E tanulmány betegcsoportjaiban a tubális faktor a fő meddőségi etiológia, 62,9 és 71,4% között, ami magasabb volt, mint más országok és régiók meddő nőknél. Ezért óvatosan kell értelmezni az eredmények szélesebb körű következményeit.
A korlátozások a vizsgálat retrospektív jellegével kapcsolatosak, és az a tény, hogy az adatok egyetlen központból származnak, szintén gyengíti megfigyeléseink egyetemességét. További lehetséges korlátok lehetnek, hogy nem GnRH-analóg protokollt alkalmaztak néhány csökkent petefészek tartalékkal rendelkező nőnél, nem pedig normális petefészek tartalékkal rendelkezőknél. Azokat a friss ciklusokat, amelyek nem hoztak petesejtet, nem vontuk be ebbe a vizsgálatba, például a petefészek-stimuláció lemondásával járó ciklusokat.
A vizsgálat eredményei új ismeretekkel szolgálhatnak az alacsony prognózisú betegek kezelési stratégiáinak kidolgozásához. A rossz prognózisú betegek klinikai kezelésének segítésére SWOT-elemzést végeztünk, amelyet a POSEIDON-jelentésekből (1, 2, 4, 5) és e tanulmány adataiból merítettünk. Az antralis tüszők gonadotropinra való érzékenysége a 3. csoportban rendkívül magasabb volt, mint a többi csoportban. Figyelembe véve a 3. csoportban elért örömteli CLBR-eredményt, a petesejttermelés növelése érdekében javasoljuk, hogy próbálkozzunk több petefészek-stimulációval, de ne keményebb petefészek-stimulációval, túlzott napi gonadotropinadagolással. Bár a 2. csoportba tartozó betegek több petefészek tartalékkal, valamint több petesejttel és embrióval rendelkeztek, a CLBR a vártnál alacsonyabb volt. A 2. csoport kezelési stratégiájának inkább az élveszületési arány javítására kell irányulnia, mint a kinyert petesejtek számának növelésére.
Következtetés
Végeredményben, a pácienscsoportonkénti petesejt- és embriómennyiség eloszlási mintázatával összeegyeztethetetlenül, a CLBR-ek a legmagasabbtól a legalacsonyabbig terjedő sorrendben az 1. csoportban (fiatal nők jó petefészek tartalékkal), a 3. csoportban (fiatal nők rossz petefészek tartalékkal), a 2. csoportban (előrehaladott korú nők jó petefészek tartalékkal), és végül a 4. csoportban (előrehaladott korú nők rossz petefészek tartalékkal) voltak.
Adatok hozzáférhetősége
A kézirat következtetéseit alátámasztó nyers adatokat a szerzők indokolatlan fenntartás nélkül bármely jogosult kutató rendelkezésére bocsátják.
Etikai nyilatkozat
A vizsgálatot az Északnyugati Nő- és Gyermekkórház Humán asszisztált reprodukciós technológia klinikai alkalmazásával foglalkozó etikai bizottsága jóváhagyta (No. 2018002). A vizsgálatot jóváhagyó etikai bizottság eltekintett a tájékozott beleegyezés beszerzésének szükségességétől. Az összes kutatást a vonatkozó irányelveknek és előírásoknak megfelelően végeztük.
A szerzők hozzájárulása
WS és JS fogalmazták meg és tervezték meg a tanulmányt. WS és WZ megszerkesztette és átdolgozta a kéziratot. WS, ZZ és WZ elemezte és értelmezte az adatokat. LT, ZZ és HZ összegyűjtötte és tisztázta az adatokat. Minden szerző elolvasta és jóváhagyta a kézirat végleges változatát.
Finanszírozás
A tanulmányt a Shaanxi tartomány társadalmi fejlődésének általános projektjei (No. 2018SF-247) és az Északnyugati Női és Gyermekkórház személyzeti képzési programja (2018ZD02) finanszírozta.
Érdekütközésre vonatkozó nyilatkozat
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Köszönet
Köszönjük az Északnyugati Női és Gyermekkórház valamennyi klinikusának, tudósának és embriológusának az adatgyűjtésben nyújtott segítségét, valamint valamennyi betegnek a tanulmányhoz való hozzájárulását. Hálásan köszönjük Dr. Xinglin Chennek a bostoni X&Y solutions Inc. epidemiológiai és biostatisztikai osztályáról a statisztikai támogatásban való közreműködését.
1. Alviggi C, Andersen CY, Buehler K, Conforti A, De Placido G, Esteves SC, et al. A petefészek-stimulációra gyengén reagálók új, részletesebb rétegzése: a rossz petefészekválasztól az alacsony prognózis fogalmáig. Fertil Steril. (2016) 105:1452-3. doi: 10.1016/j.fertnstert.2016.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Humaidan P, Alviggi C, Fischer R, Esteves SC. Az “asszisztált reprodukciós technológiában részesülő alacsony prognózisú betegek” új POSEIDON rétegzése és a sikeres kimenetel javasolt markere. F1000Res. (2016) 5:2911. doi: 10.12688/f1000research.10382.1
CrossRef Full Text | Google Scholar
3. Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund G, Gianaroli L, et al. ESHRE consensus on the definition of “poor response” to ovarian stimulation for in vitro fertilization: the Bologna criteria. Hum Reprod. (2011) 26:1616-24. doi: 10.1093/humrep/der092
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Humboldt és a magyarországi orvosok és orvosszakértők. Esteves SC, Roque M, Bedoschi GM, Conforti A, Humaidan P, Alviggi C. Az alacsony prognózisú, asszisztált reprodukciós technológián átesett betegek meghatározása: POSEIDON kritériumok – a miértek. Front Endocrinol. (2018) 9:461. doi: 10.3389/fendo.2018.00461
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Keresés English (2018) 9:461. doc. Shi W, Zhang S, Zhao W, Xia X, Wang M, Wang H és mtsai. 2313 transzferciklus retrospektív és többváltozós logisztikus regressziós elemzése 2313 transzferciklusról: a klinikai terhességgel kapcsolatos tényezők üvegezett-melegített embrió transzfer után. Hum Reprod. (2013) 28:1768-75. doi: 10.1093/humrep/det094
PubMed Abstract | CrossRef Full Text | Google Scholar
11. HUMREP/det094
. Polyzos NP, Drakopoulos P, Parra J, Pellicer A, Santos-Ribeiro S, Tournaye H, et al. Cumulative live birth rates according to the number of oocytes retrieved after the first ovarian stimulation for in vitro fertilization/intracytoplasmic sperm injection: a multicenter multinational analysis including approximately 15,000 women. Fertil Steril. (2018) 110:661-70 e1. doi: 10.1016/j.fertnstert.2018.04.039
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gyógyszeres sterilizáció. Zhou J, Wang B, Hu Y, Sun H. A kinyert petesejtek száma és a kumulatív élveszületési arány közötti kapcsolat 35-40 éves nőknél, akik hosszú GnRH-agonista IVF/ICSI-ciklusokon estek át. Arch Gynecol Obstet. (2017) 296:1005-12. doi: 10.1007/s00404-017-4503-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. MTA doktora (2017) 296:1005-12. Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. A kumulatív élveszületési arány előrejelzése a korábbi ART-ciklusokban levett petesejtek száma alapján. Hum Reprod. (2019) 34:171-80. doi: 10.1093/humrep/dey341
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Gyógyszerészi vizsgálat. Devesa M, Tur R, Rodriguez I, Coroleu B, Martinez F, Polyzos NP. Halmozott élveszületési arányok és a kinyert petesejtek száma előrehaladott korú nőknél. Egyetlen központban végzett elemzés, amely 4500 >/ = 38 éves nőt tartalmazott. Hum Reprod. (2018) 33:2010-17. doi: 10.1093/humrep/dey295
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Humboldogasszonyok és gyermekvállalás. Chang Y, Li J, Li X, Li X, Liu H, Liang X. A petesejtek minősége és a terhesség kimenetele fiatal, csökkent petefészek tartalékkal rendelkező meddő nőknél. Med Sci Monit. (2018) 24:7279-84. doi: 10.12659/MSM.910410
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bishop LA, Richter KS, Patounakis G, Andriani L, Moon K, Devine K. A tüszőstimuláló hormon és az antralis tüszőszám alapján mért csökkent petefészek tartalék nincs összefüggésben a terhesség elvesztésével fiatalabb in vitro fertilizációs betegeknél. Fertil Steril. (2017) 108:980-7. doi: 10.1016/j.fertnstert.2017.09.011
CrossRef Full Text | Google Scholar
17. A teljes szöveg | Google Scholar
. Igarashi H, Takahashi T, Nagase S. Oocyta öregedés a női reproduktív öregedés hátterében: biológiai mechanizmusok és terápiás stratégiák. Reprod Med Biol. (2015) 14:159-69. doi: 10.1007/s12522-015-0209-5
PubMed Abstract | CrossRef Full Text | Google Scholar
19. MTA doktora. Babariya D, Fragouli E, Alfarawati S, Spath K, Wells D. A szegmentális aneuploidia előfordulása és eredete emberi petesejtekben és preimplantációs embriókban. Hum Reprod. (2017) 32:2549-60. doi: 10.1093/humrep/dex324
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Humboldt, Budapest, 2017. Zeng M, Su S, Li L. A hasadási és a blasztociszta stádiumban történő vitrifikációt követő terhességi eredmények összehasonlítása: metaanalízis. J Assist Reprod Genet. (2018) 35:127-34. doi: 10.1007/s10815-017-1040-1
PubMed Abstract | CrossRef Full Text | Google Scholar
22. MTA BTK (2018) 35:127-34. Lin LT, Vitale SG, Chen SN, Wen ZH, Tsai HW, Chern CU, et al. Luteális fázisú petefészek-stimuláció javíthatja a petesejtek kinyerését és a petesejtek minőségét in vitro megtermékenyítésen áteső rossz petefészek-reagálókban: egy egyközpontú prospektív kísérleti vizsgálat előzetes eredményei. Adv Ther. (2018) 35:847-56. doi: 10.1007/s12325-018-0713-1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Gyógyszerészi vizsgálat. Narkwichean A, Maalouf W, Baumgarten M, Polanski L, Raine-Fenning N, Campbell B, et al. A dehidroepiandroszteron (DHEA) hatékonysága a petefészek öregedés hatásának leküzdésére (DITTO): elvi bizonyíték kettős vak, randomizált, placebo kontrollált kettős vak vizsgálat. Eur J Obstet Gynecol Reprod Biol. (2017) 218:39-48. doi: 10.1016/j.ejogrb.2017.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Az Európai Unió és a világszervezetek közötti kapcsolatok és a világszervezetek közötti kapcsolatok. Grynberg M, Labrosse J. A follicular output rate (FORT) megértése és ennek következményei a POSEIDON kritériumokra. Front Endocrinol. (2019) 10:246. doi: 10.3389/fendo.2019.00246
PubMed Abstract | CrossRef Full Text | Google Scholar
27. 27. Elméleti és pszichológiai vizsgálatok. Hou LY. A meddőség epidemiológiai vizsgálata Kína három tartományában. Phd Thesis, Graduate School of Peking Union Medical College, Beijing, China (2011).
Google Scholar
28. Zhu Hui-li HW. A petefészek meddőség epidemiológiája és etiológiája. J Int Reprod Health/Family Plann. (2016) 35:212-216.
Google Scholar