US Pharm. 2015;40(12):HS5-HS11.
ABSTRACT: A cirrózis heterogén diagnózis, amely befolyásolja a májműködést, beleértve a gyógyszerek metabolizmusát és clearance-ét, de a pontos hatás továbbra is tisztázatlan. Az egészségügyi szakemberek körében tévhitek és jelentős gyakorlati eltérések léteznek a fájdalomcsillapítók májműködési zavarral küzdő betegeknél történő alkalmazásával kapcsolatban. A korlátozott biztonságossági és hatékonysági adatok alapján a paracetamol az előnyben részesített fájdalomcsillapító a májbetegségben szenvedő, nem aktívan ivó betegeknél, és akár 2-3 g/nap is adagolható. A nem szteroid gyulladáscsökkentők (NSAID-ok) kerülendők a vesekárosodással, folyadékvisszatartással és fokozott vérzésveszéllyel járó káros hatásuk miatt. Az opioidokat óvatosan kell alkalmazni, és az azonnali felszabadulású készítményekkel kell kezdeni, alacsony dózisban, hosszabb időközönként és szoros megfigyelés mellett. Minden fájdalomcsillapítót óvatosan kell titrálni a biztonságos és megfelelő fájdalomcsillapítás elérése érdekében a májkárosodásban szenvedő betegeknél.
A cirrózis a károsodás vagy sérülés következtében kialakult maradandó májfibrózis. Ez egy heterogén diagnózis, amely különböző mértékű gócképződéssel, szervi diszfunkcióval, szövődményekkel, valamint jelentős morbiditással és mortalitással jár. A cirrózis okai közé tartozik az alkoholfogyasztás, a hepatitis B és C, a rák és a nem alkoholos steato-hepatitis.1 A “krónikus májbetegség és cirrózis” mint elsődleges diagnózis 2010-ben több mint 101 000 kórházi felvételt jelentett.2 2013-ban a 25-64 évesek körében ez volt a vezető halálozási ok, minden korosztályban pedig a 12. vezető halálozási ok, több mint 36 000 halálesetet okozva.2
Ezek a számok sajnos alulbecsültek lehetnek a betegségek nemzetközi osztályozásának (ICD) diagnosztikai kritériumainak korlátai miatt, amelyek nem veszik figyelembe a cirrózissal kapcsolatos szövődményeket. Egy tanulmány szerint a májjal kapcsolatos halálesetek száma akár kétszerese is lehet a CDC által jelenleg közölt adatoknak.3
Az egészségügyi szolgáltatók ismerik a máj létfontosságú szerepét számos gyógyszer anyagcseréjében és kiürítésében. A májzsugor a portohepatikus söntök kialakulásához vezethet, ami végső soron csökkenti a számos szájon át szedett gyógyszer esetében bekövetkező first-pass metabolizmust. A csökkent albumintermelés az erősen fehérjéhez kötött gyógyszerek szabad gyógyszer-koncentrációjának növekedését is eredményezheti. Általában úgy gondolják, hogy a májműködési zavar előrehaladtával a gyógyszerek eliminációja romlik; azonban a krónikus hepatitisben vagy májrákban szenvedő betegeknél – cirrózis hiányában – a gyógyszer-clearance csak kis mértékben változik.4 Továbbra sem világos, hogy a cirrózis milyen mértékben befolyásolja a gyógyszerek diszpozícióját.
Míg bizonyos gyógyszerek specifikus veseadagolási paraméterekkel rendelkeznek, a májadagolás beállítása nem biztos, hogy könnyen elérhető. Számos tanulmány értékelte a farmakokinetikát és a betegek fájdalomcsillapító szérumszintjét, amelyek nem feltétlenül korrelálnak a betegek válaszával. Más rendelkezésre álló tanulmányok elsősorban a hepatitis C-re összpontosítottak, bár sok betegnél más okok miatt másodlagosan májműködési zavar és cirrózis alakul ki. A Child-Pugh-pontszámok, amelyeket a gyakorlatban nem szoktak kiszámítani, gyakran irányítják az adagolást, de az ebből eredő ajánlások még mindig homályosak lehetnek a klinikai alkalmazásra vonatkozó egyértelmű útmutatás nélkül. A betegek kezelését tovább nehezítheti az egyidejűleg fennálló vesekárosodás, akár a májbetegséghez, például a hepatorenális szindrómához, akár más okhoz kapcsolódik.4
Fájdalomcsillapítók alkalmazása cirrózisban
A fájdalom kezelése gyakran kihívást jelent az egészségügyi szakemberek számára, de továbbra is nagyon fontos eleme a minőségi betegellátásnak, és a betegek elégedettségének gyakori tényezője.5 A krónikus májbetegségben szenvedő betegek körében a fájdalom magas prevalenciáját találták, a jelentések szerint 32% és 77% között.6-8 A fájdalom és az opioid alapú fájdalomcsillapítás jelentős előrejelző tényezőnek bizonyult az egészségügyi ellátás igénybevételében a májbetegek körében.8
Egy retrospektív áttekintés szerint a májátültetés előtti betegek 77%-a (n = 108) testi fájdalomról számolt be, több mint egyharmaduk több helyen is.7 A fájdalom állítólag befolyásolta a munkát, az alvást, a mobilitást, az étvágyat, az élvezetet és a hangulatot. Körülbelül 90%-uk számolt be arról, hogy farmakológiai terápiában részesült, azonban csak 33%-uk érzékelt enyhülést. A rövid hatású opioidokat az esetek 40%-ában írták fel, és a betegek 32%-a számolt be arról, hogy öt vagy több fájdalomcsillapítót írtak fel. A szerzők arra a következtetésre jutottak, hogy a végstádiumú májbetegségben (ESLD) szenvedő betegek fájdalma nagyon gyakori, befolyásolja a funkcionalitást, és gyakran alulkezelik, annak ellenére, hogy számos farmakológiai terápiát írnak fel.7
A fájdalomkezelés gyakori megközelítéseként a polifarmáciát javasolták, ami valószínűleg annak köszönhető, hogy a túl óvatos felírók több gyógyszer nagyon alacsony dózisát alkalmazzák a kevesebb szer gondos titrálása és optimalizálása helyett.7 A polifarmácia növeli a költségeket, megnehezíti a szerek hatékonyságának megértését, terápiás duplikációkat hoz létre, és növeli a gyógyszer-gyógyszer interakciók és mellékhatások inherens kockázatát. A cirrózisban jelentkező fájdalomcsillapítás a farmakoterápia összetett területét jelenti a megváltozott májpatofiziológia egyedi megfontolásaival és a megfelelő fájdalomcsillapítás és a jelentős potenciális mellékhatások elkerülése közötti finom egyensúly megteremtésével.7
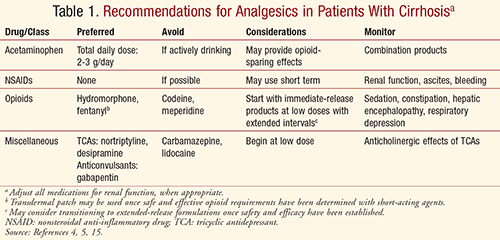
Acetaminofen
A közhiedelem szerint az acetaminofent májműködési zavarban szenvedő betegeknél kerülni kell, mivel túladagolás esetén jól ismert a hepatotoxicitás kockázata. Ez a kockázat közvetlenül összefügg más metabolikus útvonalak telítődésével és a glutation (GSH) raktárak kimerülésével.5 Az acetaminofen körülbelül 5%-a a CYP450 enzimek (túlnyomórészt a 2E1, valamint az 1A3 és 3A4) által metabolizálódik a reaktív metabolit N-acetil-p-benzokinon-iminné (NAPQI). GSH jelenlétében a NAPQI konjugálódik és kiválasztódik vesén keresztül. Ha a GSH nem áll rendelkezésre, a NAPQI felhalmozódik, és hepatocita-nekrózist és apoptózist okoz.
Az alkoholistáknál a krónikus alkoholfogyasztás miatt CYP2E1-indukció alakulhat ki, és az alultápláltság miatt csökkent GSH-szintjük van. Az ilyen fiziológiai változások miatt ezeknél a betegeknél fokozottan fennállhat az acetaminofen által kiváltott májkárosodás kockázata. Következésképpen aggodalomra ad okot, hogy minden cirrózisos betegnél alacsonyabb a GSH-szint és megnő a hepatotoxicitás kockázata az acetaminofen hatására. Bár cirrózisos betegeknél hosszabb felezési időt dokumentáltak, nem állnak rendelkezésre prospektív, hosszú távú vizsgálatok a paracetamol biztonságosságának értékelésére. Egyes tanulmányok szerint a májkárosodás megfelelő adagolás mellett ritka, és a paracetamol stabil krónikus májbetegségben 4 g/nap mennyiségig jól tolerálható, és nincs bizonyíték a megnövekedett CYP-aktivitásra vagy kritikusan kimerült GSH-raktárakra.5,9,10
A szakértői vélemények alapján 2-3 g napi teljes paracetamol-dózis ajánlott mind rövid-, mind hosszú távú használatra cirrózisos betegeknél, akik nem fogyasztanak aktívan alkoholt.4,5 A közhiedelemmel ellentétben a paracetamolt májműködési zavarok esetén előnyben részesítik, ha a napi összadagoláson belül tartják, de aktívan alkoholt fogyasztó betegeknél kerülni kell.4,11,12 Az intravénás paracetamol ellenjavallt súlyos májkárosodás és súlyos aktív májbetegség esetén.13
Nonszteroid gyulladáscsökkentők (NSAID-ok)
Cirrózisos betegeknél a jelentős CYP-metabolizmus és fehérjekötődés miatt az NSAID-ok esetében a metabolizmus és a biológiai hasznosulás megváltozása várható.5 A cirrózisos betegek esetében azonban az aggodalom elsősorban az NSAID-ok élettani hatásaira vonatkozik. Ezek a gyógyszerek gátolják a prosztaglandinszintézist, ami a vese véráramlásának és glomeruláris szűrési sebességének (GFR) csökkenéséhez, valamint a vese nátrium- és vízkiválasztásának károsodásához vezet, ami súlyosbíthatja az ascitist és növelheti a hepatorenalis szindróma kockázatát cirrózisos betegeknél.4 Az NSAID-ok közismerten gyomor-bélrendszeri irritációt, fekélyt és perforációt okoznak, és a vérlemezkék tromboxán A2-termelésének gátlása miatt növelik a betegek általános vérzésveszélyét.4,5,5 A trombocitopénia, az alvadási faktorok csökkent szintézise és a portális hipertóniához társuló nyelőcső varixok miatt a cirrózisos betegeknél nagyobb lehet a vérzés kockázata, ami életveszélyes lehet.4 Ezen okok miatt cirrózisban kerülni kell az NSAID-okat.
Opioidok
Az opioidok a leggyakoribb gyógyszercsoport fájdalomcsillapításra, különösen a mérsékelt és súlyos fájdalom vagy az acetaminofen és az NSAID-ok által nem csillapított fájdalom esetén. Az opioidok hozzájárulhatnak a cirrózis jelentős szövődményeihez, beleértve az encephalopathia előidézését, ami óvatosságot indokol az alkalmazásukkal kapcsolatban.5 Ésszerű szem előtt tartani, hogy az opioidok hatása naloxonnal visszafordítható, míg a kezeletlen vagy alulkezelt fájdalom szövődményei jelentősek lehetnek.14 Az opioidokra szükség lehet, miután a megfelelő nem farmakológiai és nem opioid kezelések nem hoztak megfelelő eredményeket.7
A morfium kivételével az oxidáció az opioidok fő metabolikus útvonala (gyakran CYP enzimeken keresztül), és úgy vélik, hogy a májműködési zavarok befolyásolják.4,15 Májbetegségben az oxidáció csökken, ami csökkent gyógyszer-clearance-hoz és/vagy megnövekedett orális biológiai hozzáférhetőséghez vezet a csökkent first-pass metabolizmus mellett. Míg a glükuronidációról úgy vélik, hogy enyhe és közepes mértékű májműködési zavarok kevésbé befolyásolják, súlyos betegség esetén jelentős lehet.4 Ezeket a megfontolásokat szem előtt tartva, bizonyos opioidok biztonságosnak és hatékonynak tekinthetők, és a NSAID-okkal szemben előnyben részesíthetők a mérsékelt és súlyos fájdalomcsillapításban, csökkentett dózisok és hosszabb időközök alkalmazásával. A homályos ajánlások miatt azonban a döntést gyakran a kezelőorvos klinikai megítélésére bízzák.15 A hosszú hatású szerek csak a rövid hatású szerek biztonságos és hatékony adagolásának meghatározása után jöhetnek szóba.5
Tramadol: A tramadol több mint 80%-ban májmetabolizmuson megy keresztül.4 Bár a cirrózisos betegeknél a csökkent biotranszformáció miatt kevesebb fájdalomcsillapítást vártak tőle, klinikai vizsgálatokban ezt nem tapasztalták.4 Egy vizsgálatban 20 rosszindulatú májbetegnél jelentős különbséget észleltek a csúcskoncentrációban (Cmax) és a csúcsidőben (Tmax), a felére csökkent clearance-ben és a kontroll háromszorosát elérő eliminációs felezési felezési időben, 10 egészséges kontrollhoz képest.16 A szerzők az adagolási intervallum meghosszabbítását javasolják, a 12 óránként 50 mg tramadolt biztonságosnak és hatásosnak tartják. Mások májműködési zavarok esetén 25 mg-ot javasoltak 8 óránként.5 A gyógyszerinformációs források, mint például a Lexicomp, cirrózisos betegek számára 50 mg-ot javasolnak 12 óránként, és kijelentik, hogy az elnyújtott hatóanyag-leadású készítmény nem alkalmazható súlyos (Child-Pugh C osztályú) májműködési zavarban szenvedő betegeknél.17
A tramadol a szerotonin-visszavétel részleges gátlása és a perifériás fájdalompályákon kifejtett aktivitása miatt előnyös lehet a kezelhetetlen fájdalomban.5 Óvatosan kell alkalmazni a tramadolt a görcsrohamokkal küzdő betegeknél és más szerotonerg gyógyszerekkel kombinálva, a görcsküszöb csökkentő hatása, illetve a szerotonin-szindróma lehetséges kialakulása miatt. A tramadol adagját és gyakoriságát a vesefunkciónak megfelelően is csökkenteni kell.17
Hidrokodon és oxikodon: A hidrokodon és az oxikodon a CYP2D6 és 3A4 függvényében metabolizálódik erősebb metabolitjaikká, hidromorfonná, illetve oximorfonná.5 Ezeknek a gyógyszereknek a fájdalomcsillapító hatása májműködési zavarban szenvedő betegeknél kevésbé erős lehet az aktív metabolitokká való csökkent átalakulás miatt, míg a csökkent clearance és a meghosszabbodott felezési idő több nem kívánt hatást okozhat.4,5 A terápiát alacsonyabb adagokkal és hosszabb időközökkel ajánlott kezdeni, megfelelő időt hagyva az adagok között a felhalmozódás elkerülése érdekében, és a beteg válaszától függően titrálva. Óvatosan kell eljárni a paracetamol kombinált készítményekkel (pl. Vicodin, Percocet), biztosítva, hogy a teljes napi paracetamol adag minden forrásból az ajánlott 2-3 g/nap határon belül maradjon.5
Morfin: A morfint az első passzos metabolizmus során nagy májkivonatúnak tekintik, így egészséges betegeknél az orális adagolást követően csak 30-40%-ban biohasznosítható.4,5 A morfint a máj metabolizálja morfin-6-glükuroniddá (aktív metabolit) és morfin-3-glükuroniddá (inaktív metabolit, potenciális neurotoxikus hatással), amelyek aztán renálisan kiürülnek. A cirrózisos betegeknél csökkent first-pass metabolizmus miatt a morfium valószínűleg jobban biohasznosítható, és alacsonyabb orális adagok javasoltak.4,5,15 A vizsgálatok következetesen csökkent clearance-t és meghosszabbodott felezési időt mutattak ki a morfiumra cirrózisos betegeknél. A gyógyszer felhalmozódásának elkerülése érdekében javasolt az adagolási intervallum akár kétszeresére növelése, mind az intravénás, mind a szájon át történő adagolás esetén.5 A morfint veseelégtelenségben, beleértve a hepatorenális szindrómát is, kerülni kell a metabolitjainak jelentős felhalmozódása és a neurotoxicitás kockázata miatt.4
Hidromorfon: Egyes vizsgálatok szerint a Cmax akár négyszeresére is megnövekedett a hidromorfon egyszeri, azonnali felszabadulású adagját követően mérsékelt májbetegségben szenvedő betegeknél, a májműködési zavarok és a magas májkivonat miatt csökkent first-pass metabolizmus miatt.4 Ajánlott alacsonyabb adagokkal kezdeni, de hasonló adagolási intervallumot fenntartani.4,5 A hidromorfon farmakokinetikáját súlyos májbetegségben szenvedő betegeknél nem vizsgálták. Úgy tűnik, hogy a hidromorfon clearance-ját viszonylag kevéssé befolyásolja, különösen a veseműködési zavar. Ugyanakkor javasolták, hogy a hidromorfont ne alkalmazzák hepatorenális szindróma esetén a neuroexcitáló metabolitja, a hidromorfon-3-glükuronid felhalmozódásának megfigyelt kockázata miatt.4
Fentanil: Bár a fentanil erősen fehérjéhez kötődik, úgy gondolják, hogy a cirrózis nem befolyásolja.4,5,15 A fentanilt jobban tolerálhatják a cirrózisos betegek, mivel nincsenek toxikus metabolitjai.4 Azonban a fentanil nem biztos, hogy a legmegfelelőbb szer a nagyon nagy hatékonysága és más klinikai forgatókönyvek (pl., akut fájdalom, ambuláns kezelés és az orális adagolás szükségessége).15
A transzdermális fentanil tapaszok használatát egyes szerzők első vonalbeli lehetőségként ajánlják a kezelhetetlen fájdalom kezelésére, de ez ellentmondásos, mivel a cirrózisos betegeknél a tapaszok használatakor a Cmax-koncentráció és a görbe alatti terület (AUC) 35%-kal, illetve 73%-kal magasabbnak bizonyult.4,5,18 Fontos megjegyezni, hogy a fentanil tapasz alkalmazását csak akkor szabad megfontolni, ha az opioidszükségletet rövid hatású opioidok titrálásával határozták meg.15 Enyhe és közepes mértékű májkárosodás esetén a szokásos adag 50%-ánál javasolt kezdeni, súlyos májkárosodás esetén pedig kerülni kell a használatát.18 A fentanilt jó választásnak tartják veseelégtelenségben, és hepatorenális szindróma esetén megfontolandó az intravénás adagolás, mivel ez az egyik olyan opioid, amelyet a vesefunkció zavarai a legkevésbé befolyásolnak.4,5
Meperidin: A jelenlegi gyakorlatban a meperidint ritkán alkalmazzák fájdalomcsillapításra a normeperidin-metabolit felhalmozódásával járó görcsrohamok kockázata miatt. Bár a normeperidin koncentrációja a csökkent CYP-aktivitás miatt ezeknél a betegeknél kisebb lehet, a csökkent fehérjekötődéshez és a késleltetett clearance-hez kapcsolódóan megnő a biológiai hozzáférhetőség, és a metabolit továbbra is felhalmozódhat.4,5,15 Cirrózisban kerülni kell a meperidint.
Kodein: Egészséges betegeknél a kodein fájdalomcsillapító hatása változó a CYP2D6 fenotípusos eltérése miatt, ami befolyásolja a morfinná való átalakulást. Májelégtelenségben szenvedő betegeknél a kodein szérumszintje a csökkent CYP-aktivitás miatt változékonyabb lehet, ami csökkent fájdalomcsillapító hatást okoz.4,5,15 A cirrózisos betegeknél végzett vizsgálatok általános hiánya miatt a kodein nem ajánlott.
Methadon: Az opioidfüggőség kezelésére gyakran alkalmazzák a metadont. A gyógyszer számos kihívást jelent a biológiai hozzáférhetőség, a fehérjekötődés és a hosszú felezési idő jelentős interindividuális változékonysága miatt.4,5,15 Túlnyomórészt a CYP3A4 metabolizálja.15 Súlyos májműködési zavarok esetén ismételt adagolás esetén felhalmozódás léphet fel, és akut alkoholbevitel hatására a plazmakoncentráció emelkedhet.4 A metadon fájdalomcsillapításra történő alkalmazását májbetegségben szenvedő betegeknél nem vizsgálták, ezért ezeknek a betegeknek nem ajánlott.4 Azonban az opioidfüggőség, például a heroinnal való visszaélés esetén a felügyelt metadon fenntartó programok előnyei meghaladhatják a lehetséges kockázatokat.5
Buprenorfin: A buprenorfin, egy parciális mu-opioid agonista orális adagolása kiterjedt first-pass metabolizmust és gyenge fájdalomcsillapító hatást eredményez, míg a szublingvális adagolás lehetővé teszi, hogy a gyógyszer körülbelül 50-55%-a elkerülje a CYP3A4 általi inaktiválást.4,15 Sajnos jelenleg nem állnak rendelkezésre buprenorfinra vonatkozó tanulmányok annak meghatározására, hogy szükséges-e dózismódosítás, vagy hogy a farmakokinetika változatlan marad-e májkárosodás esetén. Előre fennálló májműködési zavarral küzdő betegeknél buprenorfin alkalmazása során májgyulladásról számoltak be. Ezen okok miatt a buprenorfint májbetegségben szenvedő betegeknél óvatosan kell alkalmazni.
Egyéb
Lidokain: A lokális lidokain tapasz alkalmazása gyakori megfontolás a helyi fájdalomcsillapításban. Bár az orális lidokainról úgy tartják, hogy magas az első áthaladásos metabolizmussal járó hepatikus extrakciója, nem találtunk olyan irodalmat, amely a lidokain tapaszok farmakokinetikáját vagy alkalmazását tárgyalná cirrózisos betegek fájdalomcsillapítására.19 Májelégtelenségben a fájdalom diffúz lehet és/vagy aszciteszhez társulhat, ami korlátozza a helyi lidokain tapaszok indikációját.7 A bizonyítékok hiánya és a lehetséges toxicitás miatt a lidokain óvatosan alkalmazható májbetegeknél, és csak lokalizált fájdalom esetén.
Triciklikus antidepresszánsok (TCA-k): A TCA-k régóta a neuropátiás fájdalom terápiájának fő támaszai.5 A TCA-k első áthaladásos metabolizmuson és vesekiválasztáson mennek keresztül. Ezek a szerek jól ismertek antikolinerg hatásukról, amelyre a cirrózisos betegek érzékenyebbek lehetnek. A székrekedés jelentős aggodalomra ad okot, ami ezeknél a betegeknél hepatikus enkefalopátiát idézhet elő. Ezeket a gyógyszereket óvatosan és csak szükség esetén szabad alkalmazni. Ha használják, a nortriptilin és a desipramin előnyösebb lehet az alacsonyabb hatáserősség és a kisebb szedáció, tachikardia és ortosztatikus hipotenzió miatt. Májbetegségben alacsony dózissal ajánlott kezdeni, és a betegre adott válasz alapján lassan titrálni.4
Az antikonvulzívumok: Az antikonvulzívumok szintén szerepet játszanak a neuropátiás fájdalom kezelésében (a neurotranszmitterek modulációján keresztül), de ezek a gyógyszerek általában a májban metabolizálódnak és renálisan ürülnek.5 Cirrózisos betegeknél alacsonyabb dózisokra és hosszabb intervallumokra lehet szükség. A karbamazepin hepatotoxicitással jár, ezért májműködési zavarban szenvedő betegeknél kerülendő. A gabapentin az előnyben részesített szer, mivel nem metabolizálódik hepatikusan és nem kötődik fehérjéhez, de a vesefunkciónak megfelelően kell beállítani.4
Összefoglalás és ajánlások
Minden beteg esetében a fájdalomcsillapítást az előnyök és a kockázatok alapján kell egyénre szabni, a fájdalomcsillapítás és a mellékhatások szoros figyelemmel kísérésével. A fájdalomkezelésnek a farmakológiai, viselkedési, pszichológiai és fizikai beavatkozások multidiszciplináris megközelítését kell magában foglalnia a legjobb eredmények elérése és az életminőség biztonságos és hatékony optimalizálása érdekében. A kezelőorvosoknak mindig szem előtt kell tartaniuk a gyógyszer okozta májkárosodás fokozott lehetőségét a már meglévő májbetegségben szenvedő betegeknél, beleértve a cirrózist is.5 A különböző fájdalomcsillapító gyógyszerek farmakokinetikai és mellékhatásprofilját szem előtt tartva a kezelőorvosoknak figyelembe kell venniük az 1. TÁBLÁZATban összefoglalt ajánlásokat a cirrózisos betegek biztonságos és megfelelő fájdalomcsillapításának elérése érdekében.