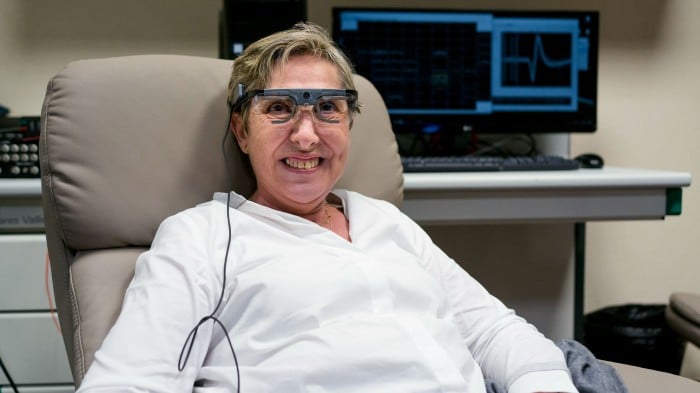
Damit konnte Gómez Deckenleuchten, Buchstaben, auf Papier gedruckte Grundformen und Menschen erkennen. Sie spielte sogar ein einfaches Pac-Man-ähnliches Computerspiel, das direkt in ihr Gehirn geleitet wurde. Für die Dauer des Experiments wurde Gómez vier Tage pro Woche von ihrem sehenden Ehemann in ein Labor gebracht und an das System angeschlossen.
Gómez‘ erster Moment des Sehens Ende 2018 war der Höhepunkt jahrzehntelanger Forschung von Eduardo Fernandez, dem Leiter der Abteilung für Neuroengineering an der Universität Miguel Hernandez in Elche, Spanien. Sein Ziel: Möglichst vielen der weltweit 36 Millionen blinden Menschen das Augenlicht wiedergeben. Fernandez‘ Ansatz ist besonders spannend, weil er das Auge und die optischen Nerven umgeht.
Viele frühere Forschungen versuchten, das Sehvermögen durch die Schaffung eines künstlichen Auges oder einer künstlichen Netzhaut wiederherzustellen. Das hat funktioniert, aber die große Mehrheit der blinden Menschen, wie Gómez, hat eine Schädigung des Nervensystems, das die Netzhaut mit dem hinteren Teil des Gehirns verbindet. Ein künstliches Auge kann ihre Erblindung nicht beheben. Aus diesem Grund hat das Unternehmen Second Sight, das 2011 in Europa und 2013 in den USA die Zulassung für den Verkauf einer künstlichen Netzhaut für die seltene Krankheit Retinitis pigmentosa erhalten hat, 2015 seine seit zwei Jahrzehnten andauernde Arbeit von der Netzhaut auf den Kortex verlagert. (Second Sight gibt an, dass etwas mehr als 350 Menschen sein Argus II-Netzhautimplantat verwenden.)
Bei einem kürzlichen Besuch im palmenreichen Elche sagte mir Fernandez, dass die Fortschritte in der Implantattechnologie und ein besseres Verständnis des menschlichen Sehsystems ihm die Zuversicht gegeben haben, direkt zum Gehirn zu gehen. „Die Informationen im Nervensystem sind die gleichen wie in einem elektrischen Gerät“, sagt er
Die Wiederherstellung des Sehvermögens durch die direkte Übertragung von Signalen an das Gehirn ist ein ehrgeiziges Unterfangen. Aber die zugrundeliegenden Prinzipien werden schon seit Jahrzehnten in der Humanmedizin für elektronische Implantate verwendet. „Zurzeit“, so Fernandez, „gibt es viele elektrische Geräte, die mit dem menschlichen Körper interagieren. Eines davon ist der Herzschrittmacher. Und im sensorischen System haben wir das Cochlea-Implantat.“

Das letztgenannte Gerät ist die hörende Version der Prothese, die Fernandez für Gómez gebaut hat: ein externes Mikrofon und Verarbeitungssystem, das ein digitales Signal an ein Implantat im Innenohr überträgt. Die Elektroden des Implantats senden Stromimpulse an nahe gelegene Nerven, die das Gehirn als Klang interpretiert. Das Cochlea-Implantat, das 1961 zum ersten Mal einem Patienten eingesetzt wurde, ermöglicht es mehr als einer halben Million Menschen auf der ganzen Welt, Gespräche als normalen Teil des täglichen Lebens zu führen.
„Berna war unsere erste Patientin, aber in den nächsten Jahren werden wir fünf weiteren Blinden ein Implantat einsetzen“, sagt Fernandez, der Gómez beim Vornamen nennt. „Wir hatten ähnliche Experimente an Tieren durchgeführt, aber eine Katze oder ein Affe kann nicht erklären, was er sieht.“
Berna konnte es.
Ihr Experiment erforderte Mut. Es erforderte eine Gehirnoperation an einem ansonsten gesunden Körper – immer ein riskantes Verfahren – um das Implantat einzusetzen. Und ein weiteres Mal, um es sechs Monate später wieder zu entfernen, da die Prothese nicht für eine längerfristige Verwendung zugelassen ist.
Anfälle und Phosphene
Ich höre Gómez, bevor ich sie sehe. Sie hat die Stimme einer Frau, die etwa ein Jahrzehnt jünger ist als ihr Alter. Ihre Worte sind bedächtig, ihre Kadenz ist perfekt, und ihr Tonfall ist warm, selbstbewusst und beständig.
Als ich sie schließlich im Labor sehe, stelle ich fest, dass Gómez den Grundriss des Raums so gut kennt, dass sie kaum Hilfe braucht, um sich in dem kleinen Flur und den dazugehörigen Räumen zurechtzufinden. Als ich zu ihr hinübergehe, um sie zu begrüßen, zeigt Gómez‘ Gesicht zunächst in die falsche Richtung, bis ich „Hallo“ sage. Als ich ihr die Hand geben will, führt ihr Mann ihre Hand in meine.
Gómez ist wegen einer MRT-Untersuchung des Gehirns hier, um zu sehen, wie es ein halbes Jahr nach der Entfernung ihres Implantats aussieht (es sieht gut aus). Sie ist auch hier, um einen potenziellen zweiten Patienten zu treffen, der in der Stadt ist und während meines Besuchs im Zimmer war. Als Fernandez erklärt, wie das Implantat mit dem Schädel verbunden wird, unterbricht Gómez das Gespräch, beugt sich nach vorne und legt die Hand des Interessenten auf ihren Hinterkopf, wo sich früher eine Metallöffnung befand. Heute ist von dem Port praktisch nichts mehr zu sehen. Die Implantation verlief so ereignislos, sagt sie, dass sie gleich am nächsten Tag ins Labor kam, um sich anschließen zu lassen und mit den Experimenten zu beginnen. Seitdem hatte sie keine Probleme oder Schmerzen mehr.
Gómez hatte Glück. Die lange Geschichte der Experimente, die zu ihrem erfolgreichen Implantat führten, hat eine bewegte Vergangenheit. Im Jahr 1929 entdeckte ein deutscher Neurologe namens Otfrid Foerster, dass er einen weißen Punkt in der Vision eines Patienten hervorrufen konnte, wenn er während einer Operation eine Elektrode in die Sehrinde des Gehirns steckte. Er bezeichnete das Phänomen als Phosphene. Seitdem haben Wissenschaftler und Science-Fiction-Autoren das Potenzial einer visuellen Prothese zwischen Kamera, Computer und Gehirn erahnt. Einige Forscher haben sogar rudimentäre Systeme gebaut.
Anfang der 2000er Jahre wurde das Hypothetische zur Realität, als ein exzentrischer biomedizinischer Forscher namens William Dobelle eine solche Prothese in den Kopf eines Versuchspatienten einbaute.
Im Jahr 2002 erinnerte sich der Schriftsteller Steven Kotler mit Schrecken daran, wie Dobelle die Elektrizität aufdrehte und ein Patient in einem Krampfanfall zu Boden fiel. Die Ursache war eine zu starke Stimulation mit zu viel Strom – etwas, das, wie sich herausstellte, Gehirne nicht mögen. Dobelles Patienten hatten auch Probleme mit Infektionen. Dennoch vermarktete Dobelle sein sperriges Gerät als nahezu alltagstauglich, zusammen mit einem Werbevideo, das einen blinden Mann zeigt, der langsam und unsicher auf einem geschlossenen Parkplatz fährt. Als Dobelle 2004 starb, starb auch seine Prothese.
Im Gegensatz zu Dobelle, der eine Heilung für Blinde verkündete, sagt Fernandez fast ständig Dinge wie: „Ich möchte mir keine Hoffnungen machen“ und „Wir hoffen, dass wir ein System haben werden, das die Menschen benutzen können, aber im Moment führen wir nur erste Experimente durch.“
Aber Gómez hat tatsächlich gesehen.
Nagelbett
Wenn auch die Grundidee hinter Gómez‘ Sicht – eine Kamera an ein Videokabel ins Gehirn anzuschließen – einfach ist, so sind es die Details nicht. Fernandez und sein Team mussten zunächst den Teil mit der Kamera herausfinden. Welche Art von Signal erzeugt die menschliche Netzhaut? Um diese Frage zu beantworten, entnimmt Fernandez menschlichen Netzhäuten von kürzlich verstorbenen Personen, schließt sie an Elektroden an, setzt sie dem Licht aus und misst, was auf die Elektroden trifft. (Sein Labor hat eine enge Beziehung zum örtlichen Krankenhaus, das manchmal mitten in der Nacht anruft, wenn ein Organspender stirbt. Eine menschliche Netzhaut kann nur etwa sieben Stunden lang am Leben gehalten werden.) Sein Team nutzt auch maschinelles Lernen, um die elektrische Leistung der Netzhaut mit einfachen visuellen Eingaben abzugleichen, was ihnen hilft, Software zu schreiben, die den Prozess automatisch nachahmt.
Der nächste Schritt besteht darin, dieses Signal an das Gehirn weiterzuleiten. In der Prothese, die Fernandez für Gómez gebaut hat, verläuft eine Kabelverbindung zu einem gewöhnlichen Neuroimplantat, dem so genannten Utah-Array, das nur etwas kleiner ist als die erhabene Spitze am positiven Ende einer AAA-Batterie. Aus dem Implantat ragen 100 winzige Elektrodenspitzen heraus, jede etwa einen Millimeter groß – zusammen sehen sie wie ein Miniatur-Nagelbett aus. Jede Elektrode kann einen Strom an ein bis vier Neuronen abgeben. Wenn das Implantat eingesetzt wird, durchbohren die Elektroden die Oberfläche des Gehirns; wenn es entfernt wird, bilden sich 100 winzige Blutstropfen in den Löchern.

Fernandez musste eine Elektrode nach der anderen kalibrieren und ihr immer stärkere Ströme schicken, bis Gómez merkte, wann und wo sie ein Phosphen sah. Es dauerte mehr als einen Monat, bis alle 100 Elektroden eingestellt waren.
„Der Vorteil unseres Ansatzes ist, dass die Elektroden des Arrays in das Gehirn hineinragen und nahe an den Neuronen sitzen“, sagt Fernandez. Dadurch kann das Implantat das Sehvermögen mit einem viel geringeren elektrischen Strom als bei Dobelle erzeugen, was das Risiko von Krampfanfällen deutlich verringert.
Der große Nachteil der Prothese – und der Hauptgrund, warum Gómez ihre Prothese nicht länger als sechs Monate behalten konnte – besteht darin, dass niemand weiß, wie lange die Elektroden halten können, ohne dass das Implantat oder das Gehirn des Benutzers geschädigt wird. „Das körpereigene Immunsystem beginnt, die Elektroden abzubauen und sie mit Narbengewebe zu umgeben, wodurch das Signal schließlich schwächer wird“, sagt Fernandez. Hinzu kommt das Problem, dass sich die Elektroden biegen können, wenn sich jemand bewegt. Ausgehend von Tierversuchen und einem ersten Blick auf die von Gómez verwendete Anordnung geht er davon aus, dass die derzeitige Anordnung zwei bis drei Jahre halten könnte, vielleicht sogar bis zu zehn Jahre, bevor sie versagt. Fernandez hofft, dass sich diese Zeitspanne mit ein paar kleinen Verbesserungen auf einige Jahrzehnte verlängern lässt – eine wichtige Voraussetzung für ein medizinisches Gerät, das eine invasive Hirnoperation erfordert.
Letztendlich wird die Prothese, wie ein Cochlea-Implantat, ihr Signal und ihre Energie drahtlos durch den Schädel übertragen müssen, um die Elektroden zu erreichen. Bislang hat sein Team die Prothese für Experimente jedoch noch verkabelt gelassen, um so die größtmögliche Flexibilität zu haben, die Hardware zu aktualisieren, bevor man sich auf ein Design festlegt.
Bei einer Auflösung von 10 mal 10 Pixeln, was in etwa der maximal möglichen Auflösung entspricht, die das Implantat von Gómez wiedergeben könnte, kann man einfache Formen wie Buchstaben, einen Türrahmen oder einen Bürgersteig wahrnehmen. Aber die Konturen eines Gesichts, geschweige denn eines Menschen, sind weitaus komplizierter. Deshalb hat Fernandez sein System mit einer Bilderkennungssoftware erweitert, um eine Person in einem Raum zu identifizieren und ein Muster von Phosphenen an Gómez‘ Gehirn zu senden, das sie zu erkennen lernte.
Mit 25 mal 25 Pixeln, schreibt Fernandez in einer Folie, die er gerne präsentiert, „ist Sehen möglich“. Und weil das Utah-Array in seiner jetzigen Form so klein ist und so wenig Energie benötigt, gibt es laut Fernandez keinen technischen Grund, warum sein Team nicht vier bis sechs auf jeder Seite des Gehirns installieren könnte, um eine Sicht mit 60 x 60 Pixeln oder mehr zu ermöglichen. Dennoch weiß niemand, wie viel Input das menschliche Gehirn von solchen Geräten aufnehmen kann, ohne überfordert zu sein und das Äquivalent von Fernsehschnee anzuzeigen.
Wie es aussieht

Gómez sagte mir, dass sie das Implantat behalten hätte, wenn sie die Wahl gehabt hätte, und dass sie die erste in der Schlange sein wird, wenn eine aktualisierte Version verfügbar ist. Wenn Fernandez mit der Analyse ihres Arrays fertig ist, will Gómez es rahmen lassen und an ihre Wohnzimmerwand hängen.
Zurück in Fernandez‘ Labor, bietet er mir an, mich an ein nichtinvasives Gerät anzuschließen, das er zur Untersuchung von Patienten verwendet.
Ich sitze in demselben Ledersessel, in dem Gómez während des bahnbrechenden Experiments im letzten Jahr saß, und warte, während ein Neurologe einen Stab mit zwei Ringen an die Seite meines Kopfes hält. Das Gerät, eine so genannte Schmetterlingsspule, ist mit einer Box verbunden, die Neuronen im Gehirn mit einem starken elektromagnetischen Impuls anregt – ein Phänomen, das als transkranielle Magnetstimulation bezeichnet wird. Der erste Impuls fühlt sich an, als würde jemand meine Kopfhaut schocken. Unwillkürlich krümmen sich meine Finger in den Handflächen. „Sehen Sie, es hat funktioniert!“ sagt Fernandez und kichert. „Das war Ihr motorischer Kortex. Jetzt werden wir versuchen, Ihnen ein paar Phosphene zu geben.“
Der Neurologe setzt den Stab neu an und stellt das Gerät auf eine schnelle Serie von Impulsen ein. Diesmal spüre ich beim Abfeuern ein intensives zzp-zzp-zzp, als ob jemand die Rückseite meines Schädels als Türklopfer benutzen würde. Dann, obwohl meine Augen weit geöffnet sind, sehe ich etwas: eine helle horizontale Linie blinkt in der Mitte meines Blickfeldes auf, zusammen mit zwei schimmernden Dreiecken, die mit etwas gefüllt sind, das wie Fernsehschnee aussieht. Die Vision verschwindet so schnell, wie sie gekommen ist, und hinterlässt ein kurzes Nachleuchten.
„Das ist wie das, was Berna sehen konnte“, sagt Fernandez. Nur dass ihre „Sicht“ der Welt so lange stabil war, wie das Signal an ihr Gehirn übertragen wurde. Sie konnte auch ihren Kopf drehen und sich mit ihrer Brille im Raum umsehen. Was ich gesehen hatte, waren lediglich innere Phantome eines elektrisch erregten Gehirns. Gómez konnte zum ersten Mal seit 16 Jahren die Hand ausstrecken und die Welt berühren, die sie betrachtete.
AnmeldenJetzt abonnieren