US Pharm. 2015;40(12):HS5-HS11.
ABSTRACT: Cirrhose er en heterogen diagnose, der påvirker leverfunktionen, herunder metabolisme og clearance af medicin, men den nøjagtige effekt er fortsat uklar. Der findes misforståelser og betydelig praksisvariabilitet blandt sundhedspersonale med hensyn til analgetisk brug af smertestillende midler hos patienter med leverdysfunktion. På baggrund af begrænsede data om sikkerhed og effekt er acetaminophen det foretrukne analgetikum hos patienter med leversygdom, som ikke drikker aktivt, og det kan doseres op til 2-3 g/dag. Ikke-steroide antiinflammatoriske lægemidler (NSAID) bør undgås på grund af deres negative virkninger i form af nedsat nyrefunktion, væskeretention og øget blødningsrisiko. Opioider bør anvendes med forsigtighed og indledes med produkter med øjeblikkelig frigivelse i lave doser med forlængede intervaller og nøje overvågning. Alle smertestillende lægemidler bør titreres omhyggeligt for at opnå sikker og tilstrækkelig smertelindring hos patienter med nedsat leverfunktion.
Cirrhose er defineret som permanent leverfibrose sekundært til skade eller skade. Det er en heterogen diagnose, der resulterer i varierende grader af knudedannelse, organdysfunktion, komplikationer og betydelig morbiditet og mortalitet. Årsagerne til skrumpelever omfatter alkoholmisbrug, hepatitis B og C, kræft og ikke-alkoholisk steato-hepatitis.1 “Kronisk leversygdom og skrumpelever” som primær diagnose tegnede sig for mere end 101 000 hospitalsindlæggelser i 2010.2 I 2013 blev det rapporteret som den førende dødsårsag hos personer i alderen 25-64 år og den 12. førende dødsårsag for alle aldre, hvilket resulterede i over 36 000 dødsfald.2
Disse tal kan desværre være undervurderet på grund af diagnostiske kriteriebegrænsninger i ICD-koder (International Classification of Diseases), som ikke tager højde for cirrose-relaterede komplikationer. En undersøgelse tyder på, at leverrelaterede dødsfald kan være så meget som dobbelt så højt som det, der i øjeblikket rapporteres af CDC.3
Sundhedsplejersker er bekendt med leverens afgørende rolle i metabolismen og clearance af mange lægemidler. Cirrhose kan føre til udvikling af portohepatiske shunts, hvilket i sidste ende mindsker den first-pass-metabolisme, der finder sted med mange orale lægemidler. Nedsat albuminproduktion kan også resultere i øgede frie lægemiddelkoncentrationer af stærkt proteinbundne lægemidler. Det antages generelt, at lægemiddeleliminationen forringes, efterhånden som leverdysfunktion skrider frem, men patienter med kronisk hepatitis eller leverkræft kan i fravær af cirrose kun have en lille ændring i lægemiddelclearance.4 Det er fortsat uklart, i hvilket omfang cirrose påvirker lægemiddeldispositionen.
Mens visse lægemidler har specifikke renale justeringsparametre, er leverdosisjusteringer måske ikke umiddelbart tilgængelige. Mange undersøgelser har evalueret farmakokinetik og patienternes analgetiske serumniveauer, som ikke nødvendigvis korrelerer med patientens respons. Andre tilgængelige undersøgelser har primært fokuseret på hepatitis C, selv om mange patienter udvikler leverdysfunktion og cirrose sekundært af andre årsager. Child-Pugh-scorerne, som ikke almindeligvis beregnes i praksis, styrer ofte doseringen, men de resulterende anbefalinger kan stadig være vage uden klare retningslinjer for den kliniske anvendelse. Håndteringen af patienterne kan kompliceres yderligere af samtidig nedsat nyrefunktion, hvad enten den er relateret til leversygdom, såsom hepatorenalt syndrom, eller en anden årsag.4
Analgetisk brug ved cirrose
Smertebehandling er ofte en udfordring for sundhedspersonalet, men det er fortsat en meget vigtig komponent i at yde patientpleje af høj kvalitet og er en almindelig faktor for patienttilfredshed.5 Der er fundet en høj prævalens af smerter blandt patienter med kronisk leversygdom, rapporteret mellem 32 % og 77 %.6-8 Smerter og opioidbaserede smerteregimer har vist sig at være væsentlige prædiktorer for brugen af sundhedsydelser blandt patienter med leversygdom.8
Et retrospektivt review fandt, at 77 % af patienterne før levertransplantation (n = 108) rapporterede om kropslige smerter, hvor mere end en tredjedel angav flere steder.7 Smerterne påvirkede angiveligt arbejde, søvn, mobilitet, appetit, fornøjelse og humør. Ca. 90 % rapporterede, at de modtog farmakologisk behandling, men kun 33 % oplevede lindring. Korttidsvirkende opioider blev ordineret i 40 % af tilfældene, og 32 % af patienterne rapporterede, at de fik ordineret fem eller flere smertestillende midler. Forfatterne konkluderede, at smerter hos patienter med leverlidelse i slutstadiet (ESLD) er meget almindelige, påvirker funktionaliteten og er ofte underbehandlet på trods af de mange farmakologiske behandlinger, der er ordineret.7
Polyfarmaci blev foreslået som en almindelig tilgang til smertebehandling, muligvis på grund af overforsigtige ordinerende læger, der anvender meget lave doser af flere lægemidler i stedet for omhyggelig titrering og optimering af færre midler.7 Polyfarmaci øger omkostningerne, komplicerer forståelsen af midlernes effektivitet, skaber terapeutiske overlapninger og øger den iboende risiko for interaktioner mellem lægemidler og bivirkninger. Smertebehandling ved cirrose udgør et komplekst område inden for farmakoterapi med unikke overvejelser om ændret leverpatofysiologi og en fin balance mellem tilstrækkelig smertelindring og undgåelse af betydelige potentielle bivirkninger.7
Acetaminophen
Det er almindeligt antaget, at acetaminophen bør undgås hos patienter med leverdysfunktion på grund af dets velkendte hepatotoksicitetsrisiko ved overdosering. Denne risiko er direkte relateret til mætning af andre metaboliske veje og udtømning af glutathion (GSH)-lagre.5 Ca. 5 % af acetaminophen metaboliseres af CYP450-enzymer (overvejende 2E1 samt 1A3 og 3A4) til den reaktive metabolit N-acetyl-p-benzoquinonimin (NAPQI). I tilstedeværelse af GSH konjugeres NAPQI og udskilles renalt. Når GSH ikke er tilgængeligt, ophobes NAPQI og forårsager hepatocytnekrose og apoptose.
Alkoholikere kan udvikle en CYP2E1-induktion på grund af kronisk alkoholindtagelse og have nedsatte GSH-niveauer på grund af underernæring. Sådanne fysiologiske ændringer kan medføre, at disse patienter har en øget risiko for acetaminofen-induceret leverskade. Der er derfor bekymring for, at alle cirrosepatienter har lavere GSH-niveauer og en øget risiko for hepatotoksicitet med acetaminophen. Selv om der er dokumenteret en forlænget halveringstid hos cirrosepatienter, findes der ingen prospektive langtidsundersøgelser til vurdering af sikkerheden ved acetaminophen. Nogle undersøgelser tyder på, at leverskader er sjældne ved passende dosering, og at acetaminophen tolereres godt ved stabil kronisk leversygdom op til 4 g/dag uden tegn på øget CYP-aktivitet eller kritisk udtømte GSH-depoter.5,9,10
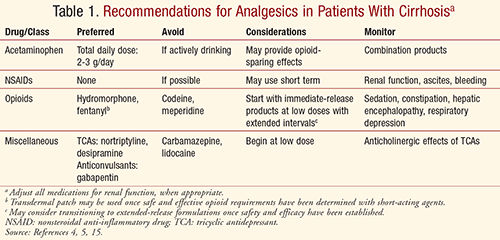
Totale daglige acetaminophen-doser på 2 til 3 g anbefales til både kort- og langtidsbrug hos cirrhotiske patienter, som ikke drikker aktivt alkohol, baseret på ekspertudtalelser.4,5 I modsætning til den almindelige opfattelse anses acetaminophen for at være det foretrukne middel ved leverdysfunktion, når det holdes inden for en samlet daglig doseringsgrænse, men bør undgås hos patienter, der aktivt drikker alkohol.4,11,12 IV acetaminophen er kontraindiceret ved svær leverinsufficiens og svær aktiv leversygdom.13
Nonsteroide antiinflammatoriske lægemidler (NSAID’er)
I cirrhotiske patienter forventes ændringer i metabolisme og biotilgængelighed med NSAID’er på grund af den betydelige CYP-metabolisme og proteinbinding.5 Imidlertid vedrører bekymringen for cirrosepatienter primært de fysiologiske virkninger af NSAID’er. Disse lægemidler hæmmer prostaglandinsyntesen, hvilket fører til nedsat nyreblodgennemstrømning og glomerulær filtrationshastighed (GFR) og nedsat renal natrium- og vandudskillelse, hvilket kan forværre ascites og øge risikoen for hepatorenalt syndrom hos cirrosepatienter.4 NSAID’er er kendt for at forårsage gastrointestinal irritation, ulceration og perforation og øge patienternes samlede risiko for blødning på grund af hæmning af tromboksan A2-produktionen i blodpladerne.4,5 På grund af trombocytopeni, nedsat syntese af koagulationsfaktorer og esophageale varicer i forbindelse med portal hypertension kan cirrosepatienter have en højere risiko for blødning, som kan være livstruende.4 Af disse grunde bør NSAID’er undgås ved cirrose.
Opioider
Opioider er den mest almindelige lægemiddelklasse til analgesi, især moderate og svære smerter eller smerter, der ikke lindres af paracetaminophen og NSAID’er. Opioider kan bidrage til betydelige komplikationer ved cirrose, herunder udfældning af encephalopati, hvilket berettiger til forsigtighed med brugen af dem.5 Det er rimeligt at huske på, at opioidvirkninger kan vendes med naloxon, mens komplikationer ved ubehandlede eller underbehandlede smerter kan være betydelige.14 Opioider kan være nødvendige, efter at passende ikkefarmakologiske og ikke-opioide behandlinger har givet utilstrækkelige resultater.7
Oxidation er den vigtigste metaboliske vej for opioider (ofte via CYP-enzymer), undtagen for morfin, og anses for at blive påvirket af leverdysfunktion.4,15 Oxidation er reduceret ved leversygdom, hvilket fører til nedsat lægemiddelclearance og/eller øget oral biotilgængelighed med reduceret first-pass-metabolisme. Mens glucuronidering menes at være mindre påvirket af let til moderat leverdysfunktion, kan den være betydelig ved alvorlig sygdom.4 Med disse overvejelser in mente anses visse opioider for at være sikre, effektive og at foretrække frem for NSAID’er til moderat til alvorlig smertebehandling ved brug af reducerede doser og forlængede intervaller. På grund af vage anbefalinger overlades beslutningen dog ofte til behandlerens kliniske vurdering.15 Langtidsvirkende midler kan kun overvejes, efter at sikker og effektiv dosering af korttidsvirkende midler er fastlagt.5
Tramadol: Tramadol gennemgår mere end 80 % hepatisk metabolisme.4 Selv om det har været forventet at give mindre smertelindring hos cirrotiske patienter på grund af nedsat biotransformation, er dette ikke blevet set i kliniske undersøgelser.4 En undersøgelse bemærkede en signifikant forskel i spidskoncentration (Cmax) og spidstid (Tmax), clearance reduceret med halvdelen og en eliminationshalveringstid på op til 3 gange kontrol med 20 patienter med levermaligniteter sammenlignet med 10 raske kontroller.16 Forfatterne anbefaler at forlænge doseringsintervallet og anser tramadol 50 mg hver 12. time for sikkert og effektivt. Andre har anbefalet 25 mg hver 8. time ved leverdysfunktion.5 Lægemiddelinformationskilder, såsom Lexicomp, anbefaler 50 mg hver 12. time til cirrosepatienter og angiver, at produktet med forlænget frigivelse ikke bør anvendes til patienter med alvorlig (Child-Pugh-klasse C) leverdysfunktion.17
Tramadol kan være gavnligt ved vedvarende smerter på grund af dets delvise hæmning af serotonin-genoptagelse og aktivitet på perifere smerteveje.5 Forsigtighed bør udvises med tramadol hos patienter med anfaldshistorie og i kombination med andre serotonerge lægemidler, på grund af dets virkning med at sænke henholdsvis krampetærsklen og mulig udvikling af serotoninsyndrom. Dosis og hyppighed af tramadol bør også reduceres i henhold til nyrefunktionen.17
Hydrocodon og Oxycodon: Hydrocodon og oxycodon er afhængige af CYP2D6 og 3A4 til metabolisme til deres mere potente metabolitter, henholdsvis hydromorphone og oxymorphone.5 Den analgetiske virkning af disse lægemidler kan være mindre potent hos patienter med leverdysfunktion på grund af nedsat konvertering til deres aktive metabolitter, mens nedsat clearance og forlænget halveringstid kan give flere uønskede virkninger.4,5 Det anbefales at indlede behandlingen med lavere doser og forlængede intervaller, idet der gives tilstrækkelig tid mellem doserne for at undgå akkumulering og titreres i henhold til patientens respons. Der bør udvises forsigtighed med acetaminophen-kombinationsprodukter (f.eks. Vicodin, Percocet), idet man sikrer, at den samlede daglige acetaminophen-dosis ligger inden for den anbefalede grænse på 2 til 3 g/dag fra alle kilder.5
Morfin: Morfin anses for at have en høj hepatisk ekstraktion ved first-pass-metabolisme, hvilket gør det kun 30-40 % biotilgængeligt efter oral dosering hos raske patienter.4,5 Morfin metaboliseres af leveren til morfin-6-glucuronid (aktiv metabolit) og morfin-3-glucuronid (inaktiv metabolit med potentielle neurotoksiske virkninger), som derefter cleares renalt. Med reduceret first-pass-metabolisme hos cirrhotiske patienter er morfin sandsynligvis mere biotilgængeligt, og lavere orale doser anbefales.4,5,15 Undersøgelser har konsekvent vist nedsat clearance og en forlænget halveringstid for morfin hos cirrhotiske patienter. Det er blevet anbefalet at øge doseringsintervallet med så meget som det dobbelte for at undgå lægemiddelakkumulering, både ved IV- og oral administration.5 Morfin bør undgås ved nedsat nyrefunktion, herunder hepatorenalt syndrom, på grund af betydelig akkumulering af dets metabolitter og risiko for neurotoksicitet.4
Hydromorphone: Nogle undersøgelser rapporterer en Cmax øget op til fire gange efter en enkelt dosis hydromorphone med øjeblikkelig frigivelse hos patienter med moderat leversygdom på grund af nedsat first-pass-metabolisme ved leverdysfunktion og høj hepatisk ekstraktion.4 Det er blevet anbefalet at starte med lavere doser, men at opretholde et lignende doseringsinterval.4,5 Farmakokinetikken for hydromorphone er ikke blevet undersøgt hos patienter med svær leversygdom. Hydromorfons clearance synes at være relativt upåvirket, især ved nyrefunktionsforstyrrelser. Det er dog blevet foreslået, at hydromorphone ikke anvendes ved hepatorenalt syndrom på grund af den observerede risiko for akkumulering af dets neuroexcitatoriske metabolit, hydromorphone-3-glucuronid.4
Fentanyl: Selv om fentanyl er stærkt proteinbundet, menes det at være upåvirket af cirrose.4,5,15 Fentanyl tolereres muligvis bedre hos cirrhotiske patienter, da det ikke har nogen toksiske metabolitter.4 Fentanyl er dog muligvis ikke det mest hensigtsmæssige middel på grund af dets meget høje potens og andre kliniske scenarier (f.eks, akutte smerter, ambulant behandling og behovet for oral administration).15
Brug af transdermale fentanylplastre er af nogle forfattere blevet anbefalet som en førstevalgsmulighed til vedvarende smerter, men dette er kontroversielt, da cirrosepatienter har vist sig at have forhøjede Cmax-koncentrationer og areal under kurven (AUC) ved brug af plastrene, henholdsvis 35 % og 73 %.4,5,18 Det er vigtigt at huske, at brugen af et fentanylplaster først bør overvejes, når opioidbehovet er blevet fastlagt ved titrering af korttidsvirkende opioider.15 Det anbefales at indlede med 50 % af den sædvanlige dosis ved let til moderat leverforringelse og undgå brug ved svær leverforringelse.18 Fentanyl anses for at være en god mulighed ved nedsat nyrefunktion, og IV-administration kan overvejes ved hepatorenalt syndrom, da det er en af de opioider, der påvirkes mindst af nyrefunktionsnedsættelse.4,5
Meperidin: I den nuværende praksis anvendes meperidin sjældent til analgesi på grund af risikoen for krampeanfald ved ophobning af dets normperidinmetabolit. Selv om normeperidin-koncentrationerne kan være mindre på grund af nedsat CYP-aktivitet hos disse patienter, er der øget biotilgængelighed relateret til nedsat proteinbinding og forsinket clearance, og metabolitten kan stadig akkumuleres.4,5,15 Meperidin bør undgås ved cirrose.
Codein: Hos raske patienter er kodeins analgetiske virkning variabel på grund af CYP2D6-fænotypisk variation, der påvirker omdannelsen til morfin. Hos patienter med leverdysfunktion kan kodeins serumniveauer være mere variable på grund af nedsat CYP-aktivitet, hvilket medfører nedsat analgetisk virkning.4,5,15 På grund af en generel mangel på undersøgelser hos cirrhotiske patienter anbefales kodein ikke.
Methadon: Til behandling af opioidafhængighed anvendes ofte metadon. Lægemidlet giver mange udfordringer med sin betydelige interindividuelle variabilitet i biotilgængelighed, proteinbinding og lange halveringstid.4,5,15 Det metaboliseres overvejende af CYP3A4.15 Akkumulering kan forekomme ved gentagen dosering ved svær leverdysfunktion, og plasmakoncentrationerne kan være forhøjede ved akut indtagelse af alkohol.4,5,15 Brugen af metadon til analgesi hos patienter med leversygdom er ikke blevet undersøgt; det anbefales derfor ikke til denne brug hos disse patienter.4 Fordelene ved overvågede metadonvedligeholdelsesprogrammer for opioidafhængighed, såsom heroinmisbrug, kan dog opveje de potentielle risici.5
Buprenorphin: Orale indgift af buprenorphin, en partiel mu-opioidagonist, resulterer i omfattende first-pass-metabolisme og dårlig analgetisk virkning, mens sublingual indgift giver mulighed for, at ca. 50 % til 55 % af lægemidlet undgår inaktivering af CYP3A4.4,15 Desværre foreligger der i øjeblikket ikke undersøgelser af buprenorphin, der kan fastslå, om der er behov for dosisjusteringer, eller om farmakokinetikken forbliver uændret ved leverforringelse. Hepatitis er blevet rapporteret ved brug af buprenorphin hos patienter med præeksisterende leverdysfunktion. Af disse grunde bør buprenorphin anvendes med forsigtighed hos patienter med leversygdom.
Diverse
Lidocain: Anvendelse af topisk lidocainplaster er en almindelig overvejelse til lokaliseret smertekontrol. Selv om oral lidocain anses for at have en høj hepatisk ekstraktion med first-pass-metabolisme, blev der ikke fundet nogen litteratur, der diskuterer farmakokinetik eller brug af lidocainplaster til smertebehandling hos cirrhotiske patienter19 . Smerter ved leverdysfunktion kan være diffuse og/eller associeret med ascites, hvilket begrænser indikationen for topiske lidocainplastre.7 På grund af manglende evidens og mulig toksicitet bør lidocain anvendes med forsigtighed hos patienter med leverdysfunktion og kun til lokaliserede smerter.
Tricykliske antidepressiva (TCA’er): TCA’er har længe været hovedhjørnestenen i behandlingen af neuropatiske smerter.5 TCA’er gennemgår first-pass-metabolisme og renal udskillelse. Disse midler er velkendte for deres antikolinergiske virkninger, som cirrhotiske patienter kan være mere modtagelige for. Obstipation er et væsentligt problem, som kan fremskynde hepatisk encephalopati hos disse patienter. Disse lægemidler bør anvendes med forsigtighed og kun om nødvendigt. Hvis de anvendes, kan nortriptylin og desipramin være at foretrække på grund af lavere potens og mindre sedation, takykardi og ortostatisk hypotension. Det anbefales at begynde med lave doser ved leversygdom og titrere langsomt baseret på patientens respons.4
Antikonvulsiva: Antikonvulsiva spiller også en rolle i behandlingen af neuropatiske smerter (via neurotransmittermodulation), men disse lægemidler metaboliseres almindeligvis af leveren og udskilles renalt.5 Lavere doser og forlængede intervaller kan være nødvendige hos cirrhotiske patienter. Carbamazepin er forbundet med hepatotoksicitet og bør undgås hos patienter med leverdysfunktion. Gabapentin er det foretrukne middel, da det ikke metaboliseres hepatisk eller er proteinbundet, men bør justeres i henhold til nyrefunktionen.4
Summarum og anbefalinger
Med alle patienter skal smertebehandling individualiseres på baggrund af fordele kontra risici med nøje overvågning af smertelindring og bivirkninger. Smertebehandling bør omfatte en tværfaglig tilgang med farmakologiske, adfærdsmæssige, psykologiske og fysiske interventioner for at opnå de bedste resultater og optimere livskvaliteten på en sikker og effektiv måde. Behandlere skal altid være opmærksomme på det øgede potentiale for lægemiddelinduceret leverskade hos patienter med præeksisterende leversygdom, herunder cirrose.5 Med de farmakokinetiske og bivirkningsprofiler for forskellige analgetiske lægemidler in mente bør behandlere overveje de anbefalinger, der er opsummeret i TABEL 1, for at opnå en sikker og tilstrækkelig smertekontrol hos cirrhotiske patienter.