- Introduktion
- Materiale og metoder
- Inklusionskriterier
- Ovariestimulering og oocytudtagning
- Politik for embryooverførsel
- Primære resultatmålinger og statistisk analyse
- Resultater
- Oocyt- og embryoparametre
- Graviditetsresultater og kumulativ levendefødselsrate (CLBR)
- Diskussion
- Slutning
- Datatilgængelighed
- Etisk erklæring
- Author Contributions
- Funding
- Interessekonflikterklæring
- Akkreditering
Introduktion
For nylig blev der udviklet et nyt system, POSEIDON-kriterierne, til at klassificere infertilitetspatienter med lav prognose, der gennemgår behandling med assisteret reproduktiv teknologi (ART) (1). Det er et nyttigt system til identifikation og klassificering af patienter med nedsat ovariereserve eller dårlig ovarierespons (POR), hvilket giver vejledning til diagnosticering og behandling af disse patienter (2). Der er blevet foreslået fire undergrupper baseret på kvantitative og kvalitative parametre, herunder alder, biomarkører for ovarie-reserve og ovarierespons. De nye kriterier har ved at indføre en mere detaljeret stratificering af POR reduceret heterogeniteten af patienter, der opfylder Bologna-kriterierne, betydeligt (3), hvilket kan differentiere patientundergrupper inden for POR-populationen, som kan identificeres og drage fordel af specifikke interventioner (4). Selv om POSEIDON-kriterierne blev etableret sammen med nogle specifikke behandlingsanbefalinger foreslået for de specifikke patientundergrupper (5), er der stadig utilstrækkelig evidens til at understøtte gyldigheden af de parametre, der anvendes i POSEIDON-kriterierne, samt vurderingen af resultatet af de forskellige undergrupper.
Men blandt de fire grupper baseret på POSEIDON-kriterierne er gruppe 1 utvivlsomt den bedste prognostiske gruppe i betragtning af deres yngre alder og normale ovariereserve, mens gruppe 4 har den dårligste prognose på grund af den fremskredne alder og den nedsatte ovariereserve. Et interessant spørgsmål er imidlertid, hvem der ville opnå et bedre graviditetsresultat, de ældre kvinder (gruppe 2) med normal ovariereserve eller de unge kvinder (gruppe 3) med nedsat ovariereserve. Den kumulative levendefødselsrate (CLBR) anses for at være et foretrukket mål for succes af IVF-behandling (6). Indtil nu har der kun været meget få rapporter om CLBR for de fire patientgrupper, der er defineret ved POSEIDON-kriterierne.
Patienternes karakteristika og prognose bør anvendes til at udvikle kliniske behandlingsstrategier. Formålet med denne undersøgelse er at karakterisere patienter med lav prognose med henblik på at lette beslutningstagningen om behandling. I denne undersøgelse blev baselinekarakteristika og resultater for patientgrupper defineret ved POSEIDON-kriterierne analyseret, og CLBR som følge af én aspireret in-vitrobefrugtning (IVF)/intracytoplasmisk sædinjektion (ICSI)-cyklus blev foreslået som den primære resultatmåling for patienter med lav prognose, der gennemgår IVF-behandling (7).
Materiale og metoder
Denne retrospektive undersøgelse omfattede 18.455 friske aspirerede IVF-cyklusser med efterfølgende frosne embryooverførsler fra januar 2014 til januar 2017 i vores center. Resultatet af levende fødsler blev fulgt op i mindst 2 år indtil januar 2019. Undersøgelsen blev godkendt af den etiske komité for den kliniske anvendelse af menneskelig assisteret reproduktionsteknologi på Northwest Women’s and Children’s Hospital (nr. 2018002). Den etiske komité godkendte denne undersøgelse undlod at indhente informeret samtykke. Al forskning blev udført i overensstemmelse med relevante retningslinjer og bestemmelser.
Inklusionskriterier
Patienterne blev kategoriseret i henhold til POSEIDON-kriterierne:
Lav prognosepatienter
Gruppe 1 (n = 879 cyklusser): Alder < 35, antralt follikelantal (AFC) ≥ 5, antal oocytter hentet ≤ 9 i den foregående cyklus;
Gruppe 2 (n = 482 cyklusser):
Gruppe 2 (n = 482 cyklusser): Alder ≥ 35, AFC≥5, tidligere antal udtagne oocytter ≤ 9 i den foregående cyklus;
Gruppe 3 (n = 858 cyklusser): Gruppe 3 (n = 858 cyklusser): Alder < 35, AFC < 5;
Gruppe 4 (n = 1.306 cyklusser): Alder ≥ 35, AFC < 5;
Patienter med ikke lav prognose
Gruppe 5 (n = 664 cyklusser): AFC ≥ 5, tidligere ovariestimulering > 9 oocytter;
Gruppe 6 (n = 13708 cyklusser):
Gruppe 6 (n = 13708 cyklusser): AFC ≥ 5, ingen tidligere ovariestimulering.
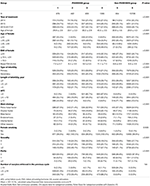
Flowdiagram og databehandlingsprocedure er anført i figur 1. Demografiske data og basale karakteristika for patienterne er præsenteret i tabel 1.
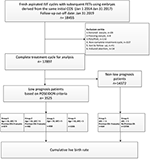
Figur 1. Flowdiagram og databehandling.
Tabel 1

Tabel 1. Demografiske data og baselinekarakteristika.
Ovariestimulering og oocytudtagning
Protokollen for ovariestimulering (OS) blev fastlagt individuelt i henhold til kvindens alder, body mass index (BMI), basalt follikelstimulerende hormon (FSH) og antral follikelantal (AFC). 94,33 % af IVF-patienterne fik rekombinante og/eller uringonadotrofiner (rFSH/hMG) i GnRH-agonistprotokol eller GnRH-antagonistprotokol efterfulgt af IVF eller ICSI. For kvinder med nedsat ovariereserve blev der anvendt den milde stimulationsprotokol eller ovariestimulering i lutealfasen eller en naturlig cyklus. Human menopausal gonadotrophin (hMG, Li Zhu, Kina) blev tilsat i protokollen for mild ægløsning eller Shanghai-protokollen i overensstemmelse med patienternes respons på stimulering. Human choriongonadotrofin (hCG) 4.000-10.000 IE eller rekombinant hCG (r-hCG, MerckSerono S.p.A.) 250μg blev administreret, når 2-3 follikler nåede en størrelse på 17 mm eller derover. 36 timer senere blev der foretaget oocytudtagning ved hjælp af transvaginal ultralydsvejledt aspiration. De ovarielle stimulationsparametre for hver gruppe er anført i tabel 2.

Tabel 2. Parametre for ovariestimulering.
Politik for embryooverførsel
Procedurerne for oocytbehandling og embryoudvikling samt systemet til scoring af embryoner er beskrevet i vores tidligere artikler (8, 9). Embryoner af grad 1-3 på dag 3 blev betragtet som brugbare embryoner, og embryoner af grad 1-2 blev betragtet som embryoner af god kvalitet. Alle friske embryooverførsler (ET’er) blev udført på dag 3 eller dag 5. I tilfælde, hvor der var et tilstrækkeligt antal (≥ 3-4) embryoner af god kvalitet på dag 3, blev der foretaget blastocystoverførsel på dag 5. Ud over de overførte embryoner blev patienternes ekstra embryoner vitrificeret på dag 3 eller på blastocyststadiet (dag 5-6). Embryoner i spaltningsstadie af grad 1-3 på dag 3 og blastocyster med Gardner-score over 4CC blev kryokonserveret (Cryo-top, åbent system, Kuwayama). Metoderne og proceduren for nedfrosset ET er beskrevet i detaljer i en tidligere kontrolundersøgelse foretaget af vores hold (8, 9). Hvis implantationen mislykkedes i en frisk cyklus, ville den frosset optøede embryooverførsel (FET) blive udført ved hjælp af de resterende vitrificerede embryoner eller blastocyster. Patienter under 35 år med embryoner af god kvalitet blev opfordret til at få en single-embryo transfer. Der blev også anvendt en politik for overførsel af et enkelt embryo til patienter med unormal livmoder (f.eks. arret livmoder, uterusmisdannelse) og/eller andre tilfælde, der var i konflikt med tvillingegraviditet. Progesteron intramuskulær injektion (60 mg/dag) blev givet til støtte for lutealfasen fra oocytudtagningsdagen indtil en negativ serum beta-hCG eller 8 ugers graviditet.
Primære resultatmålinger og statistisk analyse
Det primære resultat var kumulativ levende fødsel (CLB) defineret som mindst én levende fødsel som følge af én aspireret ART-cyklus i den friske ET eller i den efterfølgende FET i forhold til antallet af udtagne oocytter. Tælleren i CLBR-beregningen var summen af levende fødsler opnået i FET’erne og levende fødsler i friske cyklusser. Kun den første fødsel blev medregnet i analysen, hvis en patient opnåede flere fødsler. CLBR blev defineret som den kumulative levende fødsel pr. transvaginal oocytudtagning i overensstemmelse med terminologiens definition (7, 10) En behandlingscyklus blev defineret som en oocyteudtagning. En komplet behandlingscyklus betød en behandlingscyklus, der opnåede levende fødsel, eller en behandlingscyklus, der ikke opnåede levende fødsel med alle de overførte embryoner. Den kumulative levendefødselsrate i denne undersøgelse blev beregnet på grundlag af den komplette behandlingscyklus, så patienterne (n = 337) med ikke-komplet behandling blev udelukket.
Databehandlingen og den statistiske analyse blev udført ved hjælp af EmpowerStats-software (www.empowerstats.com) og de statistiske softwarepakker R. For at vurdere odds ratio (OR) for CLBR i forskellige patientgrupper blev der etableret en regressionsmodel med flere variabler med potentielle forstyrrende faktorer som variabler og justeret for behandlingsår, kvindelig BMI, type infertilitet, varighed af infertilitet, graviditet, paritet, hovedætiologi, OS-protokol, gonadotrophintype og FSH-startdosis. Patienterne blev indskrevet i 3 år, i løbet af hvilke IVF-proceduren blev revideret. For at eliminere bias forårsaget af denne faktor blev den kumulative levendefødselsrate justeret for behandlingsåret. Kvinders BMI, typen af infertilitet, længden af infertilitet, graviditet, paritet og hovedætiologi var vigtige faktorer, der påvirkede graviditet og levende fødsler gennem erfaring eller litteratur. OS-protokol, gonadotropintype og FSH-startdosis er de vigtigste indikatorer for at påvirke antallet af udtagne oocytter og i sidste ende den kumulative chance for levende fødsler.
Resultater
Oocyt- og embryoparametre

Tabel 3. Oocytter og embryoparametre og CLBR’er.
Graviditetsresultater og kumulativ levendefødselsrate (CLBR)
I modstrid med fordelingsmønstret for antallet af oocytter og embryoner pr. gruppe var CLBR’erne i rækkefølgen fra højest til lavest 44.6% i gruppe 1(n = 879), 35,5% i gruppe 3(n = 858), 24,5% i gruppe 2 (n = 482) og 12,7% i gruppe 4 (n = 1306). Der blev foretaget en regressionsanalyse med flere variabler med variabler, der kan fungere som forstyrrende faktorer, som er beskrevet i tabel 1, 2. De justerede odds ratio’er (OR’er) for CLBR med deres 95 % konfidensintervaller (CIs) blev vist i tabel 4. I overensstemmelse med tendensen i de ikke-justerede resultater var CLBR i gruppe 3 (OR 0,9, 95 % CI 0,7-1,2, p = 0,615) lidt lavere og gruppe 5 (OR 1,3, 95 % CI 0,9-1,7, p = 0,111) var lidt højere end CLBR i gruppe 1 uden signifikant statistisk forskel. CLBR i gruppe 2 var signifikant lavere end i gruppe 1 (OR 0,6, 95 % CI 0,4-0,8, p = 0,004) og CLBR i gruppe 4 var den laveste (OR 0,4, 95 % CI 0,3-0,6, p < 0,001) i forhold til gruppe 1. Tabel 5 viste graviditetsresultaterne pr. frisk overførsel eller FET hos patienter med lav prognose. Implantationsfrekvenserne i de ældre grupper (gruppe 2 og gruppe 4) var signifikant lavere end i de unge grupper (gruppe 1 og gruppe 3).

Tabel 4. Logistisk regressionsanalyse for CLBR.

Tabel 5

Tabel 5. Graviditetsresultater pr. overførsel både frisk og frossen embryotransfer hos patienter med lav prognose.
Figur 2 viste trenddiagrammet for nøglebegivenheder hos patienter med lav prognose. Der var en krydsning af tendenslinjerne mellem gruppe 2 og gruppe 3 efter embryotransfer. Patienter i gruppe 2 (alder ≥35; AFC ≥ 5) havde højere AFC, flere udtagne oocytter, flere embryoner og flere embryoner af god kvalitet, men nedsat implantationsrate og CLBR. Omvendt havde patienterne i gruppe 3 (alder < 35; AFC < 5) ganske vist færre oocytter og embryoner, men CLBR viste sig at være højere end i gruppe 2. SWOT-analysen af 4 grupper af patienter med lav prognose, defineret efter POSEIDON-kriterierne, er vist i figur 3.
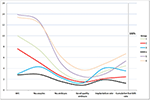
Figur 2. Tendensdiagram over nøglebegivenheder hos patienter med lav prognose. Der var et kryds af tendenslinjerne mellem gruppe 2 (rød) og gruppe 3 (blå) efter embryotransfer. X-aksen repræsenterer det gennemsnitlige antal AFC, antal oocytter, antal embryoner, antal embryoner af god kvalitet, implantationsrate og rate af kumulativ levende fødsel. Y-aksen til venstre repræsenterer antallet af de fire første variabler (n), og Y-aksen til højre repræsenterer andelen af de to sidste variabler (%).

Figur 3

Figur 3. SWOT-analyse af 4 grupper af patienter med lav prognose defineret ved POSEIDON-kriterierne.
Diskussion
Det vigtigste resultat af denne retrospektive undersøgelse i POSEIDON-kriterie-defineret population var, at CLBR var højest i gruppe 1, efterfulgt af gruppe 3 og gruppe 2 og lavest i gruppe 4. Ifølge vores resultater var CLBR fra de unge kvinder med dårlig ovariereserve (gruppe 3) lidt lavere end CLBR fra de unge kvinder med god ovariereserve og tidligere lav responder (gruppe 1). Selv om patienterne i gruppe 2 (alder ≥ 35 år; AFC ≥ 5) havde bedre ovariereserve, flere oocytter og flere embryoner, var CLBR og implantationsraten omvendt lavere end hos patienterne i gruppe 3 med dårligere ovariereserve, færre oocytter og færre embryoner. Dette resultat kan lette udviklingen af behandlingsstrategier for patienter med lav prognose.
De innovative POSEIDON-kriterier har til formål at identificere og stratificere patienter med lav prognose i fire forskellige grupper baseret på kvindens alder, AFC og ovarierespons i den foregående cyklus (4). Patienterne i gruppe 2 var karakteriseret ved god ovariereserve og fremskreden alder, præcis det modsatte af gruppe 3-patienter med dårlig ovariereserve, men er i yngre alder. Undersøgelser (11-13) har vist, at CLBR stiger med antallet af udtagne oocytter, selv hos kvinder i en fremskreden alder (14). Det blev foreslået, at antallet af udtagne oocytter er en meget vigtig variabel, der er uafhængigt forbundet med CLBR. Patienter i gruppe 2 med et højere antal oocytter forventedes at have en bedre prognose end patienter i gruppe 3, fordi patienterne i gruppe 2 havde flere embryoner til overførsel. CLBR og implantationsraten var imidlertid omvendt højere i gruppe 2 end i gruppe 3.
Vores resultater er i overensstemmelse med tidligere undersøgelser (15, 16) om sammenhængen mellem ovariereserve og graviditetsresultat. Chang et al. (15) fandt, at der var lavere satser for normal befrugtning, spaltning, embryoner af høj kvalitet, implantation og graviditet hos ældre kvinder end hos yngre kvinder med nedsat ovarie-reserve. Den primære årsag var den negative indvirkning af aldrende oocyter på graviditetsresultatet (lav implantationsrate og høj graviditetstabsrate) på grund af kromosomale abnormiteter (17) og cytoplasmatisk dysfunktion (18). Nedgangen i fertilitet med aldring vedrører både kvantitet og kvalitet af oocytene. Implantation og abort er relateret til kvaliteten af oocytter, men ikke nødvendigvis til den ovarielle reserve (16). Den rimelige ovariereserve i gruppe 2 ville øge muligheden for at få flere oocytter og embryoner til overførsel, men samtidig ville den højere aneuploiditetsrate føre til lav implantationsrate og høj abortrate.
Med hensyn til behandlingen af patienter i gruppe 2 bør der lægges større vægt på at udvikle strategier til forbedring af oocytkvaliteten snarere end oocytkvantitet eller embryokvantitet. Da der opnås flere embryoner på dag 3 i gruppe 2, er det en god mulighed at dyrke embryoner til blastocyststadiet med henblik på overførsel. Embryoner fra dag 5-6 har en lavere rate af segmental aneuploidie (19) og en højere levedygtighed for implantation (20) end embryoner fra dag 2-3. Præimplantationsgenetisk testning for aneuploidier (PGT-A) er også gavnlig for avancerede kvinder for at vælge et euploidt embryon til overførsel (21). Et optimalt ovariestimuleringsregime for at forbedre kvaliteten af oocytter (22, 23) kunne være en alternativ mulighed. Tilskud som dehydroepiandrosteron blev forsøgt for at forbedre follikeludviklingen (24), selv om der ikke er tilstrækkelig evidens til at støtte deres anvendelse hos disse patienter.
Patienterne i gruppe 3 (alder < 35; AFC < 5) havde en dårlig ovariereserve, som forventedes at være dårlige responders med dårligt graviditetsresultat. Interessant nok var oocytoutputraten (145,3 % oocytter hentet pr. AFC) i gruppe 3 signifikant højere end i de andre grupper, selv om FSH-startdosis ikke blev øget signifikant (tabel 2). Dette tydede på, at antralfolliklernes respons på gonadotropin måske har nået grænsen for sin evne, og at der derfor ikke vil være nogen yderligere fordel i oocytantallet ved yderligere at øge de daglige gonadotropindoser (25). Evaluering af ovariernes følsomhed over for FSH er et nøgleelement for at forbedre IVF-succesraten hos disse patienter med lav prognose og åbne nye behandlingsperspektiver (26). Den høje oocytproduktion pr. AFC i gruppe 3 understøttede også den rapporterede anbefaling af en maksimal daglig dosis på 300 IE rFSH (5). For patienterne i gruppe 3 bør der fokuseres mere på at øge antallet af oocytter, da det kliniske graviditetsresultat er beroliget, når der er erhvervet oocytter.
Patienterne i gruppe 5 var de patienter med ikke lav prognose, som havde et godt ovarie respons (mere end 9 oocytter i tidligere udtagning), men de fleste af disse patienter undlod at føde levende i den tidligere IVF-cyklus. Sammenlignet med en anden patient med ikke lav prognose med første IVF-behandling (gruppe 6), selvom patienterne i gruppe 5 har flere AFC og antal hentede oocytter, var embryoudviklingen og graviditetsresultatet ringere end i gruppe 6. Derfor kan fiaskoen hos første IVF-patienter med godt ovariesvar være den dårlige prognose for efterfølgende IVF-behandling.
Pelvic-tubal faktor er den mest almindelige årsag til infertilitet, der tegner sig for omkring 10,8-78,3% af infertile kvinder i Kina (27, 28). Tubal faktor omfatter hovedsageligt tubal okklusion og peritoneal patologi, der forårsager adhæsioner, som blev diagnosticeret ved hysterosalpingografi og laparoskopi. Den hyppigste årsag til tubalfaktorinfertilitet blev tilskrevet bækkenbetændelse (PID), salpingitis og endometriose (29). I patientgrupperne i denne undersøgelse er tubal faktor den vigtigste infertilitetsætiologi, der varierer fra 62,9 til 71,4 %, hvilket var højere end hos infertilitetskvinder i andre lande og regioner. Derfor bør man være forsigtig med at fortolke de bredere implikationer af resultaterne.
Begrænsninger er relateret til undersøgelsens retrospektive karakter, og det faktum, at dataene var fra et enkelt center, svækker også universalitet af vores observationer. Andre potentielle begrænsninger kunne være, at der blev anvendt en ikke-GnRH-analog protokol hos nogle kvinder med nedsat ovariereserve snarere end hos kvinder med normal ovariereserve. De friske cyklusser, der ikke gav nogen oocytter, blev ikke inkluderet i denne undersøgelse, for eksempel cyklusser med annullering af ovariestimulering.
Resultaterne af denne undersøgelse kan give ny indsigt til udvikling af behandlingsstrategier for patienter med lav prognose. Der blev udført en SWOT-analyse for at hjælpe håndteringen for patienter med lav prognose i klinikken, som blev udarbejdet på baggrund af POSEIDON-rapporterne (1, 2, 4, 5) og dataene i denne undersøgelse. Responsen af antrale follikler på gonadotrofin var ekstremt højere i gruppe 3 end i de andre grupper. I betragtning af det tilfredsstillende CLBR-resultat i gruppe 3 foreslår vi, at man for at øge oocytudbyttet forsøger flere ovariestimuleringer, men ikke hårdere ovariestimulering ved hjælp af en for høj daglig gonadotrofin-dosis. Selv om patienterne i gruppe 2 har større ovariereserve samt flere oocytter og embryoner, var CLBR lavere end forventet. Behandlingsstrategien for gruppe 2 bør være at forbedre antallet af levendefødte børn snarere end at øge antallet af udtagne oocytter.
Slutning
Sammenfattende var CLBR’erne i rækkefølge fra højest til lavest i gruppe 1 (unge kvinder med god ovariereserve), gruppe 3 (unge kvinder med dårlig ovariereserve), gruppe 2 (kvinder i fremskreden alder med god ovariereserve) og til sidst gruppe 4 (kvinder i fremskreden alder med dårlig ovariereserve) i uoverensstemmelse med fordelingsmønstret for oocytmængde og embryomængde efter patientgruppe.
Datatilgængelighed
Råddataene, der understøtter konklusionerne i dette manuskript, vil blive stillet til rådighed af forfatterne uden unødige forbehold for enhver kvalificeret forsker.
Etisk erklæring
Undersøget blev godkendt af den etiske komité for klinisk anvendelse af human assisteret reproduktionsteknologi på Northwest Women’s and Children’s Hospital (nr. 2018002). Den etiske komité, der godkendte denne undersøgelse, frafaldt behovet for at indhente informeret samtykke. Al forskning blev udført i overensstemmelse med de relevante retningslinjer og bestemmelser.
Author Contributions
WS og JS udtænkte og designede undersøgelsen. WS og WZ udarbejdede og reviderede manuskriptet. WS, ZZ og WZ analyserede og fortolkede dataene. LT, ZZ og HZ indsamlede og ryddede dataene. Alle forfattere har læst og godkendt den endelige version af manuskriptet.
Funding
Undersøgelsen blev finansieret af General Projects of Social Development in Shaanxi Province (No. 2018SF-247) og Personnel Training Program of Northwest women and children’s Hospital (2018ZD02).
Interessekonflikterklæring
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller økonomiske relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Vi takker alle klinikere, forskere og embryologer på Northwest Women and Children’s Hospital for deres hjælp med dataindsamlingen og alle patienterne for deres bidrag til denne undersøgelse. Vi takker taknemmeligt Dr. Xinglin Chen fra Department of Epidemiology and Biostatistics, X&Y solutions Inc. i Boston for hendes bidrag til den statistiske støtte.
1. Alviggi C, Andersen CY, Buehler K, Conforti A, De Placido G, Esteves SC, et al. En ny mere detaljeret stratificering af low responders til ovariestimulering: fra et dårligt ovariesvar til et koncept med lav prognose. Fertil Steril. (2016) 105:1452-3. doi: 10.1016/j.fertnstert.2016.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Humaidan P, Alviggi C, Fischer R, Esteves SC. Den nye POSEIDON-stratificering af “patienter med lav prognose i forbindelse med assisteret reproduktionsteknologi” og den foreslåede markør for et vellykket resultat. F1000Res. (2016) 5:2911. doi: 10.12688/f1000research.10382.1
CrossRef Full Text | Google Scholar
3. Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund G, Gianaroli L, et al. ESHRE-konsensus om definitionen af “dårlig respons” på ovariestimulering til in vitro-befrugtning: Bologna-kriterierne. Hum Reprod. (2011) 26:1616-24. doi: 10.1093/humrep/der092
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Esteves SC, Roque M, Bedoschi GM, Conforti A, Humaidan P, Alviggi C. Definition af patienter med lav prognose, der gennemgår assisteret reproduktionsteknologi: POSEIDON-kriterierne – hvorfor. Front Endocrinol. (2018) 9:461. doi: 10.3389/fendo.2018.00461
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Shi W, Zhang S, Zhao W, Xia X, Wang M, Wang H, et al. Faktorer relateret til klinisk graviditet efter vitrificeret-varmet embryotransfer: en retrospektiv og multivariat logistisk regressionsanalyse af 2313 transfercyklusser. Hum Reprod. (2013) 28:1768-75. doi: 10.1093/humrep/det094
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Polyzos NP, Drakopoulos P, Parra J, Pellicer A, Santos-Ribeiro S, Tournaye H, et al. Kumulative levendefødselsrater i henhold til antallet af oocytter, der er udtaget efter den første ovariestimulering med henblik på in vitro-befrugtning/intracytoplasmisk sædinjektion: en multicenter multinational analyse, der omfatter ca. 15 000 kvinder. Fertil Steril. (2018) 110:661-70 e1. doi: 10.1016/j.fertnstert.2018.04.039
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Zhou J, Wang B, Hu Y, Sun H. Association mellem antallet af hentede oocytter og kumulativ levende fødselsrate hos kvinder i alderen 35-40 år, der gennemgår lange GnRH-agonist IVF/ICSI-cyklusser med GnRH-agonist. Arch Gynecol Obstet. (2017) 296:1005-12. doi: 10.1007/s00404-017-4503-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. Prognose for kumulativ levendefødselsrate baseret på antallet af aspirerede oocytter i tidligere ART-cyklusser. Hum Reprod. (2019) 34:171-80. doi: 10.1093/humrep/dey341
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Devesa M, Tur R, Rodriguez I, Coroleu B, Martinez F, Polyzos NP. Kumulative levendefødselsrater og antal udtagne oocytter hos kvinder i fremskreden alder. En analyse fra et enkelt center med 4500 kvinder >/ = 38 år gamle. Hum Reprod. (2018) 33:2010-17. doi: 10.1093/humrep/dey295
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Chang Y, Li J, Li X, Liu H, Liang X. Ægkvalitet og graviditetsresultat hos unge infertile kvinder med nedsat ovariereserve. Med Sci Monit. (2018) 24:7279-84. doi: 10.12659/MSM.910410
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bishop LA, Richter KS, Patounakis G, Andriani L, Moon K, Devine K. Nedsat ovariereserve som målt ved hjælp af baseline follikelstimulerende hormon og antral follikelantal er ikke forbundet med graviditetstab hos yngre in vitro befrugtningspatienter. Fertil Steril. (2017) 108:980-7. doi: 10.1016/j.fertnstert.2017.09.011
CrossRef Full Text | Google Scholar
17. Igarashi H, Takahashi T, Nagase S. Oocyte aldring ligger til grund for kvindelig reproduktiv aldring: biologiske mekanismer og terapeutiske strategier. Reprod Med Biol. (2015) 14:159-69. doi: 10.1007/s12522-015-0209-5
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Babariya D, Fragouli E, Alfarawati S, Spath K, Wells D. Forekomsten og oprindelsen af segmental aneuploidi i humane oocytter og præimplantationsembryoner. Hum Reprod. (2017) 32:2549-60. doi: 10.1093/humrep/dex324
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Zeng M, Su S, Li L. Sammenligning af graviditetsresultater efter vitrificering på kløvnings- og blastocyststadiet: en metaanalyse. J Assist Reprod Genet. (2018) 35:127-34. doi: 10.1007/s10815-017-1040-1
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Lin LT, Vitale SG, Chen SN, Wen ZH, Tsai HW, Chern CU, et al. Lutealfasens ovariestimulering kan forbedre oocytudtagning og oocytkvalitet hos dårlige ovarie-respondenter, der undergår in vitro-befrugtning: foreløbige resultater fra en prospektiv pilotundersøgelse på et enkelt center. Adv Ther. (2018) 35:847-56. doi: 10.1007/s12325-018-0713-1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Narkwichean A, Maalouf W, Baumgarten M, Polanski L, Raine-Fenning N, Campbell B, et al. Efficacy of dehydroepiandrosterone (DHEA) to overcome the effect of ovarian ageing (DITTO): a proof of principle double blinded randomized placebo controlled trial. Eur J Obstet Gynecol Reprod Biol. (2017) 218:39-48. doi: 10.1016/j.ejogrb.2017.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Grynberg M, Labrosse J. Forståelse af follikulær output rate (FORT) og dens konsekvenser for POSEIDON-kriterierne. Front Endocrinol. (2019) 10:246. doi: 10.3389/fendo.2019.00246
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Hou LY. Epidemiologisk undersøgelse af infertilitet i tre provinser i Kina. Phd Thesis, Graduate School of Peking Union Medical College, Beijing, Kina (2011).
Google Scholar
28. Zhu Hui-li HW. Epidemiologi og ætiologi af oviduct infertilitet. J Int Reprod Health/Family Plann. (2016) 35:212-216.
Google Scholar