US Pharm. 2015;40(12):HS5-HS11.
ABSTRAKT: Cirhóza je heterogenní diagnóza, která ovlivňuje funkci jater, včetně metabolismu a clearance léků, ale její přesný vliv zůstává nejasný. Mezi zdravotnickými pracovníky existují mylné představy a značná variabilita praxe, pokud jde o používání analgetik u pacientů s poruchou funkce jater. Na základě omezených údajů o bezpečnosti a účinnosti je u pacientů s jaterním onemocněním, kteří aktivně nepijí, preferovaným analgetikem paracetamol, který lze dávkovat až 2 až 3 g/den. Nesteroidním protizánětlivým lékům (NSAID) je třeba se vyhnout vzhledem k jejich nežádoucím účinkům v podobě poruchy funkce ledvin, retence tekutin a zvýšeného rizika krvácení. Opioidy by měly být užívány opatrně a měly by být zahajovány přípravky s okamžitým uvolňováním v nízkých dávkách s prodlouženými intervaly a pečlivým sledováním. Všechny léky proti bolesti by měly být pečlivě titrovány, aby bylo dosaženo bezpečné a přiměřené úlevy od bolesti u pacientů s poruchou funkce jater.
Ciróza je definována jako trvalá fibróza jater sekundárně vzniklá v důsledku jejich poškození nebo poranění. Jedná se o heterogenní diagnózu, která má za následek různý stupeň tvorby uzlin, orgánové dysfunkce, komplikace a významnou morbiditu a mortalitu. Mezi příčiny cirhózy patří zneužívání alkoholu, hepatitida B a C, rakovina a nealkoholická steatohepatitida.1 „Chronické onemocnění jater a cirhóza“ jako primární diagnóza představovalo v roce 2010 více než 101 000 hospitalizací.2 V roce 2013 bylo hlášeno jako hlavní příčina úmrtí u osob ve věku 25 až 64 let a 12. hlavní příčina úmrtí pro všechny věkové kategorie, což vedlo k více než 36 000 úmrtí.2
Tato čísla mohou být bohužel podhodnocena kvůli omezením diagnostických kritérií kódů Mezinárodní klasifikace nemocí (MKN), které nezohledňují komplikace související s cirhózou. Jedna studie naznačuje, že počet úmrtí souvisejících s játry může být až dvakrát vyšší, než kolik v současnosti uvádí CDC.3
Poskytovatelé zdravotní péče jsou obeznámeni se zásadní úlohou jater při metabolismu a clearance mnoha léčiv. Cirhóza může vést ke vzniku portohepatálních zkratů, což v konečném důsledku snižuje first-pass metabolismus, ke kterému dochází u mnoha perorálních léků. Snížená tvorba albuminu může také vést ke zvýšení volných koncentrací léků s vysokou vazbou na bílkoviny. Obecně se má za to, že s postupující jaterní dysfunkcí dochází ke zhoršení eliminace léků, nicméně u pacientů s chronickou hepatitidou nebo rakovinou jater může při absenci cirhózy dojít pouze k malé změně v clearance léků.4 Zůstává nejasné, do jaké míry cirhóza ovlivňuje dispozice léků.
Ačkoli některé léky mají specifické parametry pro úpravu renální dávky, úprava jaterní dávky nemusí být snadno dostupná. Mnoho studií hodnotilo farmakokinetiku a sérové hladiny analgetik u pacientů, které nemusí nutně korelovat s odpovědí pacienta. Další dostupné studie se zaměřily především na hepatitidu C, ačkoli u mnoha pacientů dochází k jaterní dysfunkci a cirhóze sekundárně z jiných příčin. Childovo-Pughovo skóre, které se v praxi běžně nevypočítává, často určuje dávkování, ale výsledná doporučení mohou být stále vágní bez jasného vodítka pro klinickou aplikaci. Léčbu pacientů může dále komplikovat souběžná porucha funkce ledvin, ať už související s onemocněním jater, jako je hepatorenální syndrom, nebo s jinou příčinou.4
Používání analgetik při cirhóze
Léčba bolesti je pro zdravotníky často výzvou, ale zůstává velmi důležitou součástí poskytování kvalitní péče o pacienty a je častým faktorem spokojenosti pacientů.5 U pacientů s chronickým onemocněním jater byla zjištěna vysoká prevalence bolesti, uváděná mezi 32 % a 77 %.6-8 Bylo zjištěno, že bolest a léčba bolesti opioidy jsou významnými prediktory využívání zdravotní péče u pacientů s onemocněním jater.8
Jeden retrospektivní přehled zjistil, že 77 % pacientů před transplantací jater (n = 108) uvádělo tělesnou bolest, přičemž více než třetina uváděla více míst.7 Bolest údajně ovlivňovala práci, spánek, mobilitu, chuť k jídlu, radost a náladu. Přibližně 90 % respondentů uvedlo, že dostávalo farmakologickou léčbu, avšak pouze 33 % z nich pociťovalo úlevu. Krátkodobě působící opioidy byly předepsány ve 40 % případů a 32 % pacientů uvedlo, že jim bylo předepsáno pět nebo více léků proti bolesti. Autoři dospěli k závěru, že bolest u pacientů v konečném stadiu onemocnění jater (ESLD) je velmi častá, ovlivňuje funkčnost a často není dostatečně léčena, a to i přes četné předepisované farmakologické terapie.7
Polyfarmacie byla navržena jako běžný přístup k léčbě bolesti, pravděpodobně v důsledku příliš opatrných předepisujících lékařů, kteří používají velmi nízké dávky několika léků namísto pečlivé titrace a optimalizace menšího počtu látek.7 Polyfarmacie zvyšuje náklady, komplikuje pochopení účinnosti látek, vytváří terapeutické duplicity a zvyšuje inherentní riziko lékových interakcí a nežádoucích účinků. Léčba bolesti u cirhózy představuje složitou oblast farmakoterapie s jedinečným ohledem na změněnou jaterní patofyziologii a jemnou rovnováhu mezi adekvátní úlevou od bolesti a zamezením významným potenciálním nežádoucím účinkům.7
Acetaminofen
Běžně se má za to, že u pacientů s jaterní dysfunkcí je třeba se acetaminofenu vyhnout vzhledem k jeho dobře známému riziku hepatotoxicity při předávkování. Toto riziko přímo souvisí s nasycením jiných metabolických drah a vyčerpáním zásob glutathionu (GSH).5 Přibližně 5 % paracetamolu je metabolizováno enzymy CYP450 (převážně 2E1 a také 1A3 a 3A4) na reaktivní metabolit N-acetyl-p-benzochinon imin (NAPQI). V přítomnosti GSH je NAPQI konjugován a vylučován ledvinami. Pokud není GSH k dispozici, NAPQI se hromadí a způsobuje nekrózu a apoptózu hepatocytů.
U alkoholiků může dojít k indukci CYP2E1 v důsledku chronického požívání alkoholu a snížené hladiny GSH v důsledku podvýživy. Tyto fyziologické změny mohou u těchto pacientů způsobit zvýšené riziko acetaminofenem indukovaného poškození jater. V důsledku toho existují obavy, že všichni pacienti s cirhózou mají nižší hladiny GSH a zvýšené riziko hepatotoxicity paracetamolu. Ačkoli byl u pacientů s cirhózou dokumentován prodloužený poločas rozpadu, nejsou k dispozici žádné prospektivní, dlouhodobé studie, které by hodnotily bezpečnost paracetamolu. Některé studie naznačují, že poškození jater je při vhodném dávkování vzácné a že paracetamol je u stabilního chronického jaterního onemocnění dobře tolerován až do dávky 4 g/den, přičemž není prokázána zvýšená aktivita CYP ani kriticky vyčerpané zásoby GSH.5,9,10
Pro krátkodobé i dlouhodobé užívání u pacientů s cirhózou, kteří aktivně nepijí alkohol, se na základě odborného názoru doporučuje celková denní dávka paracetamolu 2 až 3 g.4,5 Na rozdíl od všeobecného přesvědčení je paracetamol považován za preferovaný přípravek při jaterní dysfunkci, pokud je dodržen limit celkové denní dávky, ale je třeba se mu vyhnout u pacientů, kteří aktivně pijí alkohol.4,11,12 Intravenózní paracetamol je kontraindikován při těžkém jaterním postižení a těžkém aktivním jaterním onemocnění.13
Nesteroidní protizánětlivé léky (NSAID)
U pacientů s cirhózou se u NSAID očekávají změny v metabolismu a biologické dostupnosti z důvodu významného metabolismu CYP a vazby na proteiny.5 Obavy u pacientů s cirhózou se však týkají především fyziologických účinků NSAID. Tyto léky inhibují syntézu prostaglandinů, což vede ke snížení průtoku krve ledvinami a rychlosti glomerulární filtrace (GFR) a ke zhoršení vylučování sodíku a vody ledvinami, což může u pacientů s cirhózou zhoršit ascites a zvýšit riziko hepatorenálního syndromu.4 Je známo, že NSAID způsobují podráždění gastrointestinálního traktu, ulcerace a perforace a zvyšují celkové riziko krvácení u pacientů v důsledku inhibice produkce tromboxanu A2 v krevních destičkách.4,5 Vzhledem k trombocytopenii, snížené syntéze srážecích faktorů a jícnovým varixům spojeným s portální hypertenzí mohou mít pacienti s cirhózou vyšší riziko krvácení, které může být život ohrožující.4 Z těchto důvodů je třeba se u pacientů s cirhózou vyhnout užívání NSAID.
Opioidy
Opioidy jsou nejčastější skupinou léků pro analgezii, zejména středně silné a silné bolesti nebo bolesti, kterou nezmírní paracetamol a NSAID. Opioidy mohou přispívat k významným komplikacím při cirhóze, včetně precipitace encefalopatie, což opravňuje k opatrnosti při jejich užívání.5 Je vhodné mít na paměti, že účinky opioidů lze zvrátit naloxonem, zatímco komplikace neléčené nebo nedostatečně léčené bolesti mohou být významné.14 Opioidy mohou být nezbytné poté, co vhodná nefarmakologická a neopioidní léčba nepřinesla dostatečné výsledky.7
Oxidace je hlavní metabolickou cestou opioidů (často prostřednictvím enzymů CYP), s výjimkou morfinu, a má se za to, že je ovlivněna jaterní dysfunkcí.4,15 Oxidace je snížena při jaterním onemocnění, což vede ke snížené clearance léčiva a/nebo zvýšené perorální biologické dostupnosti při sníženém metabolismu prvního průchodu. Zatímco se předpokládá, že glukuronidace je méně ovlivněna mírnou až středně těžkou jaterní dysfunkcí, při těžkém onemocnění může být významná.4 S ohledem na tyto skutečnosti jsou některé opioidy považovány za bezpečné, účinné a upřednostňované před NSAID při léčbě středně těžké až těžké bolesti s použitím snížených dávek a prodloužených intervalů. Vzhledem k nejasným doporučením je však rozhodnutí často ponecháno na klinickém úsudku lékaře.15 Dlouhodobě působící látky lze zvážit až poté, co je stanoveno bezpečné a účinné dávkování krátkodobě působících látek.5
Tramadol: Tramadol podléhá z více než 80 % jaternímu metabolismu.4 Ačkoli se očekávalo, že u pacientů s jaterní cirhózou bude v důsledku snížené biotransformace poskytovat menší úlevu od bolesti, v klinických studiích se to neprokázalo.4 Jedna studie zaznamenala významný rozdíl v maximální koncentraci (Cmax) a době vrcholu (Tmax), clearance se snížila na polovinu a eliminační poločas byl až 3krát delší než kontrolní u 20 pacientů s jaterní malignitou ve srovnání s 10 zdravými kontrolami.16 Autoři doporučují prodloužit dávkovací interval a považují tramadol 50 mg každých 12 hodin za bezpečný a účinný. Jiní doporučují 25 mg každých 8 hodin při jaterní dysfunkci.5 Informační zdroje o lécích, například Lexicomp, doporučují 50 mg každých 12 hodin u pacientů s cirhózou a uvádějí, že přípravek s prodlouženým uvolňováním by neměl být používán u pacientů s těžkou (Child-Pughova třída C) jaterní dysfunkcí.17
Tramadol může být prospěšný u neutišitelné bolesti díky své částečné inhibici zpětného vychytávání serotoninu a aktivitě na periferních drahách bolesti.5 Opatrně je třeba užívat tramadol u pacientů se záchvaty v anamnéze a v kombinaci s jinými serotonergními léky vzhledem k jeho účinku na snížení záchvatového prahu, resp. možnému rozvoji serotoninového syndromu. Dávku a frekvenci tramadolu je rovněž třeba snížit podle funkce ledvin.17
Hydrokodon a oxykodon: Metabolismus hydrokodonu a oxykodonu závisí na CYP2D6 a 3A4 na jejich silnějších metabolitech, hydromorfonu, resp. oxymorfonu.5 Analgetický účinek těchto léčivých přípravků může být u pacientů s poruchou funkce jater méně silný v důsledku snížené přeměny na jejich aktivní metabolity, zatímco snížená clearance a prodloužený poločas rozpadu mohou vyvolat více nežádoucích účinků.4,5 Doporučuje se zahájit léčbu nižšími dávkami a prodlouženými intervaly s ponecháním dostatečné doby mezi jednotlivými dávkami, aby nedocházelo k jejich hromadění, a titrovat podle reakce pacienta. U kombinovaných přípravků s paracetamolem (např. Vicodin, Percocet) je třeba postupovat opatrně a zajistit, aby celková denní dávka paracetamolu ze všech zdrojů nepřekročila doporučený limit 2 až 3 g/den.5
Morfin: U morfinu se předpokládá vysoká jaterní extrakce při metabolismu prvního průchodu, takže je po perorálním podání u zdravých pacientů biologicky dostupný pouze z 30 % až 40 %.4,5 Morfin je metabolizován játry na morfin-6-glukuronid (aktivní metabolit) a morfin-3-glukuronid (neaktivní metabolit s potenciálními neurotoxickými účinky), které jsou následně vylučovány ledvinami. Vzhledem ke sníženému first-pass metabolismu u pacientů s cirhózou je morfin pravděpodobně biologicky dostupnější a doporučují se nižší perorální dávky.4,5,15 Studie shodně prokázaly sníženou clearance a prodloužený poločas morfinu u pacientů s cirhózou. Bylo doporučeno prodloužit dávkovací interval až na dvojnásobek, aby se zabránilo kumulaci léčiva, a to jak při intravenózním, tak při perorálním podání.5 Morfinu je třeba se vyhnout při poruše funkce ledvin, včetně hepatorenálního syndromu, z důvodu významné kumulace jeho metabolitů a rizika neurotoxicity.4
Hydromorfon: Některé studie uvádějí až čtyřnásobné zvýšení Cmax po podání jedné dávky hydromorfonu s okamžitým uvolňováním u pacientů se středně závažným jaterním onemocněním, a to v důsledku sníženého metabolismu prvního průchodu při poruše funkce jater a vysoké jaterní extrakci.4 Bylo doporučeno začít s nižšími dávkami, ale zachovat podobný dávkovací interval.4,5 Farmakokinetika hydromorfonu nebyla u pacientů s těžkým jaterním onemocněním studována. Zdá se, že clearance hydromorfonu není relativně ovlivněna, zejména dysfunkcí ledvin. Bylo však navrženo, aby hydromorfon nebyl používán u hepatorenálního syndromu vzhledem k pozorovanému riziku akumulace jeho neuroexcitujícího metabolitu, hydromorfon-3-glukuronidu.4
Fentanyl: Ačkoli je fentanyl silně vázán na bílkoviny, předpokládá se, že není ovlivněn cirhózou.4,5,15 Fentanyl může být u pacientů s cirhózou lépe tolerován, protože nemá žádné toxické metabolity.4 Fentanyl však nemusí být nejvhodnější látkou vzhledem k jeho velmi vysoké účinnosti a dalším klinickým scénářům (např, akutní bolest, ambulantní léčba a nutnost perorálního podávání).15
Užívání transdermálních fentanylových náplastí někteří autoři doporučují jako možnost první volby u neutišitelné bolesti, což je však sporné, protože u pacientů s cirhózou byly při používání náplastí zjištěny zvýšené koncentrace Cmax a plochy pod křivkou (AUC), a to o 35 %, resp. 73 %.4,5,18 Je důležité mít na paměti, že použití fentanylové náplasti by se mělo zvažovat až poté, co byly stanoveny požadavky na opioidy pomocí titrace krátkodobě působících opioidů.15 U pacientů s mírným až středně těžkým jaterním postižením se doporučuje zahájit léčbu 50 % obvyklé dávky a vyhnout se použití u pacientů s těžkým jaterním postižením.18 Fentanyl je považován za dobrou volbu při poruše funkce ledvin a jeho intravenózní podání lze zvážit při hepatorenálním syndromu, protože patří mezi opioidy nejméně ovlivněné poruchou funkce ledvin.4,5
Meperidin: V současné praxi se meperidin k analgezii používá zřídka kvůli riziku záchvatů při kumulaci jeho normeperidinového metabolitu. Přestože koncentrace normeperidinu mohou být u těchto pacientů nižší v důsledku snížené aktivity CYP, dochází ke zvýšené biologické dostupnosti související se sníženou vazbou na proteiny a zpožděnou clearance a metabolit se může stále hromadit.4,5,15 Meperidinu je třeba se vyhnout u pacientů s cirhózou.
Kodein: U zdravých pacientů je analgetický účinek kodeinu proměnlivý v důsledku fenotypové variability CYP2D6, která ovlivňuje přeměnu na morfin. U pacientů s poruchou funkce jater mohou být sérové hladiny kodeinu variabilnější v důsledku snížené aktivity CYP, což způsobuje snížený analgetický účinek.4,5,15 Vzhledem k obecnému nedostatku studií u pacientů s cirhózou se kodein nedoporučuje.
Metadon: Pro léčbu závislosti na opioidech se často používá metadon. Tento lék představuje mnoho problémů díky své značné interindividuální variabilitě v biologické dostupnosti, vazbě na bílkoviny a dlouhému poločasu.4,5,15 Je převážně metabolizován CYP3A4.15 Při opakovaném podávání může docházet ke kumulaci při těžké jaterní dysfunkci a plazmatické koncentrace mohou být zvýšeny akutním požitím alkoholu.4 Použití metadonu k analgezii u pacientů s jaterním onemocněním nebylo studováno, proto se pro toto použití u těchto pacientů nedoporučuje.4 Přínosy monitorovaných udržovacích programů s metadonem u závislostí na opioidech, např. heroinu, však mohou převážit potenciální rizika.5
Buprenorfin: Perorální podání buprenorfinu, parciálního mu-opioidního agonisty, vede k rozsáhlému metabolismu prvního průchodu a slabému analgetickému účinku, zatímco sublingvální podání umožňuje, aby se asi 50 až 55 % léčiva vyhnulo inaktivaci CYP3A4.4,15 Bohužel v současné době nejsou k dispozici studie o buprenorfinu, které by určily, zda je nutná úprava dávky nebo zda farmakokinetika zůstává při poruše funkce jater nezměněna. Při užívání buprenorfinu u pacientů s preexistující jaterní dysfunkcí byla hlášena hepatitida. Z těchto důvodů by měl být buprenorfin u pacientů s jaterním onemocněním používán s opatrností.
Různé
Lidokain: Lokální použití lidokainových náplastí je běžnou úvahou pro lokální tlumení bolesti. Ačkoli se má za to, že perorální lidokain má vysokou jaterní extrakci s first-pass metabolismem, nebyla nalezena žádná literatura pojednávající o farmakokinetice nebo použití lidokainových náplastí pro léčbu bolesti u pacientů s cirhózou.19 Bolest u pacientů s jaterní dysfunkcí může být difuzní a/nebo spojená s ascitem, což omezuje indikaci pro lokální lidokainové náplasti.7 Vzhledem k nedostatku důkazů a možné toxicitě by měl být lidokain u pacientů s jaterní dysfunkcí používán opatrně a pouze pro lokální bolest.
Tricyklická antidepresiva (TCA): TCA jsou již dlouho základem léčby neuropatické bolesti.5 TCA podléhají metabolismu prvního průchodu a vylučování ledvinami. Tyto látky jsou známé svými anticholinergními účinky, na které mohou být cirhotičtí pacienti citlivější. Významným problémem je zácpa, která může u těchto pacientů precipitovat jaterní encefalopatii. Tyto léky by měly být používány opatrně a pouze v případě nutnosti. Pokud se použijí, lze dát přednost nortriptylinu a desipraminu kvůli nižší účinnosti a menší sedaci, tachykardii a ortostatické hypotenzi. Při onemocnění jater se doporučuje začít s nízkými dávkami a titrovat je pomalu podle reakce pacienta.4
Antikonvulziva: Antikonvulziva hrají rovněž roli v léčbě neuropatické bolesti (prostřednictvím modulace neurotransmiterů), ale tyto léky jsou běžně metabolizovány játry a vylučovány renálně.5 U pacientů s cirhózou mohou být nutné nižší dávky a prodloužené intervaly. Karbamazepin je spojen s hepatotoxicitou a je třeba se mu vyhnout u pacientů s poruchou funkce jater. Gabapentin je upřednostňovaným přípravkem, protože není metabolizován hepatálně ani není vázán na bílkoviny, ale měl by být upraven podle funkce ledvin.4
Shrnutí a doporučení
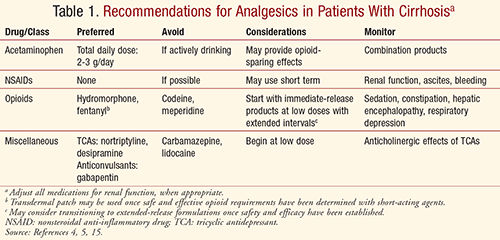
U všech pacientů musí být léčba bolesti individualizována na základě poměru přínosů a rizik s pečlivým sledováním úlevy od bolesti a nežádoucích účinků. Léčba bolesti by měla zahrnovat multidisciplinární přístup farmakologických, behaviorálních, psychologických a fyzikálních intervencí, aby bylo dosaženo nejlepších výsledků a optimalizována kvalita života, a to bezpečně a efektivně. Praktičtí lékaři musí mít vždy na paměti zvýšený potenciál lékového poškození jater u pacientů s již existujícím jaterním onemocněním, včetně cirhózy.5 S ohledem na farmakokinetické profily a profily nežádoucích účinků různých analgetik by měli praktičtí lékaři zvážit doporučení shrnutá v TABULCE 1, aby dosáhli bezpečné a přiměřené kontroly bolesti u pacientů s cirhózou.
.