Nombre genérico: aciclovir
Forma de dosificación: crema
Revisado médicamente por Drugs.com. Actualizado por última vez el 1 de diciembre de 2020.
- Descripción general
- Efectos secundarios
- Dosificación
- Profesional
- Interacciones
- Más
- Indicaciones y uso de Zovirax Crema
- Zovirax Crema Dosificación y Administración
- Formas de dosificación y concentraciones
- 4CONTRAINDICACIONES
- Advertencias y precauciones
- Generales
- Sensibilización por contacto
- Reacciones adversas
- Experiencia en ensayos clínicos
- Experiencia postcomercialización
- Interacciones medicamentosas
- Uso en poblaciones específicas
- Resumen de riesgos
- Embarazo
- Lactancia
- Uso pediátrico
- Uso geriátrico
- Sobredosis
- Zovirax Crema Descripción
- Zovirax Crema – Farmacología clínica
- Mecanismo de acción
- Farmacocinética
- Microbiología
- Toxicología no clínica
- Carcinogénesis, mutagénesis, alteración de la fertilidad
- Estudios Clínicos
- Sujetos Adultos
- Sujetos pediátricos
- Cómo se suministra/conservación y manipulación
- Información de asesoramiento al paciente
- INFORMACIÓN PARA EL PACIENTEZOVIRAX (zho-vahy-rex)(acyclovir)Crema
- PANEL DE PRESENTACIÓN PRINCIPAL – Tubo de cartón de 5 g
- Más información sobre Zovirax Crema (aciclovir tópico)
- Recursos para el consumidor
- Recursos para el profesional
- Otras formulaciones
- Guías de tratamiento relacionadas
Indicaciones y uso de Zovirax Crema
Zovirax Crema es un inhibidor de la ADN polimerasa análogo del virus del herpes simple (VHS) indicado para el tratamiento del herpes labial recurrente (herpes labial) en adultos y adolescentes inmunocompetentes de 12 años o más.
Zovirax Crema Dosificación y Administración
Zovirax Crema debe aplicarse 5 veces al día durante 4 días. El tratamiento debe iniciarse lo antes posible tras la aparición de los signos o síntomas del herpes labial, es decir, durante el pródromo o cuando aparezcan las lesiones.
Para los adolescentes de 12 años o más, la dosis es la misma que en los adultos.
Formas de dosificación y concentraciones
Cada gramo de Zovirax Crema contiene 50 mg (equivalente al 5% en peso) de aciclovir.
4CONTRAINDICACIONES
Zovirax Crema está contraindicado en pacientes con hipersensibilidad conocida al aciclovir, al valaciclovir o a cualquier componente de la formulación.
Advertencias y precauciones
Generales
Zovirax Crema sólo debe aplicarse en los aspectos externos afectados de los labios y la cara en pacientes con herpes labial. Dado que no se dispone de datos, no se recomienda la aplicación en las membranas mucosas humanas. Zovirax Crema está destinado únicamente al uso cutáneo y no debe utilizarse en el ojo o en el interior de la boca o la nariz.
Sensibilización por contacto
Zovirax Crema tiene un potencial de irritación y sensibilización por contacto.
No se ha establecido el efecto de Zovirax Crema en pacientes inmunodeprimidos.
Reacciones adversas
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas de los ensayos clínicos de otro medicamento, y pueden no reflejar las tasas observadas en la práctica clínica.
En cinco ensayos doble ciego, controlados con placebo, 1124 pacientes fueron tratados con Zovirax Crema y 1161 con crema placebo (vehículo). El 5% de los pacientes que recibieron Zovirax Crema y el 4% de los que recibieron placebo notificaron reacciones locales en el lugar de aplicación. Las reacciones adversas más frecuentes en el lugar de aplicación tópica fueron sequedad de labios, descamación, sequedad de la piel, labios agrietados, ardor en la piel, prurito, descamación de la piel y escozor en la piel; cada reacción adversa se produjo en menos del 1% de los pacientes que recibieron Zovirax Crema y placebo. Tres pacientes que recibieron Zovirax Crema y un paciente que recibió placebo interrumpieron el tratamiento debido a un acontecimiento adverso.
Se llevó a cabo un estudio adicional, en el que participaron 22 adultos sanos, para evaluar la tolerancia dérmica de Zovirax Crema en comparación con el vehículo utilizando una metodología de prueba de parche simple ocluido y semiocluido. Tanto Zovirax Crema como el placebo mostraron un potencial de irritación elevado y acumulativo. Otro estudio, en el que participaron 251 adultos sanos, se llevó a cabo para evaluar el potencial de sensibilización de contacto de Zovirax Cream utilizando la metodología de prueba de parche de insulto repetido. De 202 sujetos evaluables, se observaron posibles reacciones de sensibilización cutánea en los mismos 4 (2%) sujetos tanto con Zovirax Crema como con placebo, y estas reacciones tanto con Zovirax Crema como con placebo se confirmaron en 3 sujetos al repetir la prueba. No se ha identificado el ingrediente o ingredientes sensibilizantes.
El perfil de seguridad en pacientes de 12 a 17 años de edad fue similar al observado en adultos.
Experiencia postcomercialización
Además de los acontecimientos adversos notificados en los ensayos clínicos, se han identificado los siguientes acontecimientos durante el uso posterior a la aprobación de la crema de aciclovir. Debido a que se notifican voluntariamente desde una población de tamaño desconocido, no se pueden hacer estimaciones de la frecuencia. Estos acontecimientos han sido elegidos para su inclusión debido a una combinación de su gravedad, frecuencia de notificación o posible conexión causal con la crema de aciclovir.
General: Angioedema, anafilaxia.
Piel: Dermatitis de contacto, eczema.
Interacciones medicamentosas
La experiencia clínica no ha identificado interacciones resultantes de la administración tópica o sistémica de otros medicamentos de forma concomitante con Zovirax Crema. Debido a la mínima absorción sistémica de Zovirax Crema, es improbable que se produzcan interacciones farmacológicas sistémicas.
Uso en poblaciones específicas
Resumen de riesgos
El aciclovir se absorbe mínimamente de forma sistémica tras la vía de administración tópica, y no se espera que el uso materno dé lugar a una exposición fetal a Zovirax Crema . La experiencia con el uso de aciclovir tópico en mujeres embarazadas a lo largo de varias décadas, basada en la literatura publicada que incluye estudios observacionales, no ha identificado un riesgo asociado al medicamento de defectos congénitos importantes, abortos o resultados adversos para la madre o el feto. Se han realizado estudios de reproducción en animales con exposición sistémica de aciclovir. Consulte la información de prescripción de aciclovir para obtener detalles adicionales.
Se desconoce el riesgo de fondo estimado de defectos congénitos mayores y de aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto de nacimiento, pérdida u otros resultados adversos. En la población general de EE.UU., el riesgo de fondo estimado de defectos congénitos mayores y de aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Embarazo
Resumen de riesgos
El aciclovir se absorbe mínimamente de forma sistémica tras la vía de administración tópica, y no se espera que el uso materno dé lugar a una exposición fetal a la crema Zovirax. La experiencia con el uso de aciclovir tópico en mujeres embarazadas a lo largo de varias décadas, basada en la literatura publicada que incluye estudios observacionales, no ha identificado un riesgo asociado al fármaco de defectos congénitos importantes, abortos espontáneos o resultados maternos o fetales adversos. Se han realizado estudios de reproducción en animales con exposición sistémica de aciclovir. Consulte la información de prescripción de aciclovir para obtener detalles adicionales.
Se desconoce el riesgo de fondo estimado de defectos congénitos mayores y de aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto de nacimiento, pérdida u otros resultados adversos. En la población general de Estados Unidos, el riesgo de fondo estimado de defectos congénitos mayores y de aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Lactancia
Resumen de riesgos
Aciclovir se absorbe mínimamente de forma sistémica tras la vía de administración tópica, y no se espera que la lactancia materna provoque la exposición del niño a Zovirax Crema. No existen datos sobre los efectos de ZOVIRAX en el lactante o en la producción de leche. Los beneficios para el desarrollo y la salud de la lactancia materna deben considerarse junto con la necesidad clínica de la madre de Zovirax Crema y cualquier efecto adverso potencial en el niño amamantado de Zovirax Crema o de la condición materna subyacente.
Uso pediátrico
Se realizó un ensayo abierto y no controlado con Zovirax Crema en 113 pacientes de 12 a 17 años con herpes labial recurrente. En este ensayo, la terapia se aplicó utilizando el mismo régimen de dosificación que en los adultos y se realizó un seguimiento de los sujetos para detectar acontecimientos adversos. El perfil de seguridad fue similar al observado en adultos. No se ha establecido la seguridad y eficacia en pacientes pediátricos menores de 12 años.
Uso geriátrico
Los estudios clínicos de la crema de aciclovir no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de forma diferente a los sujetos más jóvenes. Otras experiencias clínicas comunicadas no han identificado diferencias en las respuestas entre los pacientes de edad avanzada y los más jóvenes. La absorción sistémica de aciclovir tras la administración tópica es mínima.
Sobredosis
La sobredosis por aplicación tópica de Zovirax Crema es improbable debido a la mínima exposición sistémica. No se dispone de información sobre la sobredosis.
Zovirax Crema Descripción
ZOVIRAX es el nombre comercial de aciclovir, un desoxinucleósido sintético análogo activo frente a los virus del herpes. Zovirax Crema 5% es una formulación para administración tópica.
El nombre químico de aciclovir es 2-amino-1,9-dihidro-9–6H-purina-6-ona; tiene la siguiente fórmula estructural:
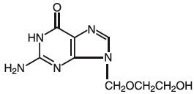
Aciclovir es un polvo blanco y cristalino con la fórmula molecular C8H11N5O3 y un peso molecular de 225. La solubilidad máxima en agua a 37°C es de 2,5 mg/mL. Los pKa de aciclovir son 2,27 y 9,25.
Cada gramo de Zovirax Crema contiene 50 mg (equivalente al 5% en peso) de aciclovir y los siguientes ingredientes inactivos: alcohol cetoestearílico, aceite mineral, poloxámero 407, propilenglicol, lauril sulfato de sodio, agua y vaselina blanca.
Zovirax Crema – Farmacología clínica
Mecanismo de acción
El aciclovir es un fármaco antiviral activo frente a los α-herpesvirus .
Farmacocinética
Se realizó un estudio de farmacología clínica con Zovirax Crema en voluntarios adultos para evaluar la absorción percutánea de aciclovir. En este estudio, en el que participaron 6 voluntarios varones, se aplicó la crema en un área de 710 cm2 en la espalda de los voluntarios 5 veces al día a intervalos de 2 horas durante un total de 4 días. Se midió diariamente el peso de la crema aplicada y la excreción urinaria de aciclovir. La concentración plasmática de aciclovir se analizó 1 hora después de la última aplicación. La excreción urinaria media diaria de aciclovir fue de aproximadamente el 0,04% de la dosis diaria aplicada. Las concentraciones plasmáticas de aciclovir fueron inferiores al límite de detección (0,01 μM) en 5 sujetos y apenas detectables (0,014 μM) en 1 sujeto. La absorción sistémica de aciclovir de Zovirax Crema es mínima en adultos.
No se ha evaluado la absorción sistémica de aciclovir tras la aplicación tópica de la crema en pacientes <18 años de edad.
Microbiología
Mecanismo de acción: Aciclovir es un análogo de desoxinucleósido de purina sintético con actividad inhibidora en cultivo celular e in vivo frente a las ADN polimerasas del VHS tipos 1 (VHS-1) y 2 (VHS-2). Inhibe la replicación del VHS-1 y del VHS-2 en cultivo celular e in vivo.
La actividad inhibidora del aciclovir es selectiva debido a su afinidad por la enzima timidina quinasa (TK) codificada por el VHS. Esta enzima viral convierte el aciclovir en monofosfato de aciclovir, un análogo de los desoxinucleótidos. El monofosfato se convierte además en difosfato por la guanilato quinasa celular y en trifosfato por una serie de enzimas celulares. En los ensayos bioquímicos, el aciclovir trifosfato inhibe la replicación del ADN viral del α-herpes. Esta inhibición se logra de 3 maneras: 1) inhibición competitiva de la ADN polimerasa viral, 2) incorporación a la cadena de ADN viral en crecimiento y terminación de la misma, y 3) inactivación de la ADN polimerasa viral.
Actividad antiviral
La relación cuantitativa entre la susceptibilidad de los virus del herpes a los antivirales en cultivo celular y la respuesta clínica a la terapia no se ha establecido en humanos, y las pruebas de sensibilidad al virus no se han estandarizado. Los resultados de las pruebas de sensibilidad, expresados como la concentración de fármaco necesaria para inhibir en un 50% el crecimiento del virus en el cultivo celular (valor EC50), varían enormemente dependiendo de una serie de factores. Utilizando ensayos de reducción de placas en células Vero, los valores EC50 de aciclovir contra aislados del virus del herpes simple van de 0,09 a 59,9 μM (0,02 a 13,5 μg/mL) para el VHS-1 y de 0.04 a 44,0 μM (0,01 a 9,9 μg/mL) para el VHS-2.
Resistencia
En cultivo celular
Se aislaron cepas de VHS-1 y VHS-2 resistentes al aciclovir en cultivo celular. El VHS resistente al aciclovir fue el resultado de mutaciones en los genes virales de la timidina quinasa (TK; pUL23) y de la ADN polimerasa (POL; pUL30). Se aislaron comúnmente cambios de marco que dan lugar a un truncamiento prematuro del producto TK del VHS, con la consiguiente disminución de la susceptibilidad al aciclovir. Las mutaciones en el gen TK viral pueden conducir a la pérdida completa de la actividad TK (TK negativa), a la reducción de los niveles de actividad TK (TK parcial) o a la alteración de la capacidad de la TK viral para fosforilar el fármaco sin una pérdida equivalente de la capacidad de fosforilar la timidina (TK alterada). En cultivo celular se observaron las siguientes sustituciones asociadas a la resistencia en la TK del VHS-1 y del VHS-2 (Tabla 1).
|
HSV-1 |
TK |
P5A, H7Q, L50V, G56V, G59A, G61A, K62N, T63A, E83K, P84S, D116N, P131S, R163H, A167V, P173L, Q185R, R216S, R220H, T245M, R281stop, T287M, M322K |
|
HSV-2 |
TK |
L69P, C172R, T288M |
|
HSV-1 |
POL |
D368A, Y557S, E597D, V621S, L702H, N815S, V817M, G841C |
|
HSV-2 |
POL |
En pacientes infectados por el VHS
Clínicos del VHS-1 y del VHS-2 obtenidos de pacientes a los que les falló el tratamiento para sus infecciones por α-herpesvirus fueron evaluados para detectar cambios genotípicos en los genes TK y POL y para la resistencia fenotípica al aciclovir (Tabla 2). Se identificaron los aislados de VHS con mutaciones frameshift y sustituciones asociadas a la resistencia en TK y POL. La lista de sustituciones en TK y POL del VHS que conducen a una menor susceptibilidad al aciclovir no es exhaustiva y es probable que se identifiquen cambios adicionales en las variantes del VHS aisladas de pacientes que fracasan en los regímenes que contienen aciclovir. Debe considerarse la posibilidad de una resistencia viral al aciclovir en los pacientes que no responden o experimentan una excreción viral recurrente durante la terapia.
|
HSV-1 |
TK |
G6C, R32H, R41H, R51W, Y53C/D/H, Y53stop, D55N, G56D/S, P57H, H58/N/R/Y, G59R, G61A, K62N, T63I, Q67stop, S74stop, Y80N, E83K, P84L, Y87H, W88R, R89Q/W, E95stop, T103P, Q104H, Q104stop, H105P, D116N, M121L/R, S123R, Q125H, M128L, G129D, I143V, A156V, D162A/H/N, R163G/H, L170P, Y172C, P173L, A174P, A175V, R176Q/W, R176stop, L178R, S181N, V187M, A189V, V192A, G200C/D/S, T201P, V204G, A207P, L208F/H, R216C/H, R220C/H, R221H, R222C/H, L227F, T245M/P, L249P, Q250Stop, C251G, R256W, E257K, Q261R, T287M, L288Stop, L291P/R, L297S, L315S, L327R, C336Y, Q342Stop, T354P, L364P, A365T |
|
HSV-2 |
TK |
R34C, G39E, R51W, Y53N, G59P, G61W, S66P, A72S, D78N, P85S, A94V, N100H, I101S, Q105P, T131P, D137stop, F140L, L158P, S169P, R177W, S182N, M183I, V192M, G201D, R217H, R221C/H, Q222stop, R223H, Y239stop, R271V, P272S, D273R, T287M, C337Y |
|
HSV-1 |
POL |
K532T, Q570R, L583V, A605V, A657T, D672N, V715G, A719T/V, S724N, F733C, E771Q, S775N, L778M, E798K, V813M, N815S, G841S, I890M, G901V, V958L H1228D |
|
HSV-2 |
POL |
E250Q, D307N, K533E, A606V, C625R, R628C, E678G, A724V, S725G, S729N, I731F, Q732R, M789K/T, V818A, N820S, Y823C, Q829R, T843A, M910T, D912N/V, A915V, F923L, T934A, R964H |
Nota: Pueden existir sustituciones adicionales a la resistencia al aciclovir.
Resistencia cruzada
Se ha observado resistencia cruzada entre los aislados del VHS portadores de mutaciones de cambio de marco y sustituciones asociadas a la resistencia, que confieren una susceptibilidad reducida a penciclovir (PCV), famciclovir (FCV) y foscarnet (FOS) .
|
Resistencia cruzada a PCV/FCV |
HSV-1 TK |
G6C, R32H, R51W, Y53C/H, H58N, G61A, S74Stop, E83K, P84L, T103P, Q104Stop, D116N, M121R, I143V, R163H, L170P, Y172C, A174P, R176Q/W, Q185R, A189V, G200D, L208H, R216C, R220H, R222C/H, T245M, Q250Stop, R256W, R281Stop, T287M, L315S, M322K, C336Y |
|
Resistencia cruzada a PCV/FCV |
HSV-1 POL |
A657T, D672N, V715G, A719V, S724N, E798K, N815S, G841S |
|
Resistencia cruzada a PCV/FCV |
HSV-2 TK |
G39E, R51W, Y53N, R177W, R221H, T288M |
|
Resistencia cruzada a PCV/FCV |
HSV-2 POL |
K533E, A606V, C625R, R628C, S729N, Q732R, M789K/T, V818A, N820S, F923L, T934A |
|
Resistencia cruzada a FOS |
HSV-1 POL |
D368A, A605V, D672N, L702H, V715G, A719T/V, S724N, L778M, E798K, V813M, N815S, V817M, G841C/S, I890M, |
|
Resistencia cruzada a FOS |
HSV-2 POL |
K533E, A606V, C625R, R628C, A724V, S725G, S729N, I731F, Q732R, M789K/T, V818A, Y823C, D912V, F923L, T934A, R964H |
Toxicología no clínica
Carcinogénesis, mutagénesis, alteración de la fertilidad
La exposición sistémica tras la administración tópica de aciclovir es mínima. No se realizaron estudios de carcinogenicidad dérmica. Los resultados de los estudios de carcinogénesis, mutagénesis y fertilidad no se incluyen en la información completa de prescripción de Zovirax Crema debido a las exposiciones mínimas de aciclovir que resultan de la aplicación dérmica. La información sobre estos estudios está disponible en la información de prescripción completa de ZOVIRAX Cápsulas, Comprimidos y Suspensión y ZOVIRAX para Inyección.
Estudios Clínicos
Sujetos Adultos
Zovirax Crema fue evaluado en dos ensayos doble ciego, aleatorizados y controlados con placebo (vehículo) para el tratamiento del herpes labial recurrente. El paciente medio había tenido cinco episodios de herpes labial en los 12 meses anteriores. En el primer ensayo, la edad media de los sujetos era de 37 años (rango de 18 a 81 años), el 74% eran mujeres y el 94% eran caucásicos. En el segundo ensayo, la edad media de los sujetos fue de 38 años (rango de 18 a 87 años), el 73% eran mujeres y el 94% eran caucásicos. Se indicó a los sujetos que iniciaran el tratamiento en el plazo de 1 hora tras notar los signos o síntomas y que continuaran el tratamiento durante 4 días, con la aplicación de la medicación del estudio 5 veces al día. En ambos estudios, la duración media del episodio de herpes labial recurrente fue aproximadamente medio día más corta en los sujetos tratados con Zovirax Crema (n = 682) en comparación con los sujetos tratados con placebo (n = 703) durante aproximadamente 4,5 días frente a 5 días, respectivamente. No se observaron diferencias significativas entre los sujetos que recibieron Zovirax Crema o placebo en la prevención de la progresión de las lesiones del herpes labial.
Sujetos pediátricos
Se realizó un ensayo abierto y no controlado con Zovirax Crema en 113 pacientes de 12 a 17 años con herpes labial recurrente. En este ensayo, la terapia se aplicó utilizando el mismo régimen de dosificación que en los adultos y se realizó un seguimiento de los sujetos para detectar acontecimientos adversos. El perfil de seguridad fue similar al observado en adultos.
Cómo se suministra/conservación y manipulación
Cada gramo de Zovirax Crema contiene 50 mg (equivalente al 5% en peso) de aciclovir en una base de crema acuosa. Zovirax Crema se suministra de la siguiente manera:
NDC 0187-0994-45: Tubos de 5 g
Conservar a una temperatura igual o inferior a 25°C (77°F); se permiten excursiones a 15° a 30°C (59° a 86°F) .
Información de asesoramiento al paciente
Aconsejar al paciente que lea el etiquetado aprobado por la FDA (Información al paciente).
Generalidades
Se debe informar a los pacientes de que Zovirax Crema es una crema tópica de prescripción para el tratamiento del herpes labial (herpes recurrente) que se produce en la cara y los labios. Zovirax Crema no es una cura para el herpes labial. Los pacientes deben ser informados de que Zovirax Crema está destinado al uso cutáneo sólo para el herpes labial de los labios y alrededor de la boca. Se debe advertir a los pacientes que Zovirax Crema no debe utilizarse en los ojos, dentro de la boca o la nariz, ni en los genitales. Se debe indicar a los pacientes que eviten la aplicación de otros productos tópicos en la zona afectada mientras utilicen Zovirax Crema.
No lo utilice si es alérgico a Zovirax Crema o a cualquiera de los ingredientes de Zovirax Crema. Antes de utilizar Zovirax Crema, informe a su médico si está embarazada, planea quedarse embarazada o está dando el pecho.
Instrucciones de uso
El tratamiento debe iniciarse al primer signo o síntoma de reaparición. Indique a los pacientes que se laven las manos antes de la aplicación y que se aseguren de que la cara y/o los labios están limpios y secos. Aconsejar a los pacientes que se apliquen Zovirax Crema por vía tópica 5 veces al día durante 4 días. Indique a los pacientes que apliquen tópicamente una cantidad de Zovirax Crema suficiente para cubrir la zona afectada, incluido el margen exterior. Aconseje a los pacientes que eviten frotar innecesariamente la zona afectada para evitar agravar o transferir la infección. Indique a los pacientes que se laven las manos con agua y jabón después de utilizar Zovirax Crema. Mantener fuera del alcance de los niños.
Posibles efectos secundarios
Los efectos secundarios comunes relacionados con la piel que se produjeron al aplicar Zovirax Crema incluyen reacciones en el lugar de aplicación. Zovirax Crema tiene un potencial de irritación y sensibilización por contacto.
Distribuido por: Bausch Health US, LLC
Bridgewater, NJ 08807 USA
Fabricado por: Bausch Health Companies Inc.
Laval, Quebec H7L 4A8, Canadá
Zovirax es una marca registrada del grupo de empresas GlaxoSmithKline y utilizada bajo licencia por Bausch Health.
© 2020 Bausch Health Companies Inc. o sus filiales
9462203
INFORMACIÓN PARA EL PACIENTEZOVIRAX (zho-vahy-rex)(acyclovir)Crema
Información importante: Zovirax Crema es para uso en herpes labial en los labios y alrededor de la boca solamente. Zovirax Crema no debe utilizarse en los ojos, la boca, la nariz o los genitales.
¿Qué es Zovirax Crema?
– Zovirax Crema es un medicamento de prescripción utilizado para tratar el herpes labial (herpes labial) recurrente en adultos y niños de 12 años o más, y que tienen sistemas inmunológicos normales. – Zovirax Crema no es una cura para el herpes labial.
No se sabe si Zovirax Crema es seguro y eficaz en niños menores de 12 años.
No utilice Zovirax Crema si es alérgico a aciclovir, valaciclovir o a cualquiera de los componentes de Zovirax Crema. Consulte el final de este prospecto para obtener una lista completa de los ingredientes de Zovirax Crema.
¿Qué debo decirle a mi proveedor de atención médica antes de usar Zovirax Crema?
Antes de usar Zovirax Crema, informe a su proveedor de atención médica sobre todas sus condiciones médicas, incluyendo si usted:
– se enferma muy fácilmente (tiene un sistema inmunológico débil). – está embarazada o planea quedarse embarazada. No se sabe si Zovirax Crema puede dañar al feto. – está amamantando o planea amamantar. No se sabe si Zovirax Crema pasa a la leche materna. Hable con su proveedor de atención médica sobre la mejor manera de alimentar a su bebé si utiliza Zovirax Crema.
Informe a su proveedor de atención médica sobre todos los medicamentos que toma, incluidos los medicamentos recetados y sin receta, las vitaminas y los suplementos de hierbas.
¿Cómo debo utilizar Zovirax Crema?
– Utilice Zovirax Crema exactamente como su proveedor de atención médica le indique. – Utilice Zovirax Crema tan pronto como tenga los primeros síntomas de un herpes labial como picor, enrojecimiento, ardor u hormigueo, o cuando aparezca el herpes labial. – Lávese las manos con agua y jabón antes y después de aplicar Zovirax Crema. – La zona afectada debe estar limpia y seca antes de aplicar Zovirax Crema. – Aplique Zovirax Crema en la zona afectada 5 veces al día durante 4 días, incluyendo el borde exterior. – No debe aplicar otros productos para la piel en la zona afectada durante el tratamiento con Zovirax Crema. – Evite frotar innecesariamente el herpes labial porque esto puede hacer que el herpes labial se extienda a otras zonas alrededor de su boca o que empeore su herpes labial.
¿Cuáles son los posibles efectos secundarios de Zovirax Crema?
Los efectos secundarios más frecuentes de Zovirax Crema son reacciones cutáneas en el lugar de tratamiento y pueden incluir: labios secos o agrietados, descamación, descamación o sequedad de la piel, sensación de quemazón o picor.
Estos no son todos los posibles efectos secundarios de Zovirax Crema. Llame a su médico para que le aconseje sobre los efectos secundarios. Puede informar de los efectos secundarios a la FDA en el teléfono 1-800-FDA-1088.
¿Cómo debo conservar Zovirax Crema?
– Conserve Zovirax Crema a temperatura ambiente entre 68° y 77°F (20° y 25°C).
Mantenga Zovirax Crema y todos los medicamentos fuera del alcance de los niños.
Información general sobre el uso seguro y eficaz de Zovirax Crema.
A veces se prescriben medicamentos para fines distintos a los indicados en un folleto de información al paciente. No utilice Zovirax Crema para una afección para la que no ha sido prescrito. No dé Zovirax Crema a otras personas, aunque tengan los mismos síntomas que usted. Puede perjudicarles. Puede pedir a su farmacéutico o profesional sanitario información sobre Zovirax Crema escrita para profesionales de la salud.
¿Cuáles son los ingredientes de Zovirax Crema?
Ingrediente activo: aciclovir
Ingredientes inactivos: alcohol cetoestearílico, aceite mineral, poloxámero 407, propilenglicol, lauril sulfato de sodio, agua y vaselina blanca
Distribuido por: Bausch Health US, LLC
Bridgewater, NJ 08807 USA
Fabricado por: Bausch Health Companies Inc.
Laval, Quebec H7L 4A8, Canadá
Zovirax es una marca registrada del grupo GlaxoSmithKline utilizada bajo licencia por Bausch Health.
© 2020 Bausch Health Companies Inc. o sus filiales
Para más información, llame al 1-800-321-4576.
Esta información para el paciente ha sido aprobada por la Administración de Alimentos y Medicamentos de los Estados Unidos.
Revisado: 12/2020
9462203
PANEL DE PRESENTACIÓN PRINCIPAL – Tubo de cartón de 5 g
ZOVIRAX®
(ACYCLOVIR) CREMA 5%
NDC 0187-0994-45
Peso neto. 5 g
Cada gramo contiene:
50 mg de aciclovir, alcohol cetoestearílico, aceite mineral, poloxámero 407, propilenglicol, lauril sulfato de sodio, agua y vaselina blanca.
USAR SÓLO PARA LAS DOLORES FRÍOS.
SÓLO PARA USO CUTÁNEO.
Ortho Dermatologics
Sólo con receta
| ZOVIRAX crema de aciclovir |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Etiquetador – Bausch Health US, LLC (831922468)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Bausch Health Companies Inc. | 245141858 | MANUFACTURA(0187-0994) | |
Más información sobre Zovirax Crema (aciclovir tópico)
- Efectos secundarios
- Durante el embarazo o la lactancia
- Información sobre la dosis
- Interacciones con otros medicamentos
- Precios &Cupones
- 39 opiniones
- Clase de medicamentos: antivirales tópicos
Recursos para el consumidor
- Información para el paciente
Recursos para el profesional
- Información para la prescripción
- Ungüento de aciclovir (FDA)
Otras formulaciones
- Zovirax
- Una pomada de Zovirax
Guías de tratamiento relacionadas
- Herpes simple
- Llorones
Descargo de responsabilidad médica