- El sistema inmunitario
- Respuesta inmunitaria innata y adaptativa
- Componentes del sistema inmunitario
- Células linfoides
- Las células T
- Células B
- Células NK
- Células mieloides
- Macrófagos
- Células dendríticas
- Otras células inmunitarias innatas y señalización
- Inmunología en la salud y la enfermedad
- Inmunología del cáncer
El sistema inmunitario
El sistema inmunitario está compuesto por tejidos, células y moléculas cuya función principal es detectar, responder y eliminar patógenos y células transformadas.
Respuesta inmunitaria innata y adaptativa
Hay dos componentes principales del sistema inmunitario-1) el sistema inmunitario innato y 2) el sistema inmunitario adaptativo. El sistema inmunitario innato actúa como primera línea de defensa y detecta los patógenos a través de los receptores de reconocimiento de patrones codificados por la línea germinal, no forma memoria y responde rápidamente (en cuestión de minutos u horas). El sistema inmunitario adaptativo responde lentamente (a lo largo de días), utiliza receptores específicos de antígenos que pasan por múltiples reordenamientos genéticos durante su desarrollo y forma memoria inmunológica, «aprendiendo» de la agresión inicial y preparando al organismo para luchar contra futuras exposiciones a materiales nocivos similares. Ambos tipos de respuestas inmunitarias pueden ser impulsadas por macromoléculas del líquido extracelular o por la activación de células inmunitarias específicas. Estas respuestas se conocen como inmunidad humoral e inmunidad mediada por células, respectivamente.
Bajo el paraguas de la respuesta inmunitaria mediada por células, las células inmunitarias se estratifican principalmente en función de si la respuesta es innata o adaptativa. El sistema inmunitario innato está formado principalmente por células fagocíticas, como los neutrófilos, los macrófagos, las células asesinas naturales, los basófilos y otras que se dirigen a los organismos invasores peligrosos. Las células del sistema inmunitario adaptativo son las células T y las células B. Las células T asesinas naturales (NK) tienen características tanto de las células inmunitarias innatas como de las adaptativas. Además, la mayoría de los demás tipos celulares, no específicos del sistema inmunitario, pueden albergar funciones inmunitarias innatas intrínsecas en forma de receptores citoplasmáticos y moléculas de señalización y efectoras, como los miembros de las familias RIG-I, STING y NLR. Como revisaremos más adelante, las células de ambos sistemas surgen de diferentes linajes mieloides y linfoides de células madre hematopoyéticas.
Componentes del sistema inmunitario
Las células inmunitarias maduras se diferencian de lo que se conoce como células madre hematopoyéticas. Se trata de células progenitoras indiferenciadas pluripotentes que se encuentran en la médula ósea, la sangre periférica y la placenta. Estas células madre hematopoyéticas pueden diferenciarse en la célula progenitora mieloide común o en la célula progenitora linfoide común.
Células linfoides
Las células progenitoras linfoides comunes pueden diferenciarse en cuatro poblaciones principales de linfocitos que pueden distinguirse por la expresión del receptor de la superficie celular: Células T, células B, células asesinas naturales (NK) y células NK-T.
Las células T
desempeñan un papel fundamental en la inmunidad mediada por células. Estas células se identifican por la expresión de las cadenas de señalización de las células T CD3.
Las células T surgen de células progenitoras linfoides que se desarrollan originalmente a partir de células madre hematopoyéticas en la médula ósea. Una vez que el progenitor linfoide se compromete a convertirse en una célula T, migra de la médula ósea al timo (de ahí el nombre de célula T). El timo proporciona el microentorno adecuado en el que las células T pueden convertirse en sus distintos subtipos, definidos por los receptores específicos expresados en la superficie celular. Los linfocitos T en fase de maduración, o timocitos, carecen de receptores para CD4 y CD8, por lo que se denominan células doblemente negativas (DN). Las células DN sufren entonces reordenamientos genéticos y mutaciones en los genes que codifican los receptores de células T alfa y beta (TCR), lo que les hace emprender un camino de compromiso de linaje por el que el resultado final es un receptor de células T con afinidad específica por un antígeno único.
Los timocitos se seleccionan entonces, tanto positiva como negativamente, para asegurar que reconocen los antígenos «extraños» pero no los antígenos del huésped, que se presentan como péptidos a través del MHC en la superficie celular. Sólo las células que superen ambas pruebas serán activadas para expresar CD4 y CD8, convirtiéndose en células doblemente positivas. Al final de la maduración, las células T expresarán CD4 o CD8 (y perderán la expresión del otro) y se convertirán así en células unipositivas. Estas células T maduras CD4 o CD8-positivas se liberan entonces en el torrente sanguíneo y se encuentran inicialmente en estado ingenuo, lo que significa que aún no se han comprometido con un subtipo particular de células T.
Si el timocito maduro muestra una cantidad intermedia de afinidad por los péptidos MHC propios durante la maduración, entonces puede ser seleccionado para convertirse en una célula T reguladora (Treg) por su capacidad de reconocer antígenos «propios» dañinos. Las células T de la sangre o de los tejidos periféricos también pueden ser inducidas localmente para convertirse en Tregs. El principal trabajo de las Tregs es mantener la tolerancia a los antígenos propios, así como limitar la función y la proliferación de las células T efectoras.
Una vez que llegan a la sangre o al tejido periférico, las células T ingenuas pueden ser inducidas a convertirse en células T auxiliares. Las células presentadoras de antígeno (APC), como los macrófagos, las células dendríticas y las células B, mostrarán el antígeno a la célula T, y si su receptor tiene afinidad la célula T reconocerá el antígeno. Normalmente, las células T CD4+ son adecuadas para reconocer antígenos peptídicos unidos a proteínas MHC de clase II. Una vez reconocido el complejo péptido-MHC, la célula T activará una serie de vías internas que permiten verificar el reconocimiento del antígeno. Sólo entonces la célula T colaboradora proliferará, ampliando el conjunto de células disponibles que son específicas para el antígeno dañino, como diferentes bacterias y parásitos.
Una vez que las células T auxiliares han reconocido su antígeno y se han activado, liberarán una serie de citoquinas, que son moléculas que indican a otras células inmunitarias cómo responder adecuadamente a la molécula dañina. Existen varios subconjuntos de células T auxiliares, como Th1, Th2 y Th17. Estos subconjuntos producen y segregan citoquinas distintas que ayudan a adaptar la respuesta inmunitaria en función del tipo de patógeno. Por ejemplo, las células Th1 dependen de la citocina efectora IFN-γ para indicar a los macrófagos que digieran y destruyan el material dañino, mientras que las células Th2 segregan una combinación de IL-4, IL-5, IL-9, IL-10 e IL-13 para desencadenar que los basófilos, eosinófilos y otras células ataquen la infección. La cantidad y las variedades específicas de citoquinas determinarán la respuesta adecuada a la infección o a la célula dañina. Las células T también pueden responder a las células propias convirtiéndose en células T citotóxicas (o células T asesinas naturales). Normalmente se trata de células CD8+ que reconocen las células infectadas por virus o las células tumorales. Las células T asesinas naturales (NKT) se tratarán con más detalle en una sección posterior. Estos y otros tipos de células T desempeñan sus diversas tareas o funciones efectoras de forma dispar para reconocer material dañino y reclutar otras células inmunitarias para destruirlo, así como para crear una respuesta inmunitaria duradera al mismo tipo de insulto.
La vía interactiva de señalización del receptor de células T se revisa en detalle aquí.
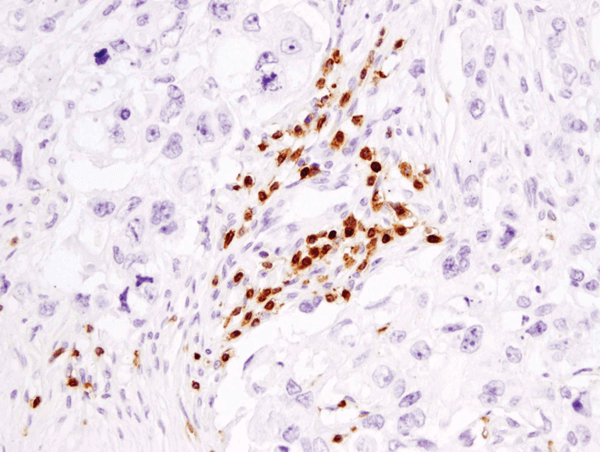
CD3ε (D7A6E™) XP® Rabbit mAb #85061: Análisis IHC de carcinoma de mama humano embebido en parafina utilizando #85061.
CD3ε (D7A6E™) XP® Rabbit mAb #85061: Análisis IHC de carcinoma de mama humano embebido en parafina utilizando #85061.
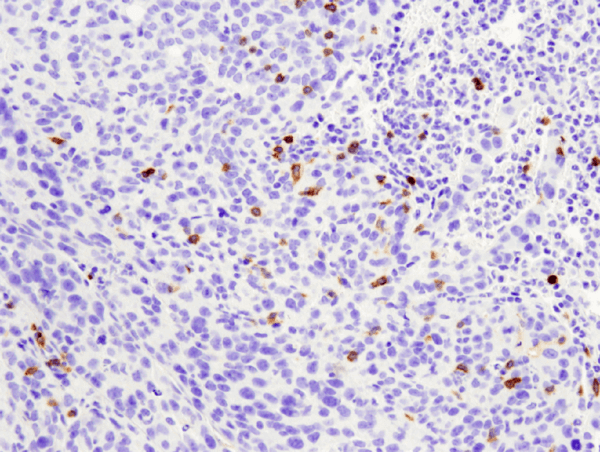
CD4 (D7D2Z) Rabbit mAb #25229: Análisis IHC de tumor metastásico 4T1 embebido en parafina en pulmón de ratón usando #25229.
CD4 (D7D2Z) Rabbit mAb #25229: Análisis IHC de tumor metastásico 4T1 embebido en parafina en pulmón de ratón usando #25229.
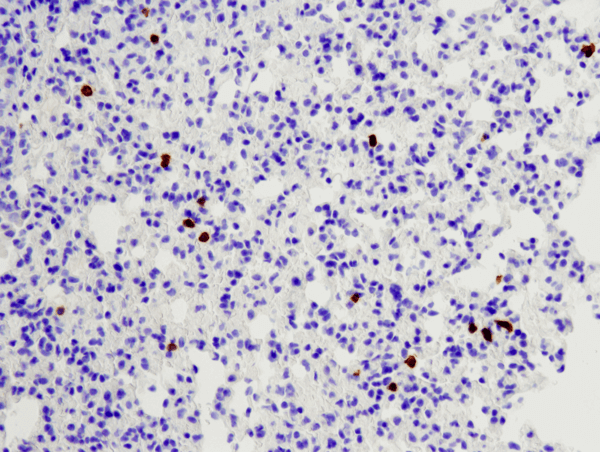
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: Análisis IHC de pulmón de ratón embebido en parafina utilizando #98941.
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: Análisis IHC de pulmón de ratón embebido en parafina utilizando #98941.
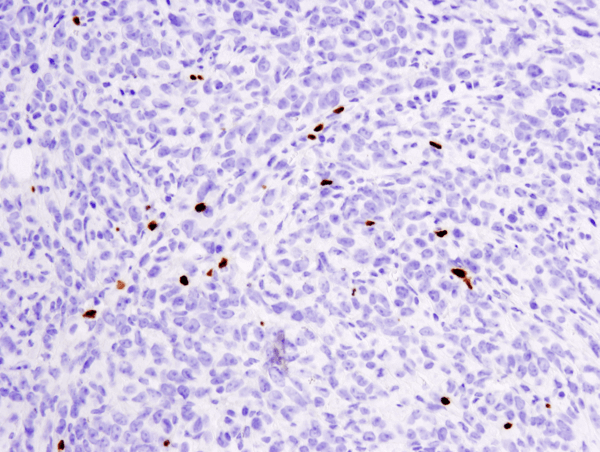
FoxP3 (D6O8R) Rabbit mAb #12653: Análisis IHC de tumor metastásico 4T1 embebido en parafina en pulmón de ratón usando #12653.
FoxP3 (D6O8R) Rabbit mAb #12653: Análisis IHC de tumor metastásico 4T1 embebido en parafina en pulmón de ratón usando #12653.
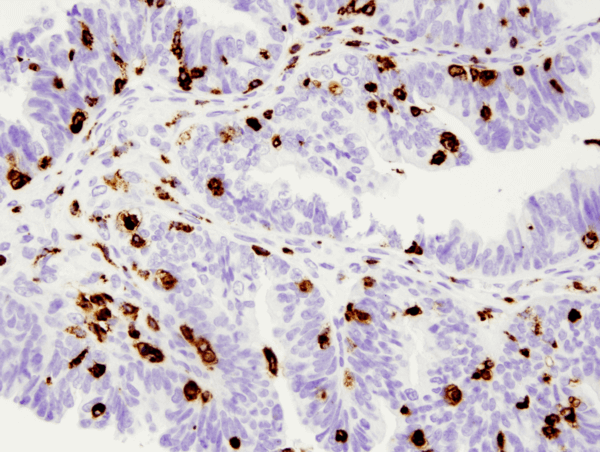
Células B
Las células B son las células críticas en la sangre que median la producción de anticuerpos. Cuando el material nocivo está presente en el torrente sanguíneo, es reconocido como un antígeno por los receptores específicos de las células B. A continuación, tras procesar el antígeno, y con la ayuda de las células T, la célula B madura en células plasmáticas que secretan anticuerpos. Las células B también pueden desempeñar un papel en la presentación de antígenos y en la secreción de citoquinas. Se discutirán tanto el desarrollo como las diversas funciones de las células B.
El 15% de los leucocitos que se encuentran en la sangre periférica son células B. Las células B producen inmunoglobulinas (Ig), que son proteínas de unión a antígenos (también conocidas como anticuerpos) compuestas por dos cadenas pesadas idénticas y dos cadenas ligeras idénticas. Estas inmunoglobulinas contienen sitios específicos de unión al antígeno que varían en la secuencia de aminoácidos de una molécula de anticuerpo a otra. Estos sitios confieren la especificidad de cada anticuerpo para el reconocimiento de un antígeno distinto.
Como se ha mencionado anteriormente, las células B se diferencian de las células hematopoyéticas que se encuentran en la médula ósea. Es dentro de la médula ósea donde se ensamblan los receptores Ig de superficie (anticuerpos) a través de un proceso de reordenamiento de genes. Las células B utilizan la unión somática de diferentes genes en una multitud de cromosomas que codifican las diferentes partes de las cadenas pesadas y ligeras que componen las Ig. Las células B son empujadas hacia la diferenciación mediante la producción de IL-7 por parte de las células estromales de la médula ósea. Estos linfocitos B en desarrollo siguen un programa de reordenamiento secuencial de las cadenas pesadas y ligeras mediado por la expresión diferencial de los receptores de la superficie celular. Por ejemplo, la expresión de un receptor específico de células pre-B evita ciertos reordenamientos genéticos en cromosomas no relacionados para asegurar que la célula B madura pueda expresar un determinado receptor de superficie de Ig capaz de reconocer específicamente un único antígeno. Este proceso se denomina exclusión alélica. El ensamblaje incorrecto de las cadenas pesadas y ligeras de Ig puede inducir un reordenamiento secundario para la edición del receptor.
Además de la expresión en la superficie celular de un receptor de Ig, las células B también contienen proteínas transmembrana que pueden inducir señales intracelulares después de que un antígeno se una a la porción extracelular del receptor de Ig. Las células B utilizan cascadas de señalización intracelular similares a las de las células T que inducen cambios transcripcionales que conducen a la proliferación y maduración. Específicamente, los dominios intracelulares del receptor de Ig pueden ser fosforilados por la familia src de quinasas, iniciando una cascada que es transmitida por la tirosina quinasa Syk y una proteína de enlace conocida como BLINK a la fosfolipasa C y a los factores de intercambio de guanina, activando finalmente la proteína quinasa C, movilizando el calcio y activando la MAP quinasa de una manera dependiente de Ras/Rac.
Una característica única de los linfocitos B es su capacidad de cambiar de isotipo. Esto se refiere específicamente a un proceso de reordenación del ADN que puede generar cadenas pesadas ligeramente diferentes. Además, el empalme alternativo de los exones de la cadena pesada puede permitir que la Ig permanezca unida a la superficie de la célula o que sea secretada si se empalma el exón transmembrana. El splicing alternativo y el cambio de isotipo son inducidos por las citoquinas derivadas de las células T. Además, las células T pueden inducir mutaciones somáticas que conducen a cambios en los sitios de unión al antígeno de las Ig de las células B. Una función autocorrectiva de las células B puede detectar si estas mutaciones aparentemente aleatorias conducen a una pérdida de afinidad por el antígeno e inician un programa de muerte celular. Así, los antígenos que activan tanto las células T como las células B desencadenan la maduración de las células B mediada por las células T a través del cambio de isotipo y las mutaciones somáticas, ambos altamente asociados con la memoria de las células B.
Las respuestas de memoria se caracterizan por una rápida y extensa producción de Ig de alta afinidad a dichos antígenos. El desarrollo de estas respuestas de memoria son críticas para el éxito de la vacunación. Sin embargo, también pueden aumentar la autoinmunidad y las reacciones alérgicas.
También puede producirse una activación de las células B independiente de las células T por un antígeno; sin embargo, este tipo de activación está relacionada con una memoria inmunitaria débil. Además, estos antígenos deben ser poliméricos para poder activar las células B.
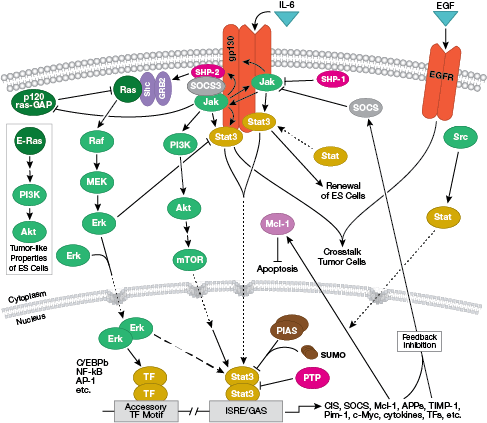
NB: Las citocinas, o interleucinas (IL), son moléculas secretadas que actúan sobre receptores transmembrana de la superficie celular. Al unirse, estas citoquinas activan vías de transducción de señales intracelulares que suelen depender de la señalización Jak-STAT.
La vía interactiva de señalización del receptor de células B se revisa en detalle aquí.
CD19 (D4V4B) XP® Rabbit mAb #90176: Análisis IHC de carcinoma de pulmón humano embebido en parafina utilizando #90176.
CD19 (D4V4B) XP® Rabbit mAb #90176: Análisis IHC de carcinoma de pulmón humano embebido en parafina usando #90176.
Células NK
Las células asesinas naturales, o NK, son otro tipo celular derivado del linaje linfoide. Al igual que las células B, se desarrollan en la médula ósea de forma dependiente de las citoquinas y de las células estromales de la médula ósea. Representan una pequeña proporción de la sangre periférica y no tienen receptores específicos de antígeno. En cambio, las células NK dependen de un complejo conjunto de receptores transmembrana. En particular, contienen receptores inhibidores de la superficie celular que reconocen las moléculas HLA de clase I y, por lo tanto, son inhibidas por las moléculas MHC propias, matando sólo a las células que han disminuido la expresión de HLA de clase I. Por lo tanto, cumplen el importante propósito de dirigirse a las células infectadas por virus y a las células tumorales cuya expresión de HLA de clase I está regulada a la baja para evadir la muerte por parte de las células T asesinas naturales (NK-T) CD8+. Las células NK también pueden activarse de forma dependiente de anticuerpos, interferones o citoquinas y, por tanto, pueden desempeñar un papel importante en la lucha contra los tumores. El mecanismo de acción de las células NK se basa en la liberación de pequeños gránulos que contienen granzimas y perforina desde su citoplasma. Tras su liberación, estas proteínas pueden hacer poros y romper las proteínas intracelulares para inducir la apoptosis. Como tal, se dice que las células NK son citotóxicas.
Las células NK-T son un subtipo especial de células T que expresan ciertos receptores y marcadores típicamente expresados por las células NK en combinación con un repertorio limitado de receptores de células T. Por lo tanto, este subtipo único comparte propiedades tanto de las células T como de las células NK. A diferencia de las células NK, que se desarrollan en la médula, las células NK-T se desarrollan en el timo.
Células mieloides
Las células progenitoras mieloides comunes, que son descendientes de las células madre hematopoyéticas, dan lugar a varios tipos diferentes de células mieloides, incluidos los macrófagos, las células dendríticas y varias otras células inmunitarias innatas y células sanguíneas.
Macrófagos
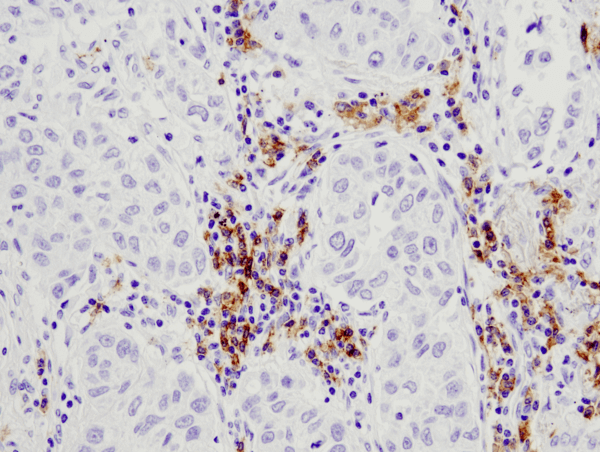
Los macrófagos pueden ser activados para reconocer antígenos, como células dañadas o material extraño, para su destrucción a demanda. Los macrófagos están presentes en la mayoría de los tejidos y responden cuando es necesario a las infecciones y a las células moribundas. El material reconocido se destruye mediante fagocitosis en el macrófago, lo que da a las células su nombre («gran comedor» en griego). Los macrófagos adoptan diversas formas cuando están presentes en diferentes lugares y pueden realizar otras funciones además de la fagocitosis.
Al producirse una lesión tisular o una infección por patógenos, los monocitos de la sangre son reclutados hacia el tejido afectado y se diferencian para formar macrófagos. Dependiendo de la localización tisular, existen diferentes tipos de macrófagos, como las células de Kupffer en el hígado, los macrófagos alveolares en el pulmón, la microglía en el cerebro, etc. Estos diferentes tipos de macrófagos proceden todos de los monocitos pero especializan su función en el tejido residente. La mayor parte de la función general de fagocitosis la llevan a cabo los macrófagos residentes del tejido. Además de fagocitar células muertas y material extraño, los macrófagos también pueden enviar señales a otras células inmunitarias a través de citoquinas. Hasta cierto punto, los macrófagos desempeñan la función crítica de la presentación de antígenos y, en consecuencia, trabajan junto con las células T para apoyar la inmunidad adaptativa. Además, los macrófagos pueden secretar citocinas como la IL-12 y desempeñar un papel en las respuestas inmunitarias locales, mientras que otros secretan grandes cantidades de IL-10, que media su papel en la reparación de tejidos. Así pues, los «grandes comedores» desempeñan diversas funciones en el sistema inmunitario, además de la tarea principal de fagocitación.
CD68 (D4B9C) XP® Rabbit mAb #76437: Análisis IHC de un carcinoma papilar seroso de ovario humano embebido en parafina utilizando #76437.
CD68 (D4B9C) XP® Rabbit mAb #76437: Análisis IHC del carcinoma papilar seroso humano de ovario embebido en parafina utilizando #76437.
CD163 (D6U1J) Rabbit mAb #93498: Análisis IHC de carcinoma de pulmón de células no pequeñas humano embebido en parafina usando #93498 realizado en el Leica® Bond™ Rx.
CD163 (D6U1J) Rabbit mAb #93498: Análisis IHC de carcinoma de pulmón de células no pequeñas humano embebido en parafina usando #93498 realizado en el Leica® Bond™ Rx.
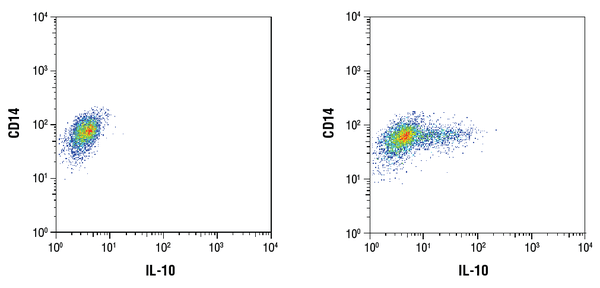
IL-10 (D13A11) XP® Rabbit mAb #12163: Análisis de citometría de flujo de células mononucleares de sangre periférica humana CD14+ purificadas sin tratar (izquierda) o tratadas con LPS (100ng/mL, 16 h; derecha) utilizando un anticuerpo CD14 y #12163. Se añadió Brefeldin A #9972 (300ng/mL) a las células no tratadas y tratadas después de 1 hora de estimulación con LPS. Como anticuerpo secundario se utilizó el anticuerpo IgG de conejo (H+L), fragmento F(ab’)2 (conjugado con Alexa Fluor® 647) #4414.
IL-10 (D13A11) XP® Rabbit mAb #12163: Análisis de citometría de flujo de células mononucleares de sangre periférica humana CD14+ purificadas sin tratar (izquierda) o tratadas con LPS (100ng/mL, 16 h; derecha) utilizando un anticuerpo CD14 y #12163. Se añadió Brefeldin A #9972 (300ng/mL) a las células no tratadas y tratadas después de 1 hora de estimulación con LPS. Como anticuerpo secundario se utilizó el anticuerpo IgG de conejo (H+L), fragmento F(ab’)2 (conjugado con Alexa Fluor® 647) #4414.
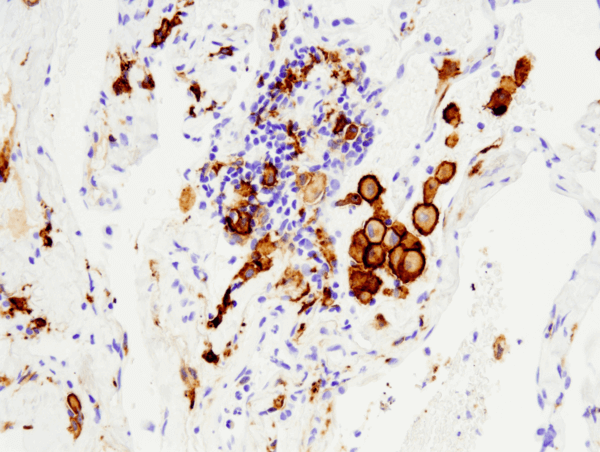
Células dendríticas
Al igual que los macrófagos, las células dendríticas tienen la capacidad de engullir material celular y extraño, pero en lugar de digerirlo para su eliminación, las células dendríticas procesan el material y lo presentan como antígenos a las células T. Como tales, las células dendríticas sirven como células presentadoras de antígenos, o células accesorias, y así transmiten información sobre los patógenos entre los sistemas inmunitarios innato y adaptativo. Las células dendríticas reciben su nombre de sus distintas proyecciones celulares que se extienden y agarran el material dañino para ser digerido.
Las células dendríticas, que surgen de los progenitores hematopoyéticos de la médula ósea, pasan inicialmente por una fase de «aprendizaje» en la que toman muestras de material extraño en su área local e inician una respuesta de reconocimiento a través de receptores de reconocimiento de patrones (un conjunto común de estos receptores son los receptores tipo Toll). Estas células dendríticas inmaduras pueden residir en diferentes lugares con acceso al entorno externo, como el revestimiento de la nariz, el estómago, los pulmones e incluso en la piel. Tras reconocer el antígeno, las células dendríticas migrarán al ganglio linfático, donde entrenarán a las células T para que reconozcan el antígeno y respondan en consecuencia. Las células dendríticas son las únicas células presentadoras de antígenos que activan tanto las células T de memoria como las ingenuas. Los receptores tipo Toll son una clase de receptores bien estudiados presentes en los macrófagos y las células dendríticas, que median el reconocimiento y la respuesta a los patógenos extraños. Además de interactuar directamente con las células T, las células dendríticas también pueden enviar señales a través de citoquinas como la IL-12, que actúa para preparar al sistema inmunitario para el posterior ataque al material dañino. Otros tipos de células dendríticas pueden segregar citoquinas que señalan el reclutamiento de más macrófagos para limpiar una sobrecarga de material de desecho. Como principales mediadores celulares para la presentación de antígenos, las células dendríticas desempeñan así un papel indispensable en la diafonía entre los sistemas inmunitarios innato y adaptativo.
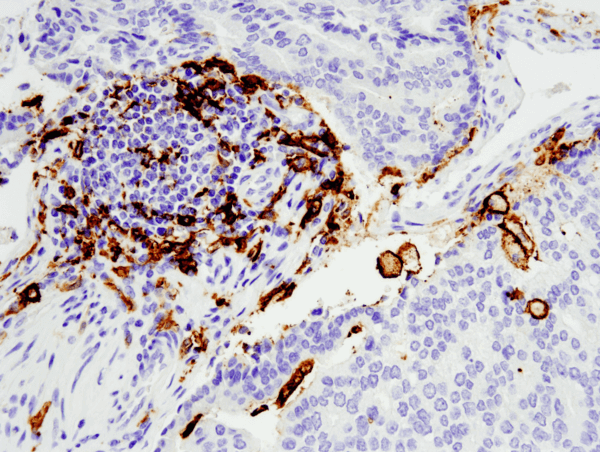
CD11c (D3V1E) XP® Rabbit mAb #45581: Análisis IHC de adenocarcinoma de próstata humano embebido en parafina utilizando #455812 realizado en el Leica® Bond™ Rx.
CD11c (D3V1E) XP® Rabbit mAb #45581: Análisis IHC de adenocarcinoma de próstata humano embebido en parafina utilizando #455812 realizado en el Leica® Bond™ Rx.
Otras células inmunitarias innatas y señalización
Otras células del sistema inmunitario innato incluyen los mastocitos, que funcionan en la curación de heridas y ayudan a proporcionar una protección contra los patógenos. Cuando son desencadenados por un patógeno, los mastocitos pueden segregar citoquinas, así como gránulos que contienen histamina y heparina, que median la respuesta inmunitaria posterior, como el reclutamiento de macrófagos y la dilatación de los vasos sanguíneos. Los neutrófilos, eosinófilos y basófilos se denominan colectivamente granulocitos debido a los gránulos característicos de su citoplasma. En los neutrófilos, los gránulos actúan para liberar compuestos tóxicos que se dirigen a patógenos como hongos y bacterias.
Inmunología en la salud y la enfermedad
Inmunología del cáncer
Aprovechar las células inmunitarias para combatir el cáncer se ha convertido en un tema de investigación muy candente debido al éxito en la clínica. Un enfoque reciente de la inmunoterapia actual consiste en dirigirse a las proteínas de punto de control de señalización, como la PD-1, que normalmente impiden la activación y la respuesta de las células T. La terapia celular adoptiva es otro enfoque interesante que implica la inmunoedición de células T obtenidas del paciente. Las células T se modifican para que expresen un receptor de antígeno quimérico específico para las células cancerosas del paciente. Las células T se reinfunden en el paciente y ahora están programadas para buscar las células cancerosas y eliminarlas, de acuerdo con la función normal de las células T. Estos y otros enfoques para manipular el sistema inmunitario con el fin de que ataque a las células cancerosas dañinas del paciente representan una clase innovadora de terapias para tratar el cáncer.