Vattenkemi 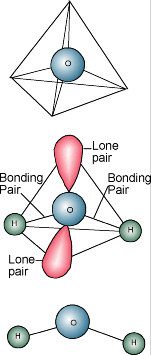 Du vet säkert att vattens kemiska beteckning är H2O. En vattenmolekyl består av en syreatom bunden till två väteatomer. Väteatomerna är ”fästa” på ena sidan av syreatomen, vilket resulterar i att en vattenmolekyl har en positiv laddning på den sida där väteatomerna finns och en negativ laddning på den andra sidan, där syreatomen finns. Eftersom motsatta elektriska laddningar drar till sig varandra tenderar vattenmolekylerna att dra till sig varandra, vilket gör vatten till ett slags ”klibbigt” ämne. Sidan med väteatomerna (positiv laddning) drar till sig syre-sidan (negativ laddning) på en annan vattenmolekyl.
Du vet säkert att vattens kemiska beteckning är H2O. En vattenmolekyl består av en syreatom bunden till två väteatomer. Väteatomerna är ”fästa” på ena sidan av syreatomen, vilket resulterar i att en vattenmolekyl har en positiv laddning på den sida där väteatomerna finns och en negativ laddning på den andra sidan, där syreatomen finns. Eftersom motsatta elektriska laddningar drar till sig varandra tenderar vattenmolekylerna att dra till sig varandra, vilket gör vatten till ett slags ”klibbigt” ämne. Sidan med väteatomerna (positiv laddning) drar till sig syre-sidan (negativ laddning) på en annan vattenmolekyl.
Alla dessa vattenmolekyler som drar till sig varandra gör att de tenderar att klumpa ihop sig. Det är därför vattendroppar faktiskt är droppar! Om det inte vore för några av jordens krafter, t.ex. gravitationen, skulle en vattendroppe vara bollformad – en perfekt sfär. Även om det inte bildar en perfekt sfär på jorden bör vi vara glada att vatten är klibbigt.
Vatten kallas det ”universella lösningsmedlet” eftersom det löser upp fler ämnen än någon annan vätska. Detta innebär att varhelst vatten går, antingen genom marken eller genom våra kroppar, tar det med sig värdefulla kemikalier, mineraler och näringsämnen.
Rent vatten har ett neutralt pH-värde. Rent vatten har ett pH, på cirka 7, vilket varken är surt eller basiskt.
Vattens fysikaliska egenskaper:
Vatten är unikt i det avseendet att det är det enda naturliga ämne som finns i alla tre tillstånden – flytande, fast (is) och gas (ånga) – vid de temperaturer som normalt förekommer på jorden. Jordens vatten interagerar, förändras och är ständigt i rörelse.
 Vatten fryser vid 32° Fahrenheit (F) och kokar vid 212° F. Faktum är att vattnets fryspunkt och kokpunkt är den baslinje med vilken temperaturen mäts: 0° på Celsiusskalan är vattnets fryspunkt och 100° är vattnets kokpunkt. Vatten är ovanligt eftersom den fasta formen, is, är mindre tät än den flytande formen, vilket är anledningen till att is flyter.
Vatten fryser vid 32° Fahrenheit (F) och kokar vid 212° F. Faktum är att vattnets fryspunkt och kokpunkt är den baslinje med vilken temperaturen mäts: 0° på Celsiusskalan är vattnets fryspunkt och 100° är vattnets kokpunkt. Vatten är ovanligt eftersom den fasta formen, is, är mindre tät än den flytande formen, vilket är anledningen till att is flyter.
Vatten har ett högt specifikt värmeindex. Det innebär att vatten kan absorbera mycket värme innan det börjar bli varmt. Det är därför vatten är värdefullt för industrier och i din bils kylare som kylmedel. Vattnets höga specifika värmeindex bidrar också till att reglera hur snabbt luften ändrar temperatur, vilket är anledningen till att temperaturförändringen mellan årstiderna är gradvis snarare än plötslig, särskilt i närheten av haven.
Vatten har en mycket hög ytspänning. Med andra ord är vatten klibbigt och elastiskt och tenderar att klumpa ihop sig i droppar snarare än att spridas ut i en tunn film. Ytspänningen är ansvarig för kapillärverkan, som gör att vatten (och dess lösta ämnen) kan röra sig genom växternas rötter och genom de små blodkärlen i våra kroppar.
Vattentemperatur:
Vattentemperaturen är inte bara viktig för simmare och fiskare, utan även för industrier och till och med för fiskar och alger. Mycket vatten används för kylning i kraftverk som genererar elektricitet. De behöver kallt vatten till att börja med och släpper i allmänhet ut varmare vatten tillbaka till miljön. Temperaturen på det utsläppta vattnet kan påverka livsmiljöer nedströms. Temperaturen kan också påverka vattnets förmåga att hålla syre samt organismers förmåga att motstå vissa föroreningar.
pH:
pH är ett mått på hur surt/basiskt vatten är. Intervallet går från 0 – 14, där 7 är neutralt. pH under 7 indikerar surhet, medan ett pH över 7 indikerar en bas. pH är egentligen ett mått på den relativa mängden fria väte- och hydroxyljoner i vattnet. Vatten som har fler fria vätejoner är surt, medan vatten som har fler fria hydroxyljoner är basiskt. Eftersom pH kan påverkas av kemikalier i vattnet är pH en viktig indikator för vatten som förändras kemiskt. pH rapporteras i ”logaritmiska enheter”, liksom Richterskalan, som mäter jordbävningar. Varje siffra motsvarar en 10-faldig förändring av vattnets surhet/basicitet. Vatten med ett pH på 5 är tio gånger surare än vatten med ett pH på sex.
Föroreningar kan förändra ett vattens pH, vilket i sin tur kan skada djur och växter som lever i vattnet. Vatten som kommer från en övergiven kolgruva kan till exempel ha ett pH-värde på 2, vilket är mycket surt och definitivt skulle påverka alla fiskar som är galna nog att försöka leva i det! Om man använder den logaritmiska skalan skulle detta gruvvatten vara 100 000 gånger surare än neutralt vatten – så håll dig borta från övergivna gruvor.
Specifik konduktans:
Specifik konduktans är ett mått på vattnets förmåga att leda elektrisk ström. Den är starkt beroende av mängden lösta fasta ämnen (t.ex. salt) i vattnet. Rent vatten, t.ex. destillerat vatten, har en mycket låg specifik konduktans, medan havsvatten har en hög specifik konduktans. Regnvatten löser ofta upp luftburna gaser och luftburet damm medan det finns i luften och har därför ofta en högre specifik konduktans än destillerat vatten. Specifik konduktans är ett viktigt mått på vattenkvaliteten eftersom det ger en god uppfattning om mängden löst material i vattnet.
Sannolikt har du i skolan gjort experimentet där du ansluter ett batteri till en glödlampa och drar två ledningar från batteriet till en bägare med vatten. När trådarna sätts i en bägare med destillerat vatten tänds inte lampan. Men glödlampan tänds när bägaren innehåller saltvatten (saltlösning). I saltvattnet har saltet lösts upp och frigjort fria elektroner, och vattnet leder en elektrisk ström.
Turbiditet:
Turbiditet är ett mått på vattnets grumlighet. Den mäts genom att skicka en ljusstråle genom vattnet och se hur mycket som reflekteras av partiklar i vattnet. Vattens grumlighet orsakas av material, t.ex. smuts och rester från löv, som är suspenderat (flyter) i vattnet. Kristallklart vatten, som t.ex. Lake Tahoe (där man arbetar hårt för att förhindra att sediment sköljs in i sjön), har en mycket låg turbiditet. Men titta på en flod efter en storm – den är förmodligen brun. Du ser all suspenderad jord i vattnet. Tur för oss är att de material som orsakar grumlighet i vårt dricksvatten antingen sedimenterar eller filtreras innan vattnet hamnar i vårt dricksglas hemma. Turbiditet mäts i nefelometriska turbiditetsenheter (NTU).
Upplöst syre:
Och om vattenmolekylerna innehåller en syreatom så är detta syre inte det som vattenlevande organismer som lever i våra naturliga vatten behöver. En liten mängd syre, upp till cirka tio syremolekyler per miljon vatten, är faktiskt löst i vattnet. Detta lösta syre andas fiskar och zooplankton och behövs för deras överlevnad.
Snabbt rörligt vatten, som i en bergsbäck eller stor flod, tenderar att innehålla mycket löst syre, medan stillastående vatten innehåller lite. Processen där bakterier i vatten hjälper organiskt material, till exempel det som kommer från ett reningsverk, att ruttna förbrukar syre. Överskott av organiskt material i våra sjöar och floder kan därför leda till syrebrist. Vattenlevande organismer kan ha det svårt i stillastående vatten med mycket ruttnande organiskt material, särskilt på sommaren, när syrenivån för löst syre är lägst under hela säsongen.
Hårdhet:
Mängden löst kalcium och magnesium i vattnet bestämmer dess ”hårdhet”. Vattnets hårdhet varierar över hela USA. Om du bor i ett område där vattnet är ”mjukt” har du kanske aldrig hört talas om vattenhårdhet. Men om du bor i Florida, New Mexico, Arizona, Utah, Wyoming, Nebraska, South Dakota, Iowa, Wisconsin eller Indiana, där vattnet är relativt hårt, kan du märka att det är svårt att få upp ett lödder när du tvättar händer eller kläder. Dessutom kan industrier i ditt område behöva spendera pengar för att mjuka upp sitt vatten, eftersom hårt vatten kan skada utrustningen. Hårt vatten kan till och med förkorta livslängden på tyger och kläder! Betyder detta att studenter som bor i områden med hårt vatten inte hänger med i det senaste modet eftersom deras kläder slits snabbare?
Suspenderade sediment:
Suspenderade sediment är den mängd jord som rör sig i ett vattendrag. Den är starkt beroende av vattenflödets hastighet, eftersom snabbt strömmande vatten kan ta upp och suspendera mer jord än lugnt vatten. Under stormar sköljs jord från bäckbankarna ut i bäcken. Mängden som sköljs ut i ett vattendrag beror på vilken typ av mark som finns i vattendragets avrinningsområde och vilken vegetation som omger vattendraget.
Om marken störs längs ett vattendrag och skyddsåtgärder inte vidtas kan överskott av sediment skada vattenkvaliteten i ett vattendrag. Du har säkert sett de där korta plaststängslen som byggherrar sätter upp i kanten av den fastighet som de håller på att exploatera. Dessa siltstängsel ska fånga upp sediment under en regnstorm och hindra det från att sköljas ut i ett vattendrag, eftersom överskott av sediment kan skada bäckar, floder, sjöar och reservoarer.
Sediment som kommer in i en reservoar är alltid ett bekymmer; när det väl har kommit in kan det inte ta sig ut – det mesta av det kommer att sedimentera på botten. Reservoarer kan ”försumpas” om det kommer in för mycket sediment i dem. Reservoarens volym minskar, vilket resulterar i mindre område för båtliv, fiske och rekreation, samt minskar kraftproduktionskapaciteten hos kraftverket i dammen.
Vattenlösningsgeokemi:
Se på ett diagram över den hydrogeokemiska cykeln.
- Syra = ämne som innehåller väte och som ger fritt väte (H + ) när det löses upp i vatten
- Bas = ämne som innehåller OH-gruppen och som ger fritt (OH – ) när det löses upp i vatten
-
En syralösning är en lösning som innehåller ett överskott av fritt H + , och en bas är en lösning som innehåller ett överskott av fritt OH – . En reaktion mellan en syra och en bas brukar kallas neutralisering.
Till exempel:
-
HCl (syra) + NaOH (bas) ==> H 2 O + NaCl
som dissocieras till joner:
H + + Cl – + Na + OH – ==> H 2 O + Na + + Cl – - dvs. Na + och Cl – påverkas inte.
- pH = omvänt log av koncentrationen (aktiviteten) av fritt H + , eller pH = -log
-
Vatten dissocieras till H + och OH – ;
-
dissociationskonstanten är: K vatten = =10 -14
- Det måste alltså finnas 10 -7 mol vardera av H+ och OH – i ett kilo neutral lösning vid standardtemperaturen 25 °C. Ett mol är 6,023 x 10 10 23 atomer (eller molekyler) och H 2 O har en molekylvikt på 18 gram per mol. Ett kilo vatten innehåller cirka 1000/18 = 55,6 mol vatten eller cirka 3,35 x 10 25 syreatomer och cirka dubbelt så många (6,7 x 10 25 atomer) H + (mängden fritt H + eller fritt OH – är relativt liten jämfört med mängden odissocierat H 2 O).
- pH varierar vid 25 °C från 0 till 14; pH < 7 = sur lösning; pH > 7 = basisk lösning. Om HCl eller en annan syra tillsätts minskar pH; om NaOH eller en annan bas tillsätts ökar pH.
- pH ökar när kolsyra (en svag syra) dissocieras: När koldioxid förenas med vatten, vilket sker i atmosfären när fossila bränslen förbränns, bildas kolsyra: H 2 O + CO 2 ==> H 2 CO 3 . Fria H + blir tillgängliga under successiva dissociationer:
-
H 2 CO 3 ==> H + + HCO 3- kolsyra till bikarbonat, inträffar vid pH ~6,4
-
HCO 3 ==> H + + CO 32- bikarbonat till karbonat, inträffar vid pH ~10.3
Kom ihåg att fritt H + är tillgängligt endast när det är surt, eller när pH < ~7. Dissociationen av bikarbonat till karbonat inträffar när det finns för mycket OH – i systemet och H + ”frigörs” för att balansera basen.
- Upplösta katjoner och anjoner i vatten
Katjoner = elektrondonatorer, positivt laddade: Na + , K + , Mg ++ , Ca ++ , Fe ++ eller Fe +++ , Mn ++ , Al +++
Anjoner = elektronacceptorer, negativt laddade: Cl – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Metaller = fungerar som katjoner, oftast: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo osv.
- Vattenanalyser – måste ha en kation-anjonbalans
millequivalent (MEQ) = molsekvivalent laddning eller anjon eller katjon, mått på den totala laddning som beror på jonen i fråga löst i lösningen. Börja med koncentrationen, dividera med molvikt, multiplicera med laddning: XX mg/L / MW x CHG = MEQ
Exempel: Exempel: NaCl i lösning, Na = 50 mg/L (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Om den totala mängden katjoner och anjoner i en lösning inte är balanserad, finns det alltså ett fel i analysen.