INLEDNING
Heterozygot familjär hyperkolesterolemi (FH) är en vanlig genetisk sjukdom som är förknippad med för tidig aterosklerotisk kardiovaskulär sjukdom (ASCVD). Barn med obehandlad FH löper ökad risk att drabbas av för tidig ASCVD efter 20 års ålder.1 Den kraftiga förhöjningen av kolesterolhalten i lipoproteiner med låg densitet (LDL-C) börjar redan hos fostret och leder till att artärväggen utsätts för långvarig exponering av LDL-C, vilket påskyndar kolesterolavlagring och kärlinflammation och predisponerar för tidig initiering av ateroskleros, särskilt i kranskärlen och aortan.
Statiner och andra lipidsänkande terapier (LLT) sänker effektivt LDL-C, är säkra hos barn och ungdomar och återställer endotelfunktionen i tidig ålder.2-4 Nyligen har universell screening av barn från 2 års ålder och före 8 års ålder föreslagits5,6 för att upptäcka individer som kräver behandling. Detta tillvägagångssätt bygger dock på teoretiska överväganden och har inte bevisats i verkligheten.
Det finns dock lite kunskap om egenskaperna hos FH-patienter som är yngre än 18 år, om den LLT som används hos dessa patienter och om de lipidmål som uppnås i verkligheten. Informationsbristen är ännu större när det gäller uppföljningsdata. Nationella register kan användas för att tillhandahålla denna viktiga information, som är nödvändig för att förbättra vårdmodeller för FH, terapeutiska protokoll och hälsopolitiken7,8. SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) utformades för att förbättra insikten om prognostiska faktorer och mekanismer som påverkar utvecklingen av ASCVD och mortalitet i en FH-population.
Vårt mål var att analysera patientkarakteristika och bedöma LLT- och lipidmål vid inklusion och under uppföljning hos FH-patienter yngre än 18 år som skrevs in i SAFEHEART och att fastställa de faktorer som predicerar sannolikheten för att dessa mål uppnås.
METHODSStudieutformning och population
SAFEHEART är en öppen, multicenter, rikstäckande, långsiktig prospektiv kohortstudie i en molekylärt definierad FH-population i Spanien. Rekryteringen av deltagare från FH-familjer började 2004 och pågår fortfarande. Inklusionskriterier var indexfall med en genetisk diagnos av FH och deras släktingar äldre än 15 år med en genetisk diagnos av FH, samt deras släktingar utan en genetisk diagnos av FH (kontrollgrupp). Deltagare som var yngre än 15 år deltog dock också, om deras föräldrar begärde det. Studien godkändes av de lokala etikkommittéerna. Alla berättigade personer och/eller minst en av deras föräldrar eller vårdnadshavare lämnade skriftligt informerat samtycke. Ett samordningscenter i Madrid, Spanien, ansvarade för uppföljningen av deltagarna. Patienterna och/eller deras föräldrar kontaktades årligen med hjälp av ett standardiserat telefonsamtal för att registrera relevanta förändringar i livsstilsvanor och mediciner och eventuella kardiovaskulära händelser eller andra medicinska problem. Deltagande läkare som registrerade patienter och familjer i detta register fick utbildning, med riktlinjer för bästa praxis som förstärktes vid årliga möten där läkare som var experter på området deltog. Dessutom användes ett elektroniskt baserat program och telefonrådgivning och ett webbaserat utbildningsprogram användes för att ytterligare stödja hanteringen när så krävdes. Behandlingsbeslut fattades uteslutande av varje patients läkare.
Kliniska och laboratoriemässiga mätningar
Demografiska och kliniska egenskaper registrerades som beskrivits på annat håll.9 Venösa blodprover togs efter 12 timmars fasta. Serum-, plasma- och DNA-prover alikvoterades och förvarades vid -80 °C. Serumets totalkolesterol-, triglycerid- och högdensitetslipoproteinkolesterolnivåer (HDL-C) mättes i ett centralt laboratorium med hjälp av enzymatiska metoder. LDL-C-koncentrationen i serum beräknades med hjälp av Friedewaldformeln. DNA isolerades från helblod med hjälp av standardmetoder och FH diagnostiserades genetiskt med hjälp av ett DNA-mikroarray.10 LDL-C-målen definierades i enlighet med aktuella rekommendationer och mål. Lipoproteinkolesterol med låg densitet
mg/dL var det primära målet.11 Ett alternativt mål för patienter yngre än 14 år bestod av LDL-C mg/dL i avsaknad av andra kardiovaskulära riskfaktorer (rökning, HDL-C mg/dL, lipoprotein (a) > 50mg/dL eller LDL-C > 250mg/dL) eller förtida kardiovaskulära sjukdomar i stam- eller farföräldrar.6 För tidig familjär ASCVD definierades som förekomsten av en första händelse före 55 års ålder hos män och före 65 års ålder hos kvinnor.Klassificering av lipidsänkande terapi
Maximal statindos definierades som atorvastatin 40 till 80 mg/d eller rosuvastatin 20 till 40 mg/d, vilka ansågs vara högintensiva statindoser. Maximal kombinerad behandling definierades som maximal statindos plus ezetimib 10 mg/d. Maximal LLT definierades som varje LLT som förväntades ge en minskning på minst 50 % av LDL-C-nivåerna i utgångsläget: simvastatin 20, 40 eller 80 mg/d plus ezetimib 10 mg/d; pravastatin 40 mg/d i kombination med ezetimib 10 mg/d; fluvastatin 80 mg/d plus ezetimib 10 mg/d; atorvastatin 40 eller 80 mg/d med eller utan ezetimib 10 mg/d; atorvastatin 10 eller 20 mg/d plus ezetimib 10 mg/d; rosuvastatin 20 eller 40 mg/d med eller utan ezetimib 10 mg/d; rosuvastatin 10 mg/d plus ezetimib 10 mg/d; och pitavastatin 4 mg/d i kombination med ezetimib 10 mg/d.12,13
Genetisk analys
Mutationer av LDLR-kolesterolreceptorn (Low Density Lipoprotein Cholesterol Receptor) klassificerades enligt deras kända effekt på LDL-receptorproteinets funktion som nollmutationer (receptor-negativa) och defekta mutationer (receptor-defekta) enligt tidigare beskrivning.14 Varianter som leder till fullständig avsaknad av eller trunkering av proteinet (funktionsförlust) som påvisats genom in vitro-funktionsanalys eller datorsimuleringsanalys klassificerades som receptor-negativa. Dessa varianter omfattade följande: a) punktmutationer som orsakar en för tidig stoppkodon, b) missense-mutationer som påverkar den femte cysteinrika upprepningen i den ligandbindande domänen i LDL-C-receptorgenen (klass 2A-mutation), c) små deletioner eller insertioner som orsakar en ramförskjutning och en för tidig stoppkodon, och d) stora omarrangemang. Receptordefektiva mutationer var de återstående inframe-punktmutationerna och små inframe-deletioner och -insatser. Alla mutationer utan känd funktionalitetsanalys med hjälp av in vitro-studier eller datorsimuleringsanalyser klassificerades som ”okänd funktionalitet” eftersom vi inte kunde vara säkra på om effekten på receptorn var negativ eller defekt; de betraktades dock som patogena eftersom alla individer som bär på 1 av dessa mutationer hade hyperkolesterolemi, medan släktingar utan mutationen hade normala kolesterolnivåer.14
Statistisk analys
Statistiska analyser utfördes med hjälp av SPSS version 18.0 (SPSS Inc, Chicago, Illinois, Förenta staterna). Normaliteten i fördelningen av variablerna analyserades med Kolmogorov-Smirnov-testet. Kvantitativa data uttrycks som median och interkvartilområde (IQR) och kvalitativa data som absolut antal och procent. Två populationer definierades: populationen vid inträdet (n = 241) och populationen vid uppföljningen (även kallad kohorten), som omfattade de patienter som hade en fullständig plasmalipidprofil vid uppföljningen (n = 217). Alla jämförelser mellan inträde och uppföljning utfördes i kohortstudien. Jämförelser av frekvenser mellan kvalitativa variabler utfördes med hjälp av chi-kvadrat-testet. Förändringar i binära variabler analyserades med McNemar-testet. Medianvärden för kvantitativa variabler jämfördes med det icke-parametriska Mann-Whitney-testet eller det parade Wilcoxon signed rank-testet, beroende på vad som var lämpligt. En framåtriktad binär logistisk regressionsanalys genomfördes i kohortstudien för att fastställa vilka variabler som var förknippade med statinanvändning. Vi inkluderade variabler som var statistiskt signifikanta i univariata analyser, liksom a priori prediktorer och confounders: ålder, kön och uppföljning i en primär/specialiserad miljö. En annan framåtriktad binär logistisk regressionsanalys genomfördes i kohortstudien, med undantag för de patienter som uppnådde målet vid inträdet, för att fastställa de variabler som är förknippade med uppnåendet av LDL-C
mg/dL. Vi inkluderade variabler som var statistiskt signifikanta i univariata analyser, liksom a priori prediktorer och confounders: ålder, kön, typ av mutation (noll eller defekt), användning av ezetimib och uppföljning i en primär/specialiserad miljö. Skillnader ansågs statistiskt signifikanta vid P RESULTAT
I dagsläget har 4141 deltagare registrerats i SAFEHEART-registret. 392 är yngre än 18 år. Av dessa har 241 en molekylär bekräftelse av FH, och 217 har följts upp med en fullständig lipidprofil (90,0 %) (figur 1). Tjugofyra patienter utelämnades från analysen på grund av att det saknades en fullständig lipidprofil vid uppföljningen. Uppföljningen skedde inom primärvården för 40 patienter (18,4 %). Medianuppföljningstiden var 4,69 år (IQR, 2,48-6,38 år).
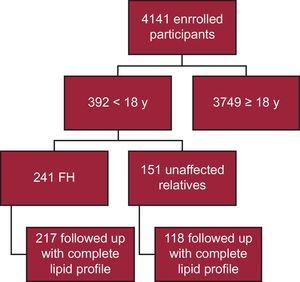
Schematisk flödesschema över studien. FH, familjär hyperkolesterolemi.
Vid rekryteringen (populationen vid inträdet) var 129 FH-patienter (53,5 %) män. Medianåldern var 15,0 år (IQR, 14,0-16,0 år). De 2 yngsta patienterna var 8 år gamla. Historia av ASCVD fanns inte hos någon patient och för tidig familjär ASCVD fanns hos 40 (16,6 %). Grundläggande egenskaper visas i tabell 1. En jämförelse av baslinjeegenskaperna vid inklusion mellan kohortpatienterna och de som inte följdes upp visas i tabell 1. Inga signifikanta skillnader hittades mellan de 2 grupperna. Ingen patient hade en historia av ASCVD, högt blodtryck eller diabetes mellitus. En högre andel av gruppen utan uppföljning hanterades inom primärvården, även om skillnaden inte var statistiskt signifikant. I kohorten fanns det signifikanta minskningar av plasmakoncentrationerna av totalkolesterol, LDL-C, triglycerider och non-HDL-C; en signifikant ökning av HDL-C observerades också vid uppföljningen (tabell 2).
Baseline Characteristics of the At-entry Population
| FH-patienter med uppföljning Median (IQR)/nr. (%) |
FH-patienter utan uppföljning Median (IQR)/nr. (%) |
P | |
|---|---|---|---|
| Antal | 217 | 24 | |
| Kön (man) | 117 (53,9%) | 12 (50%) | .72 |
| Ålder, y | 15,0 (14,0-16,0) | 15,0 (13,0-15,8) | .06 |
| Prematuritet bekant ASCVD | 36 (16,6 %) | 4 (16,7 %) | 1.00 |
| Aktiv tobaksrökare | 13 (6,0 %) | 2 (8,3 %) | .65 |
| Xanthomer | 1 (0,5 %) | 0 (0,0 %) | .99 |
| Corneal arcus | 6 (2,8 %) | 1 (4,2 %) | .53 |
| BMI, kg/m2 | 21,09 (19,40-22,80) | 20,79 (17,80-22,70) | .64 |
| Västomfång, cm | 72,0 (66,0-78,0) | 72,0 (66,0-75,8) | .94 |
| Total kolesterol, mg/dL | 223,5 (194,0-262.3) | 217,5 (194,5-277,5) | .76 |
| LDL-C, mg/dL | 162,6 (133.0-195,8) | 153,9 (13,1-209,3) | .71 |
| HDL-C, mg/dL | 49.0 (42,8-55,0) | 48,5 (41,5-56,0) | .96 |
| TG, mg/dL | 62,0 (49.0-80.3) | 66.0 (42.1-82.3) | .90 |
| Non-HDL-C, mg/dL | 174.0 (145,8-210,9) | 167,0 (146,5-225,3) | .74 |
| Lp (a), mg/dL | 18,80 (7,00-48,50) | 13,45 (9,10-28,10) | .46 |
| Hanteras inom primärvården | 40 (22,9 %) | 7 (46,7 %) | .06 |
ASCVD, aterosklerotisk kardiovaskulär sjukdom; BMI, kroppsmasseindex; FH, familjär hyperkolesterolemi; HDL-C, lipoproteinkolesterol med hög densitet; LDL-C, lipoproteinkolesterol med låg densitet; Lp (a), lipoprotein (a); IQR, interkvartilintervall; TG, triglycerider.
Lipid- och lipoproteinkoncentrationer i plasma (kohort)
| Kohort vid inträde | Kohort vid uppföljning | .Uppföljning | P | |
|---|---|---|---|---|
| Total kolesterol, mg/dL | 221.0 (194.0-260.2) | 203.0 (183.0-233.5) | .001 | |
| LDL-C, mg/dL | 157,7 (132,8-194,5) | 138,0 (116,5-165.4) | .001 | |
| HDL-C, mg/dL | 49.0 (43.0-55.0) | 50.0 (44.0-58.0) | .002 | |
| TG, mg/dL | 62.0 (49.0-80.2) | 70.0 (54.5-91.0) | .004 | |
| Non-HDL-C, mg/dL | 171.0 (145.8-209.2) | 154.0 (132,0-182,5) | .001 |
HDL-C, lipoproteinkolesterol med hög densitet; LDL-C, lipoproteinkolesterol med låg densitet; TG, triglycerider.
Värdena är medianvärden (interkvartilområde).
Funktionella mutationer
Vi identifierade 212 patienter med en mutation i LDL-C-receptorgener (97,7 %) och 5 patienter med en mutation i apolipoprotein B-gener (2,3 %). Av mutationerna i LDL-C-receptorgener klassificerades 95 (43,8 %) som nollmutationer, 92 (42,4 %) som defekta mutationer och 25 (11,5 %) som mutationer med okänd funktionalitet.
Lipidsänkande behandling och måluppfyllelse
Tabell 3 visar användningen av olika LLT-regimer vid inträde och uppföljning. Resultaten visar en signifikant ökning av användningen av statiner (44,2 % vid inträde och 68,2 % vid uppföljning), ezetimib (8,7 % vid inträde och 15,2 % vid uppföljning), maximal statindos (3,3 % vid inträde och 13,9 % vid uppföljning) och maximal LLT (7,9 % vid inträde och 23,6 % vid uppföljning). Den mest förskrivna statinen vid inskrivning (25,3 %) och uppföljning (30,3 %).5 %) var atorvastatin. Förskrivningen av rosuvastatin ökade (från 6,0 % vid inklusion till 20,3 % vid uppföljning). Mediantiden för statinbehandling var 7,0 år (5,0 till 9,0 år). Åldern vid menarche var 12,0 år (12,0 till 13,0 år) för flickor som behandlades med statiner och 12,0 år (11,0 till 13,0 år) för flickor som inte behandlades med statiner (P = .77). Ingen ökning av vare sig levertransaminaser eller kreatinfosfokinas observerades. Fibrater och gallsyrasekvestranter användes endast hos 15 patienter vid inklusion (7,0 %) och 3 patienter vid uppföljning (1,5 %). Ezetimibmonoterapi utan statin användes hos 18 patienter vid inklusion (8,3 %) och 24 patienter vid uppföljning (11,1 %). När det gäller följsamhet till behandlingen rapporterade 10 patienter (4,6 %) att de inte tog sin medicin minst en dag varje månad under uppföljningen. Vid multivariabel analys var ingen variabel oberoende associerad med statinanvändning.
Lipidsänkande terapier och uppnående av LDL-C-mål (kohort)
| At entry-/follow-up- | At entry-/follow-up+ | At entry+/follow-up- | At entry+/follow-up+ | P | |
|---|---|---|---|---|---|
| Patienter på statiner | 60 (27.6%) | 61 (28,1%) | 9 (4,1%) | 87 (40,1%) | .001 |
| Patienter på maximal statindos | 186 (85.7%) | 24 (11,1%) | 1 (0,5%) | 6 (2,8%) | .001 |
| Patienter på ezetimib | 177 (81,6%) | 21 (9.7%) | 7 (3,2%) | 12 (5,5%) | .013 |
| Patienter på maximal kombinationsbehandling | 211 (97,2%) | 6 (2,8%) | 0 (0.0%) | 0 (0,0%) | N/A |
| Patienter på maximal LLT | 163 (75,1%) | 37 (17,1%) | 3 (1,4%) | 14 (6,5%) | .001 |
| LDL-C | 111 (51,2%) | 62 (28,6%) | 16 (7.4%) | 28 (12,9%) | .001 |
| LDL-C | 44 (20,3%) | 64 (29.5%) | 19 (8,8%) | 90 (41,5%) | .001 |
LDL-C, lipoproteinkolesterol med låg densitet; LLT, lipidsänkande behandling.
Värdena är n (%). – = inte närvarande; + = närvarande.
Se text för klassificering av LLT.
Plasma LDL-C-koncentrationen minskade med i genomsnitt 12,5 % och nådde vid uppföljningen ett medianvärde på 138,0 mg/dL. Målen för lipoproteinkolesterol med låg densitet, enligt de senaste internationella rekommendationerna om FH, uppnåddes hos 20,3 % vid inskrivning och 41,5 % vid uppföljning (tabell 3 och figur 2). När ett alternativt mål på LDL-C
mg/dL övervägdes för patienter yngre än 14 år, nådde 8 av 48 patienter (16,7 %) och 1 av 6 patienter (16,7 %) målet vid inskrivning respektive uppföljning. Den enda variabel som var oberoende förknippad med att LDL-C-målet uppnåddes i den multivariabla analysen var statinanvändning (oddskvot, 13,83; 95 % konfidensintervall, 2,98-64,15). Typ av vårdgivare (specialist eller primärvårdsläkare), ålder, kön, lipoprotein (a)-nivå och typ av mutation var inte förknippade med uppnåendet av LDL-C-målet.
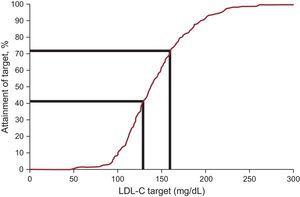
Behandlingsmål hos patienter med familjär hyperkolesterolemi som är yngre än 18 år: andel patienter som uppnår LDL-C-målet. LDL-C, lipoproteinkolesterol med låg densitet.
DISKUSSION
I den här studien rapporterar vi egenskaperna, LLT-användningen och uppnåendet av LDL-C-målen i en longitudinell kohort av molekylärt definierade FH-patienter som är yngre än 18 år och som registrerats i SAFEHEART-registret. Detta unika register över FH-patienter är baserat på data som erhållits från det verkliga livet i Spanien i både specialiserade och primärvårdsmiljöer. Våra resultat visar att ett behandlingsmål för LDL-C
mg/dL uppnåddes av endast 20,3 % av patienterna vid inklusionen och hos 41,5 % vid uppföljningen, med 68,2 % av patienterna på LLT. Statinanvändning var den enda faktorn som var oberoende förknippad med uppnåendet av LDL-C-målet. Såvitt vi vet har inget annat arbete visat på måluppfyllelse hos FH-patienter yngre än 18 år och denna studie är den första som rapporterar detta i en stor population.
Nyligen analyserade ett brittiskt register15 207 barn med FH, identifierade mutationer hos 64 % av barnen och konstaterade att 48 % stod på LLT; en 35 % minskning av LDL-C uppnåddes. Författarna rapporterade dock inga resultat för måluppfyllelse. En annan rapport, som analyserade ett litet urval av försökspersoner (n = 89), visade en minskning av LDL-C med 43 % vid långtidsuppföljning.16 Denna större minskning beror troligen på en mer frekvent användning av kombinationsbehandling (56 %). Inga resultat för måluppfyllelse visades. I en annan retrospektiv artikel om 207 patienter i Nederländerna stod endast 26 % av patienterna på LLT och återigen rapporterades inga resultat avseende uppnåendet av LDL-C-målet.17
Denna longitudinella studie visade att LDL-C-nivåerna hos FH-patienter som är yngre än 18 år kan förändras med tiden på grund av LLT-modifiering och läkarutbildning. Andelen patienter med statiner, maximal statindos och maximal LLT ökade signifikant under uppföljningen. Intressant nog tyder våra data på att vår kohort inte är snedvriden eftersom det inte fanns några statistiskt signifikanta skillnader mellan de patienter som inte följdes upp och kohorten.
Förtida diagnos och behandling av FH är viktigt, särskilt hos barn och ungdomar, för att förhindra ASCVD-utveckling i vuxen ålder. Screening för FH hos barn lönar sig och måste utföras före 8 års ålder eftersom barn med hyperkolesterolemi löper en ökad risk för tidig ASCVD. Dessutom kan screening identifiera dem som löper störst risk och påskynda inledandet av LLT, som har visat sig effektivt vända den aterosklerotiska processen och minska ASCVD-risken. Barn med FH har vanligtvis inte klinisk ASCVD. Trots detta stöder förekomsten av en framtida risk användningen av LLT, där statiner är hörnstenen i FH-hanteringen.18
Säkerheten och tolerabiliteten för LLT vid FH hos barn är alltid kontroversiell, även om de rapporteras vara likartade med dem hos vuxna.5,19,20 Nyligen rapporterade Ramaswami et al.15 att det inte fanns några säkerhetsproblem, vilket liknar våra resultat. Trots detta rekommenderas strikt övervakning, särskilt hos de patienter som får högre statindoser. Ungdomsflickor bör också rådas att avbryta statinbehandlingen när de överväger en graviditet. Trots att det behövs fler uppgifter om säkerhetsfrågor för barn under långtidsbehandling med LLT har nyligen utförda långtidsuppföljningar visat på en utmärkt säkerhetsprofil.21 Detta resultat stöds indirekt av våra uppgifter, eftersom en stor andel av patienterna påbörjade LLT under uppföljningen och det fanns få avhopp. Våra resultat visar tydligt en ökad andel patienter som använder statiner, en hög statindos och maximal LLT, med en låg andel patienter som avbryter medicineringen. Dessa data bekräftar säkerheten, följsamheten och tolerabiliteten hos statiner, även när de används i hög dos, hos FH-patienter som är yngre än 18 år.22 Dessutom stämmer våra resultat överens med tidigare rapporter som visar att det inte finns några effekter på den sexuella mognaden.23 Alla dessa resultat bekräftar återigen konceptet ”ju yngre, desto bättre” när det gäller den idealiska åldern för att påbörja statiner hos dessa unga FH-patienter.23
Våra resultat visar ett stort antal FH-patienter som är yngre än 18 år och tyder i enlighet med tidigare studier15,16 på att vuxna FH-patienter är villiga att inkludera sina närmaste familjemedlemmar i screening- och registerverksamhet. Detta faktum återspeglar det allvar med vilket dessa patienter tar sitt problem på allvar och den inverkan som läkarens råd kan ha på en förändring av deras livsstil. En sådan attityd hos vuxna patienter utgör grunden för en hälsosam livsstil hos deras släktingar.24
Och även om det vanligaste målet för FH-patienter som är yngre än 18 år är en LDL-C-nivå under 130 mg/dL, kan ett alternativt tillvägagångssätt bestående av LDL-C mg/dL användas hos de patienter som är yngre än 14 år, som är icke-rökare, med HDL-C ≥ 40 mg/dL, lipoprotein (a) mg/dL, LDL-C mg/dL, och som inte har någon för tidig hjärt- och kärlsjukdom hos förfäder eller mor- eller farföräldrar.6 Andra aktuella riktlinjer rekommenderar en 50-procentig minskning av LDL-C från nivåerna före behandling, men för de barn som är ≥ 10 år, särskilt om det finns ytterligare kardiovaskulära riskfaktorer, inklusive förhöjt lipoprotein (a), bör LDL-C-målet vara mg/dL.11 Våra resultat visar också på svårigheten för dessa patienter att uppnå lipidmålen.25 Dessutom var uppnåendet av LDL-C-målen likadant oavsett om patienterna behandlades av specialister eller av primärvårdsläkare. Det är således möjligt att uppnå en vårdnivå för pediatriska patienter med FH i en primärvårdsmiljö som är jämförbar med den som uppnås genom specialistvård. För detta mål är det viktigt att betona det stöd som kliniker får via register och särskilda utbildningsprogram. Register kan optimera hanteringen av FH-patienter yngre än 18 år genom att möjliggöra integrering av primär- och specialistvård och kan också stödja hälsomyndigheter i beslutsfattandet.8,26
Begränsningar och styrkor
I denna stora uppföljningsstudie av FH-patienter yngre än 18 år var interventionen oförändrad i förhållande till den som tillhandahölls av patientens läkare. Det saknas en tillförlitlig baslinje lipidprofil i detta register eftersom vissa patienter redan fick behandling när de skrevs in. Dessutom kan resultaten ha ändrats av flera förhållanden, t.ex. olika livsstilar och ett samband med olika kardiovaskulära riskfaktorer som kan ha ändrat resultaten.
KONKLUSIONER
SAFEHEART-registerdata visar att en stor andel FH-patienter yngre än 18 år har höga LDL-C-nivåer och misslyckas med att uppnå rekommenderade LDL-C-mål. Vi fann en ökning av LLT-intensiteten och en signifikant minskning av LDL-C-nivåerna under uppföljningen. Statinanvändning var den enda oberoende prediktoren för att uppnå LDL-C-målet. Dessutom upptäcktes inga säkerhetsproblem under uppföljningen. Dessa resultat tyder på att många FH-patienter inte är tillräckligt kontrollerade och att det fortfarande finns utrymme för behandlingsförbättringar. Dessutom kan uppföljningen av denna FH-population bidra till kunskapen om säkerheten för livslång LLT och den optimala åldern för behandlingsstart för att förhindra ASCVD-utveckling i vuxen ålder.
FINANsiering
Detta arbete stöddes av bidrag G03/181 från Fundación Hipercolesterolemia Familiar, FIS PI12/01289 från Instituto de Salud Carlos III och bidrag 08-2008 från Centro Nacional de Investigación Cardiovascular.
INTRESSEKONFLIKTER
Ingen deklarerade.
- –
Barn med obehandlad heterozygot familjär hyperkolesterolemi löper ökad risk för tidig ASCVD efter 20 års ålder.
- –
Statiner och andra lipidsänkande terapier sänker effektivt LDL-C och är säkra hos barn och ungdomar.
- –
Det finns lite kunskap om egenskaperna hos FH-patienter som är yngre än 18 år, de lipidsänkande terapier som används hos dessa patienter och de lipidmål som uppnås i verkligheten.
- –
Denna informationsbrist är ännu större när det gäller uppföljningsdata.
VAD TILLÄGGER DENNA STUDIE?
- –
En stor andel FH-patienter yngre än 18 år misslyckas med att uppnå de rekommenderade LDL-C-målen.
- –
Vi fann en ökning av LLT-intensiteten och en signifikant minskning av LDL-C-nivåerna under uppföljningen.
- –
Statinanvändning var den enda oberoende prediktoren för att uppnå LDL-C-målet och inga säkerhetsproblem upptäcktes under uppföljningen.
- –
Dessa resultat förstärker konceptet ”ju yngre, desto bättre”.
.