Intracellulära signaler, t.ex. skador på cellens DNA, driver apoptos främst genom den intrinsiska vägen. Den intrinsiska apoptosvägen, som involverar konserverade signalproteiner, är fysiskt associerad med mitokondrier och är hos ryggradsdjur känslig för oxidativ stress i mitokondrier. Vägen påverkas av medlemmar av Bcl-familjen som är bundna till mitokondriemembranet, inklusive Bax- och Bcl-2-genen, som fungerar som pro- eller antiapoptotiska regleringsproteiner, respektive.
Översikt över den intrinsika apoptosvägen
Den intrinsika apoptosvägen initieras av t.ex. kemoterapi och/eller strålbehandling. Den aktiveras av en rad exogena och endogena stimuli, såsom DNA-skador, ischemi och oxidativ stress. Dessutom spelar den en viktig funktion vid utveckling och vid eliminering av skadade celler.
I den intrinsiska vägen är den funktionella konsekvensen av proapoptotisk signalering rubbning av mitokondrialmembranet och frisättning av cytokrom c i cytoplasman, där det bildar ett komplex eller apoptosom med apoptotisk proteasaktiverande faktor 1 (APAF1) och den inaktiva formen av caspase-9. Detta komplex hydrolyserar adenosintrifosfat för att klyva och aktivera caspase-9. Initiatorn caspas-9 klyver och aktiverar sedan exekutionskaspas-3/6/7, vilket resulterar i cellapoptos. Det skiljer sig helt från de extracellulära signalerna, som vanligtvis genereras av cytotoxiska celler i immunförsvaret och utlöser apoptos huvudsakligen genom den extrinsiska vägen.
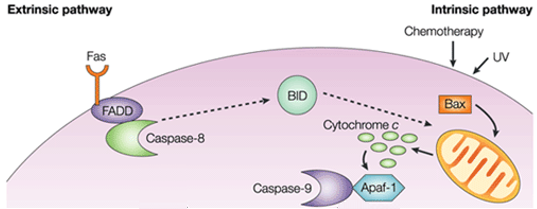
Figur 1. Skillnaden mellan extrinsisk väg och intrinsisk väg.
Process och reglering av intrinsisk apoptosväg
Den intrinsiska apoptosvägen inducerar apoptos genom att direkt aktivera caspas-3 eller genom att klyva bid (BH3-interagerande domän-dödsagonist), vilket resulterar i mitokondriell dysfunktion och efterföljande frisättning av cytokrom c och aktivering av caspas-9 och caspas-3. Caspas-3 främjar de typiska apoptosegenskaperna, inklusive DNA-fragmentering och celldöd i flera vävnader.
Proteinfamiljen B-celllymfom 2 (Bcl-2) kontrollerar noggrant aktiveringen av den intrinsiska vägen. Den finns i follikulärt lymfom och identifierades först som en av de gener som är involverade i celldöd genom att antingen aktivera proapoptotisk eller hämma antiapoptotisk apoptos. Proteiner i en undergrupp, inklusive Bid, Bad, Bim, Bmf, Puma och Noxa, innehåller en enda Bcl-2-homologi 3-domän (BH3-only proteiner) och har proapoptotisk aktivitet. Två andra undergrupper av proteiner har flera BH-domäner. Den första undergruppen, som omfattar Bcl-2-associerat X-protein (Bax), Bcl-2 homologous antagonist/killer (Bak) och Bcl-2-familjens apoptosregulator (Bok), är proapoptotisk, medan den andra undergruppen, som omfattar Bcl-2, Bcl-XL och Mcl-1, är antiapoptotisk. Den mitokondriella vägen påverkas delvis av Bcl-familjemedlemmar som är bundna till mitokondriemembranet, inklusive både proapoptotiska regulatoriska proteiner Bax och antiapoptotiska regulatoriska proteiner Bcl-2.
De proapoptotiska molekylerna orsakar permeabilisering av det yttre mitokondriemembranet, vilket leder till utflöde av cytokrom c, som binder adaptatorn Apaf-1 och initiatorn caspase-9 i cytosolen för att bilda apoptosomkomplexet. Detta stimulerar caspase-9, som i sin tur aktiverar de effektiva caspaserna. Mitokondrien släpper också ut ett protein som kallas Smac/DIABLO i cytosolen. Smac/DIABLO främjar indirekt apoptos genom att blockera effekterna av en grupp antiapoptotiska proteiner som kallas inhibitor of apoptosis proteins (IAPs).
De antiapoptotiska proteinerna Bcl-2 och Bcl-XL hämmar frisättningen av cytokrom c, medan Bax, Bak och Bid, som alla är pro-apoptotiska proteiner, främjar dess frisättning från mitokondrierna. Cytokrom c och deoxyadenosintrifosfat (dATP) binds till APAF-1 för att bilda ett multimeriskt komplex som rekryterar och aktiverar pro-caspase-9, ett apoptosmedierande exekutionsproteas som i sin tur aktiverar caspaskaskaden, vilket resulterar i cellapoptos. Under denna process är caspase-2, caspase-8, caspase-9 och caspase-10 involverade i initieringen av apoptos. Caspase-3, caspase-6 och caspase-7 är involverade i apoptos. Caspase-3 och caspase-7 reglerar inhiberingen av DNA-reparation och påbörjar DNA-nedbrytning. Dessutom reglerar caspase-6 upplösningen av lamina och cytoskelett.
Intrinsik apoptosväg i patofysiologi
De flesta kemoterapeutiska och målinriktade cancerterapier dödar tumörceller genom att generera pro-dödssignalering som initierar den intrinsikala apoptosvägen för programmerad celldöd. När den väl har inträffat leder mitokondriernas permeabilisering av det yttre membranet till att en apoptosom bildas, vilket underlättar aktivering av caspaserna och därefter utlöser de andra kännetecknen för apoptotisk celldöd. Det cellulära beslutet att initiera MOMP styrs av en känslig balans mellan de pro- och antiapoptotiska molekylerna i BCL-2-familjen.
En av orsakerna till kemoterapiresistens är tumörcellernas misslyckande att gå in i apoptos på grund av defekter i den intrinsiska apoptosvägen (t.ex. förändringar i p53). Trots betydande förbättringar av behandlingen förblir botningsgraden för många cancerformer suboptimal. Den ökande användningen av cytotoxisk kemoterapi har lett till botande behandling för en undergrupp av cancerformer, även om intrinsikalt behandlingsmotstånd är svårt att förutsäga för enskilda patienter. Vågen av molekylärt riktade terapier har fokuserat på mutationer som aktiverar läkemedel och är därför begränsad till specifika undergrupper av patienter. Den inneboende mitokondriella apoptosvägen utgör en lovande måltavla för nya terapier, och en framgångsrik inriktning på denna väg har potential att förändra det terapeutiska landskapet för behandling av en rad olika cancerformer.