VAD ÄR EN KONGENITAL CORONARY ARTERY ANOMALY?
Det finns en pågående debatt om vad som ska betraktas som normalt och vad som ska betraktas som en coronararterieanomali (CAA). Enligt Angelini1 diagnostiseras CAA genom uteslutning, vilket innebär att man i de fall där kranskärlsmorfologin inte är normal definierar normalitet enligt ett statistiskt kriterium (intervall mellan plus eller minus 2 standardavvikelser från medelvärdet). Således skulle en CAA vara den kranskärlsmorfologi som observeras hos mindre än en procent av den allmänna befolkningen.1,2 CAA kan produceras under normal eller patologisk kardiogenes: i det första fallet skulle resultatet vara isolerade CAA, som vi fokuserar på i den här artikeln, medan de i det andra fallet skulle vara förknippade med andra hjärtmissbildningar.
KLASSIFIKATION
Det finns flera klassifikationer.1-3 En ny som försöker standardisera diagnostiska kriterier och grupperar CAA enligt 7 kategorier har nyligen föreslagits4 (tabell 1).


Internationella grupper efterlyser register som omfattar åtminstone de anomalier som orsakar majoriteten av de kliniska händelserna (plötslig död och ischemi i hjärtat) som tillskrivs CAA,5-7 utgörs av dem som har sitt ursprung i den kontralaterala eller ”fel” sinus Valsalva. I denna grupp ingår koronararterier med ett enda kärl (”hyperdominans” i Rigatelli et al:s klassificering4), eftersom de måste förse myokardiet med blod från ett enda koronart ostium och fastställa vägar som ibland liknar CAA:s vägar som har sitt ursprung i fel sinus Valsalva (figur 1).

Figur 1. Coronary arteriografía i vänster främre snedprojektion som visar ett enda kärl höger kranskärl.
INKIDENS
De olika definitionerna eller klassificeringarna och analysen av både angiografiska8,9 och obduktionsserier10 och, på senare år, ekokardiografiska serier11 resulterar i en rapporterad incidens av CAA som ligger mellan 0,1 % och 8,4 %,1,8,11 vilket gör det svårt att fastställa den exakta omfattningen av det problem som de representerar. På det hela taget kan incidensen vara ganska lik den för andra sjukdomar som vi har kunnat definiera mer exakt, såsom
hypertrofisk kardiomyopati (0,2 %)12 eller Wolff-Parkinson-White-syndromet (0,1 % till 0,3 %)13
Incidensen av onormala kranskärl med ursprung i fel bihåla och enkelkärlskoronarkärl i koronarangiografiska studier varierar mellan 0.28 % och 1,74 %.2,3,8,9,14-16 Med tanke på deras kliniska betydelse kommer vi att fokusera vår granskning på dessa anomalier.
KLINISKA PRESENTATIONER
Inledningsvis diagnostiserades dessa anomalier under koronarangiografi som utfördes på patienter med klaffsjukdom eller ischemisk hjärtsjukdom, och ansågs inte ha någon klinisk betydelse. Senare började man rapportera om plötslig död hos unga idrottsmän där det enda tecknet på sjukdom var en anomali med ursprung i kranskärlen.8,17
Det kliniska spektrumet vid presentationen är varierande: medan vissa patienter är asymtomatiska, uppvisar andra angina pectoris, dyspné, synkope, akut hjärtinfarkt, hjärtsvikt och plötslig död.1,2,5,8,17-20 I dagsläget anses CAA vara den näst vanligaste orsaken till plötslig död hos idrottare i USA.21
Betyder detta att alla CAA bör anses indikera hög risk? Absolut inte, men ur strategisk synvinkel bör de betraktas som ”potentiellt maligna” tills ytterligare tester utförs för att utesluta myokardiell ischemi framkallad av anomalin.
Det stora bekymret ligger i att avgöra vilka CAA som kan uppvisa plötslig död. Idag vet vi att de som följer ett interarteriellt (eller intramuralt) förlopp, de där den anomala kranskärlet är det dominerande och de som ger kliniska tecken hos patienter som är yngre än 30 eller 35 år är de där incidensen av plötslig död är högst.22-26
För denna anledning bör vårt tillvägagångssätt vid en CAA skilja sig åt beroende på patientens ålder. Hos unga människor, under 35 år, kommer vi att ”fokusera” på att förhindra plötslig död, medan vi hos dem som är över 35 år kommer det huvudsakliga målet att vara att behandla myokardischemi (figur 2).
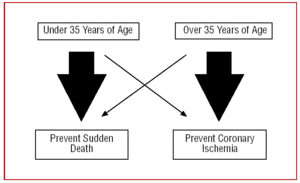
Figur 2. Olika tillvägagångssätt beroende på patientens ålder.
Undertiden kan CAA, på grund av sitt ursprung och anomala förlopp, skadas vid kirurgi för klaffbyte, men detta kan också inträffa vid perkutan stängning av foramen ovale. Av denna anledning bör förekomsten av CAA uteslutas före ingrepp av denna typ. 27-30
PATHOPHYSIOLOGI FÖR ISCHEMI I CORONARIA ANOMALIES
Det finns ett antal teorier31 för att förklara de mekanismer som ger upphov till ischemi i CAA, men ingen av dem har kunnat påvisas tydligt. I en av dem anses orsaken vara den anomala artärens markerade vinkling där den utgår från aorta. I motsats till en normal kranskärlsartär, som är vinkelrät mot aorta vid sitt ursprung, måste den onormala kranskärlsartären böja sig över sig själv för att nå sitt normala försörjningsområde från den motsatta sinus Valsalva. På grund av detta skulle den onormala kranskärlets ostium vara mindre, med ventilliknande kammar, jämfört med det normala cirkulära ostium, och skulle kunna komprimeras vid en markant utvidgning av aorta, som den som observeras vid ansträngande träning.32
En annan teori hänvisar till CAA:s initiala förlopp. När den är interarteriell, mellan aorta och lungartär, skulle tryckökningen i de två kärlen, som sker vid ansträngning, ge upphov till en kompression av den onormala kranskärlet.33 Om det initiala förloppet dessutom är intramuralt kan obstruktionen förstärkas, eftersom kranskärlet kan deformeras inom aortaväggen under perioder av hypertoni.34
Vissa författare anser att den mekanism som leder till ischemi innefattar produktion av en spasm i den onormala kranskärlet till följd av endotelskador som produceras av den onormala banan,35 och andra anser att en intussusception av den proximala delen av CAA i aortaväggen skulle produceras.31
Slutningsvis kan alla de mekanismer som diskuterats producera akut eller kronisk ischemi (mindre ischemiska händelser) som framkallar myokardfibros som i sin tur kan vara orsaken till generering av dödliga arytmier.36
HUR DIAGNOSERAS EN CORONARY ANOMALY?
Diagnosen kräver ett högt index för misstanke och en bedömning av dess närvaro under vissa omständigheter. Som vi nämnde ovan upptäcks de flesta CAA oavsiktligt under koronarangiografier som utförs hos patienter med ischemisk hjärtsjukdom eller klaffsjukdom som genomgår denna undersökning före operation för klaffbyte.
Ungdomar som inte uppvisar några koronära riskfaktorer eller associerad klaffsjukdom utgör den största diagnostiska utmaningen. Vi bör misstänka CAA i närvaro av ansträngningsmässig synkope, dyspné eller bröstsmärta som tyder på angina.24,26,35 Uppenbarligen är det första diagnostiska testet som vi alla utför standardergometri. Detta har dock inte visat sig vara särskilt användbart för den här typen av patienter eftersom det vanligtvis är negativt, vilket tyder på att ischemi på grund av CAA endast förekommer sporadiskt.35,36
Med tanke på att de ”funktionella” testerna inte är till någon större hjälp måste vi alltså välja en avbildningsundersökning som gör det möjligt att undersöka den koronära anatomin. Det icke-invasiva test som initialt rekommenderas är transtorakal ekokardiografi (TTE).7,26,37-40 Hos majoriteten av dessa patienter gör utförandet av enkel TTE i den parasternala kortaxelprojektionen i aortakroppens plan det möjligt att särskilja de två kranskärlsostierna och till och med bestämma CAA:s initiala förlopp. Pellicia et al studerade 1360 elitidrottare med hjälp av ekokardiografi och visualiserade ostium och den proximala delen av vänster huvudkoronarartär i 97 % av fallen och höger huvudkoronarartär i 80 % av fallen.41
Nyligen utförde Frommelt et al34 ekokardiografi på alla barn och ungdomar (åldersintervall, 3 månader till 20 år) som hänvisades till deras sjukhus (1997-2002) med symtom på myokardischemi, misstänkt medfödd hjärtsjukdom eller smärta i muskuloskeletala system. De genomgick alla en konventionell TTE med hjälp av Doppler-färgflödeskartläggning för att bestämma blodflödets riktning. De identifierade 10 patienter med avvikande ursprung av en kranskärl i fel sinus (6 patienter med vänster kranskärl med ursprung i höger sinus Valsalva och 4 med höger kranskärl med ursprung i vänster sinus Valsalva). Med hjälp av TTE med färgdopplerteknik observerade de ett intramuralt förlopp inom aortaväggen hos nio av patienterna och ett intramyokardialt förlopp hos den återstående patienten. När förloppet hos en CAA som har sitt ursprung i fel sinus är intramuralt kan det se ut som om den kommer ut från sitt normala ostium. Författarna rekommenderar därför användning av färgdoppler för att bestämma flödesriktningen när det är nödvändigt att utesluta förekomsten av en anomali.
Förbättringar i ekokardiografiska avbildningstekniker gör det möjligt för oss att bestämma ursprunget och följa det initiala förloppet av en CAA i vissa patientgrupper. Studier har genomförts på barn, ungdomar och elitidrottare, men stora serier som omfattar den normala vuxna befolkningen har ännu inte studerats. Därför bör identifieringen av kranskärlsostierna hos unga patienter med denna symtomatologi utföras systematiskt vid TTE-undersökningen.7,26
I patienter med ett dåligt ekokardiografiskt fönster, eller när diagnostiska tvivel kvarstår trots de kliniska indikationerna, för att möjliggöra visualisering av CAA:s ursprung och initiala förlopp, kan transesofageal ekokardiografi (TEE),7,26,42,43 datortomografi (CT)26,44-46–med elektronstråle eller multislice–(Figur 3) eller kardiell magnetisk resonanstomografi (CMRI)26,47,48 utföras (Figur 4).

Figur 3. Multidetektor datortomografisk bild som visar den cirkumflexa koronarartären (Cx) som har sitt ursprung i den högra koronarartären (CD) och som följer ett retroaortiskt förlopp för att komma till sitt normala distributionsområde. Ao anger aorta, AP lungartär. Med tillstånd av dr Gabriel C. Fernández, Servicio de Radiología, Hospital Povisa, Vigo, Spanien.
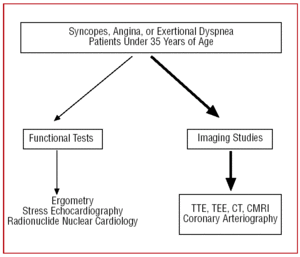
Figur 4. Diagnostiskt protokoll som föreslås för patienter under 35 år med misstänkt kranskärlsavvikelse. CMRI anger kardiell magnetresonanstomografi; CT, datortomografi; TEE, transesofageal ekokardiografi; TTE, transtorakal ekokardiografi.
Vilken teknik ska vi använda och i vilken ordning? Varje medicinskt team bör svara på denna fråga i enlighet med tillgängliga tekniker och sin erfarenhet. Vad vi bör göra är att identifiera CAA och dess initiala förlopp med hjälp av den minst invasiva teknik som är tillgänglig för oss. Även om TEE har använts för att diagnostisera och identifiera det initiala förloppet av vissa CAA anser vi att den, med tanke på dess semi-invasiva karaktär, bör användas först när andra tekniker har misslyckats. I dag, på grund av den ökande tillgängligheten och de utmärkta tredimensionella bilder som kan erhållas, förefaller det klokt att välja multidetektor-CT (figur 5) eller CMRI.49,50 Standardkoronararteriografi skulle vara indicerat om de andra testerna inte resulterar i en definitiv diagnos. I detta avseende rekommenderas i den 36:e Bethesda-konferensen51 för urval av tävlingsidrottare med kardiovaskulära anomalier som publicerades i april 2005: ”Koronära anomalier bör övervägas hos idrottare med ansträngningssynkope eller symtomatisk kammararytmi och bör undersökas med hjälp av lämpliga undersökningar, t.ex. ekokardiografi, CMR eller ultrasnabb datortomografi. Koronarangiografi är indicerat om andra undersökningar inte är diagnostiska.” Kort sagt, de väljer inte 1 diagnostisk studie eller en annan.
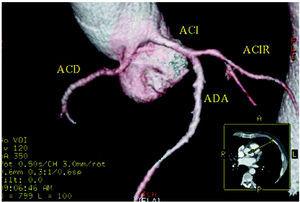
Figur 5. Multislice datortomografi (16 skikt); tredimensionell renodlad rekonstruktion som visar höger kranskärl (ACD) som har sitt ursprung i vänster sinus of Valsalva. ACI indiactes left coronary artery; ACIR, circumflex coronary artery; ADA, anterior descending coronary artery. Med tillstånd av Dr Joaquín Alonso, Servicio de Cardiología y Servicio de Diagnóstico por Imagen, Hospital de Fuenlabrada, Madrid, Spanien.
I patienter över 35 år som uppvisar kliniska tecken på angina pectoris eller upprepad synkope, efter funktionstestet (ergometri, ansträngningsekokardiografi etc.), utförs vanligen en kateterisering, eftersom den högre incidensen av åderförkalkning leder till en misstanke om kranskärlssjukdom. På vissa centra som är utrustade med tekniken kan patienter med en atypisk klinisk bild genomgå en första screening med multidetector CT eller CRMI. I båda fallen skulle CAA vara ett fynd (figur 6).
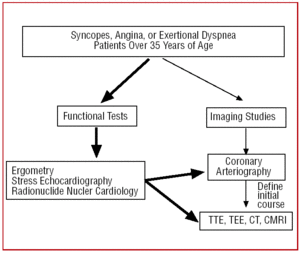
Figur 6. Diagnostiskt protokoll som föreslås för patienter över 35 år med misstänkt kranskärlsavvikelse. CRM anger kardiell magnetresonanstomografi; CT, datortomografi; TEE, transesofageal ekokardiografi; TTE, transtorakal ekokardiografi.
Hur identifieras det initiala förloppet av en kranskärlsanomali?
Detta är en av de mest komplexa punkterna i studiet av CAA och utgör en grundläggande aspekt i riskidentifieringen.
För att börja måste vi ta hänsyn till det faktum att namnet och karaktären på en kranskärlsartär definieras av det område de försörjer, inte av deras ursprung. En koronar som utgår från höger sinus Valsalva och förgrenar sig för att försörja territorierna för de främre nedåtgående och cirkumflexa (Cx) artärerna är således inte en höger koronarartär utan en vänster huvudkoronarartär med ursprung i fel sinus. När en koronarartär utgår från fel sinus förblir namnet, arten och till och med funktionen densamma; endast dess ursprung och initiala förlopp är avvikande.2
När en avvikande koronarartär utgår från fel sinus Valsalva kan den nå sitt normala försörjningsområde via minst fem olika vägar2,52:
1. Retrokardialt, bakom mitral- och trikuspidalventilerna.
2. Retroaortikalt, vanligen följt av Cx med ursprung i höger sinus Valsalva eller i höger kranskärl, i anslutning till den bakre aortaväggen, i spåret mellan förmaket och aorta (sinus transversus) (figur 3).
3. Preaortisk eller interarteriell (mellan aorta och lungartär), där den onormala högra koronarkärlet, vänster främre nedåtgående eller vänster huvudkoronarkärlet korsar septum eller det aortopulmonära utrymmet. Detta är det förlopp som oftast har relaterats till tecken på ischemi och/eller plötslig död (figur 7 och 8).
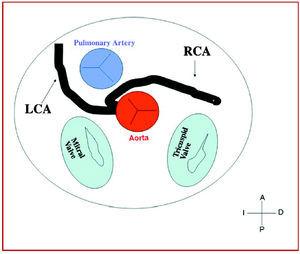
Figur 7. Diagram som visar det interarteriella förloppet hos en höger koronarartär (RCA) med ursprung i sinus controlateral.
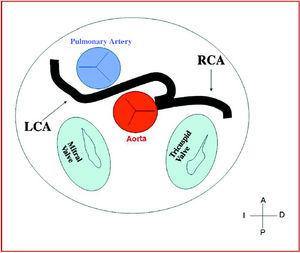
Figur 8. Diagram som visar det interarteriella förloppet för en vänster koronarartär (LCA) som har sitt ursprung i sinus controlateral.
4. Intraseptalt, genom den övre delen av den intraventrikulära septum. Den är intramyokardiell i de flesta fall och känns igen på angiografi på grund av den systoliska förträngningen, som liknar en myokardiell bro, och på grund av att det vanligtvis finns 1 eller 2 septala perforatorförgreningar i denna zon (figur 9).

Figur 9. Diagram som visar det intraseptala förloppet av en vänster koronarartär (CI) som har sitt ursprung i höger sinus Valsalva.
5. Prekardiell eller prepulmonell, kännetecknas av sitt subepikardiella läge, i den främre väggen av höger ventrikels utflödeskanal eller infundibulum. Denna passage följs vanligen av en avvikande höger koronar, vänster huvudstam eller vänster främre nedåtgående koronarartär.
Andra möjliga förlopp eller till och med flera förlopp hos en viss patient har rapporterats.2
Hur kan dessa initiala förlopp identifieras med hjälp av koronarangiografi? Ursprungligen ansågs det att införandet av en styrtråd i lungartären följt av koronararteriografi i lateralprojektion skulle vara tillräckligt för att fastställa förhållandet mellan anomalin och de stora kärlen. Denna teknik är dock av begränsat värde eftersom till exempel i en lateral vy skulle både det septala och det interarteriella förloppet tyckas ligga posteriort till lungartären och anteriort till aorta när det septala förloppet i verkligheten ligger kaudalt till båda kärlen.53
Olika koronarangiografiska kännetecken för igenkänning av anomalin och dess initiala förlopp, till och med före visualisering, har också rapporterats. I detta avseende föreslår Page et al54 två tecken som gör det möjligt att känna igen ett onormalt ursprung för Cx och dess initiala förlopp:
1. Tecknet ”operfunderat myokardium”. Under den selektiva opakifieringen av vänster kranskärl kan vi observera ett avaskulärt område i den posterolaterala zonen av vänster kammare som indikerar det onormala ursprunget av Cx. Det är först nödvändigt att injicera ett kontrastmedel i vänster kranskärlssinus för att utesluta inblandning av ostior som är oberoende av de främre nedåtgående och Cx-arterierna. Om identifieringen av Cx inte är tydlig bör man dock komma ihåg att det är vanligare att observera att Cx har sitt ursprung i höger koronarsinus eller i höger kranskärl än att det finns separata ostior i vänster koronarsinus.55
2. Tecknet med ”aortisk rot”. Vid ventrikulografi visar den högra främre snedprojektionen konturen av den onormala Cx och följer dess förlopp när den passerar bakom höger koronarsinus (figur 10).
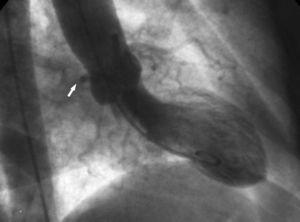
Figur 10. Ventrikulografi i höger främre snedprojektion som visar konturen av den anomala cirkumflexartären (pil) som passerar bakom höger koronarsinus; detta är känt som aortikarotstecken eller Page’s tecken.
I 1985 föreslog Ishikawa et al,56 som följdes av Serota et al 1990,57 en rad koronararteriografiska kriterier som var avsedda att definiera förhållandet, längs det initiala förloppet, mellan det anomala kärlet och aortan och lungartären (Figur 11). Dessa författare försökte identifiera de olika förloppen på grundval av orienteringen av den ”slinga” som bildas av det avvikande kranskärlet i förhållande till resten av kranskärlsträdet56 eller genom att tillämpa begreppet ”prick” (visualisering av CAA:s kontrastpelare som på grund av den vändning som den gör antar morfologin av en prick57).
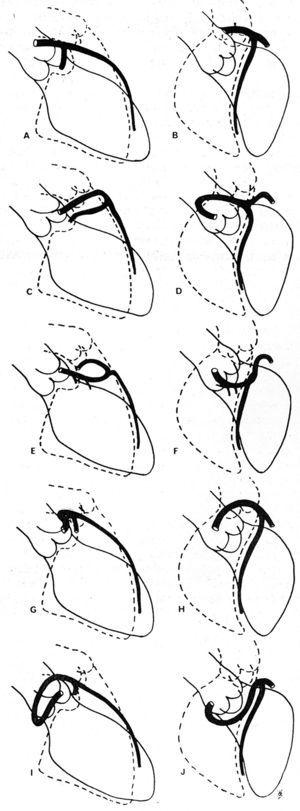
Figur 11. Illustrationer av koronarangiografiskac bilder av vänster främre nedåtgående och proximala cirkumflexa kranskärl i höger främre snedprojektion (A, C, E, G, I) och i vänster främre snedprojektion (B, D, F, H, J), som visar de olika möjliga initiala förloppen för en vänster kranskärl som har sitt ursprung i höger sinus of Valsalva. A och B representerar en normal kranskärlsartär; C och D visar en anterokranial ”slinga”, som beskrivs i det främre förloppet; E och F: anterokaudal ”slinga”, septalt förlopp; G och H: posterokranial ”slinga”, interarteriellt förlopp; I och J: posterokaudal ”slinga”, retroaortiskt förlopp. Taget från Ishikawa et al.56
I många fall är det svårt att identifiera CAA:s initiala förlopp med hjälp av koronarangiografi eftersom denna teknik ger en tvådimensionell bild av kranskärlsträdet, som är en komplex tredimensionell struktur. Interventionell kardiolog med erfarenhet av diagnos av CAA kan koronarangiografin vara tillräcklig för att korrekt identifiera förloppet. Med tanke på den låga förekomsten har de flesta interventionella kardiologer dock begränsad erfarenhet av att undersöka CAA. I de allra flesta fall är de därför inte korrekt beskrivna. I ett nyligen genomfört register som omfattade 13 spanska sjukhus identifierades inte det initiala förloppet av den CAA som rapporterades i majoriteten av fallen.16
Därmed krävs det i många fall ytterligare en bildteknik för att identifiera det initiala förloppet av en CAA med ursprung i fel bihåla för att identifiera det initiala förloppet. Som vi nämnde ovan kan både TTE och TEE användas för detta ändamål, men med tanke på den ökande tillgången på våra sjukhus till icke-invasiva tekniker som ger en mer korrekt och exakt definition av den koronära anatomin och dess förhållande till intilliggande strukturer hos patienter som kan vara kandidater för kirurgi, väljer vi CMRI eller multidetector CT35,37,47,49.
Vad är det bästa terapeutiska tillvägagångssättet?
Detta är en av de mest kontroversiella aspekterna av detta tillstånd eftersom inga officiella riktlinjer har fastställts i detta avseende.
När CAA väl har diagnostiserats och karakteriserats verkar det logiskt att försöka avgöra om den framkallar myokardiell ischemi eller inte. Om patienten har haft en hjärtinfarkt (utan påvisbart samband med ateroskleros) eller har genomgått återupplivning för plötslig död som kan tillskrivas anomalin och är under 35 år, rekommenderar de flesta författare revaskularisering24,26,35 .
Ett thallium-stresstest eller ekokardiografi under läkemedels- eller ansträngningsinducerad stress som visar reversibel ischemi i anomalins territorium kommer att underlätta beslutsprocessen.36
Vad ska man göra när det gäller unga, asymtomatiska personer hos vilka CAA upptäcks av en tillfällighet om riskkriterierna uppfylls, men stresstestet inte ger några tecken på ischemi? För det första bör patienten anta en stillasittande livsstil.26,35
Corrado et al jämförde plötslig död hos unga idrottsmän och icke idrottsmän och endast de som tillskrevs CAA eller arytmogen högerkammardysplasi var förknippade med ansträngning.58 När det gäller behandling är revaskularisering kontroversiell, men det finns författare som väljer detta tillvägagångssätt eftersom den plötsliga döden hos dessa patienter är oförutsägbar och kan vara det första tecknet på CAA.24,26,34,35 Vissa författare stöder årliga uppföljningsbesök i dessa fall, med ekokardiografier eller thalliumstristest, och baserar sina beslut på resultaten.7,36 Efter den kirurgiska behandlingen åtnjuter patienterna en normal livsstil, inklusive deltagande i idrott.25,34,49
I patienter över 35 år måste besluten fattas på individuell basis. Risken för plötslig död är lägre, men eftersom CAA kan provocera symtomatisk myokardiell ischemi utförs i vissa fall revaskularisering (figur 12).24,26
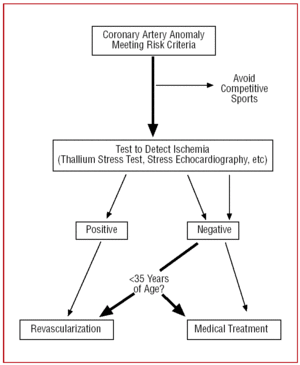
Figur 12. Terapeutiskt protokoll som föreslås för koronara anomalier med ursprung i kontralaterala sinus of Valsalva i närvaro av riskfaktorer.
Vissa grupper undersöker användningen av vissa diagnostiska protokoll (intrakoronar ekokardiografi för att bedöma det onormala koronarostiumet i vila och efter dobutamininfusion eller vätskeöverbelastning)59 eller användningen av intrakoronära tryckkablar för att upptäcka ischemi.60
Som kan konstateras förefaller det rimligaste tillvägagångssättet, tills officiella riktlinjer har fastställts i denna fråga, vara att för det första bekräfta om patientens ålder och CAA:s anatomi är förknippade med risk och för det andra verifiera att den kranskärlsischemi (som presenteras av patienten eller som påvisas) tydligt är framkallad av anomalin.
HUR SKULLE REVASKULARISERINGEN GENOMFÖRAS?
Logiskt sett är det nödvändigt att behandla varje fall individuellt utifrån den koronära anatomin; revaskularisering kan således vara antingen kirurgisk eller perkutan.
Kirurgisk revaskularisering innebär aortokoronar bypass, ostial reimplantation eller unroofing-tekniken, som frigör det intramurala segmentet av CAA med hjälp av ett snitt i den vägg som delas av CAA och aorta, och på så sätt skapar en ny, större öppning i den lämpliga sinus.61,62 Det råder stor oenighet om kirurgisk revaskularisering hos dessa patienter, särskilt hos unga människor. Aortokoronar bypassgrafting har kritiserats starkt7,63 på grund av dess ”begränsade” genomsläpplighet och det oundvikliga konkurrerande flödet mellan bypasset och CAA. Därför används allt oftare tekniken för att avlägsna taket, som verkar vara mer fysiologisk,62
Perkutan intervention, med implantation av stents i området för kompressionen mellan de stora kärlen och i det onormala ostiumet, har utförts i flera fall, hos vuxna, med kortsiktig framgång.64 Hittills är kirurgisk revaskularisering att föredra hos unga patienter och det perkutana ingreppet utförs endast hos vuxna.26,62-64 Uppenbarligen är det i båda fallen nödvändigt med långtidsuppföljning.
ÄR MEDICINSK BEHANDLING ETT OPTION?
Frånvaron av serier och kontrollerade studier gör det svårt att svara på denna fråga. Det finns rapporter som omfattar 2- och 5-årsuppföljning hos patienter som eller patienter som vägrade operation, där tillvägagångssättet var antingen avvaktande behandling eller behandling med betablockerare, och bland dem fanns inga fall av plötslig död.65-68 Vissa författare argumenterar dock mot beslutet att inleda ”livslång” behandling hos barn och ungdomar.7
GRAVLIGA OSLÖSTA PROBLEM
Den verkliga risken för plötslig död som är förknippad med varje anomali är okänd.5 Anledningen till detta är att risken beräknas på grundval av obduktionsstudier, som inte anger den verkliga risken för att en person ska dö till följd av en CAA, utan antyder möjligheten att en person som har drabbats av plötslig död har en CAA.7 Dessutom kan de beräknade riskerna vara överskattade i förhållande till den allmänna befolkningen eftersom de erhålls från serier av tävlingsidrottare som, vilket har rapporterats, har en två gånger högre risk för plötslig död än en stillasittande person.69 Vi vet att risken för plötslig död till följd av en CAA är större hos unga människor; i själva verket rekommenderas det ena eller andra terapeutiska tillvägagångssättet beroende på om patienten är yngre än 30 eller 35 år. Dessa gränsvärden är baserade på de få studier som har behandlat denna fråga23,25 och bör därför endast betraktas som vägledande. Av denna anledning bör det terapeutiska tillvägagångssättet alltid beslutas på individuell basis.
Om den kirurgiska lösningen som beskrivs ovan antas måste man ta hänsyn till att det inte finns några serier där patienternas förlopp studerats under mer än två år. Till osäkerheten om bypassens genomgångsförmåga tillkommer den eventuella skada på aortaklaffen som avtakningsförfarandet kan ge upphov till. I detta avseende finns det rapporter om aortainsufficiens eller till och med klaffbyte efter detta ingrepp.7,70 Vi måste komma ihåg att hjärtkirurgi alltid innebär en risk för neurologiska komplikationer, vars incidens hos ungdomar har uppskattats till cirka 2,3 %.71
Sluttligen rekommenderar riktlinjerna för urval av tävlingsidrottare med kardiovaskulära anomalier att patienter med CAA ska uteslutas från alla tävlingsidrotter.51 Ännu en gång har man extrapolerat data från en population av idrottsmän till den allmänna befolkningen. Hos en tonåring kan begreppet ”tävlingsidrott” vara svårt att definiera. Att förbjuda en tonåring eller ung vuxen att delta i gymnastiklektioner eller i den sport han eller hon kanske tycker om kan dessutom orsaka mer skada än nytta. Kanske bör ansträngande sporter undvikas, men inte en mindre krävande sport.7
KONKLUSION
Koronarartärer som har sitt ursprung i fel sinus Valsalva utgör den grupp CAA som oftast är förknippad med myokardischemi och framför allt med plötslig död.
Misstankeindexet för denna anomali bör vara högt hos unga patienter som uppvisar kliniska tecken på angina pectoris, dyspné eller ansträngningssynkope. I dessa fall bör TTE utföras för att försöka identifiera ostia och det initiala förloppet för båda kranskärlen.
Vi bör tydligt definiera det initiala förloppet för varje avvikande kranskärl, med hjälp av avbildningstekniker som TTE, TEE eller, företrädesvis, multidetector CT eller CMRI, i enlighet med vårt sjukhus egenskaper.
Vi måste prioritera inrättandet av nationella och internationella register som gör det möjligt för oss att fastställa incidensen av dessa anomalier, liksom de tillhörande morbiditets- och mortalitetssiffrorna, prognos, behandling, eventuella genetiska eller miljömässiga influenser och, kort sagt, lära oss så mycket som möjligt om detta.
Det är nödvändigt att genomföra en långtidsuppföljning av patienter som genomgått kirurgi för CAA, särskilt unga människor. I vilket fall som helst kan revaskularisering (kirurgisk eller perkutan) vara en giltig för patienter med denna typ av sjukdom.
KACKANMÄRKNINGAR
Vi tackar Dr Joaquín Alonso och Dr Gabriel C. Fernández för deras hjälp med att erhålla multidetector datortomografibilderna.