Lärandemål
- Hänvisa grundämnenas elektronkonfigurationer till formen på det periodiska systemet.
- Bestäm den förväntade elektronkonfigurationen för ett grundämne utifrån dess plats i det periodiska systemet.
I kapitel 3 ”Atomer, molekyler och joner” introducerade vi det periodiska systemet som ett verktyg för att organisera de kända kemiska grundämnena. Ett periodiskt system visas i figur 8.11 ”Det periodiska systemet”. Grundämnena listas efter atomnummer (antalet protoner i kärnan), och grundämnen med liknande kemiska egenskaper grupperas i kolumner.
Figur 8.11 Det periodiska systemet
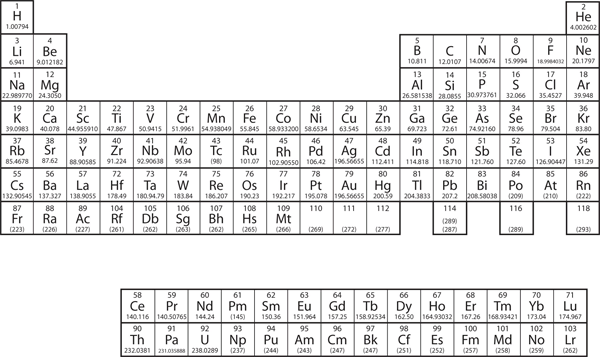
Varför har det periodiska systemet den struktur det har? Svaret är ganska enkelt, om man förstår elektronkonfigurationer: det periodiska systemets form efterliknar fyllningen av underskalorna med elektroner.
Låt oss börja med H och He. Deras elektronkonfigurationer är 1s1 respektive 1s2; med He är skalet n = 1 fyllt. Dessa två grundämnen utgör den första raden i det periodiska systemet (se figur 8.12 ”1:an”).
Figur 8.12 1s-subskalet
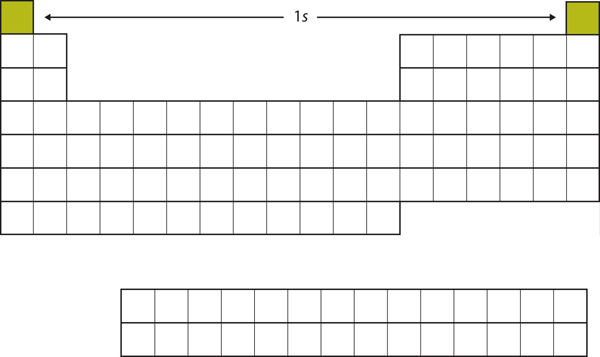
H och He representerar fyllningen av 1s-subskalet.
De nästa två elektronerna, för Li och Be, skulle gå till 2s-subskalet. Figur 8.13 ”2:an” visar att dessa två grundämnen ligger intill varandra i det periodiska systemet.
Figur 8.13 2s-subskalet
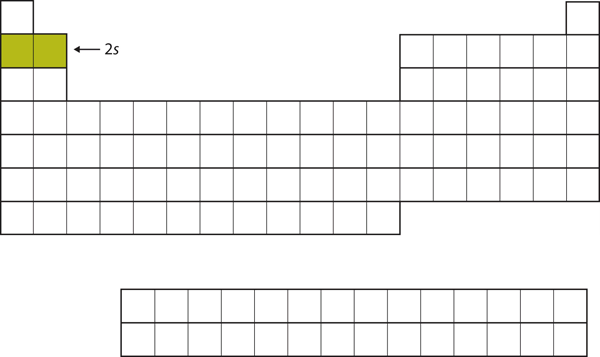
I Li och Be fylls 2s-subskalet.
För de följande sex grundämnena tas 2p-subskalet upp med elektroner. På den högra sidan av det periodiska systemet är dessa sex grundämnen (B till Ne) grupperade tillsammans (figur 8.14 ”The 2”).
Figur 8.14 2p-subskalet
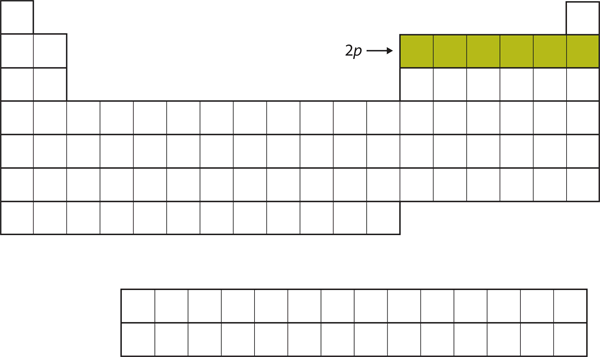
För B till Ne är 2p-subskalet ockuperat.
Nästkommande subskal som fylls är 3s-subskalet. De grundämnen när detta underskal fylls, Na och Mg, är tillbaka på den vänstra sidan av det periodiska systemet (figur 8.15 ”The 3”).
Figur 8.15 3s-subskalet
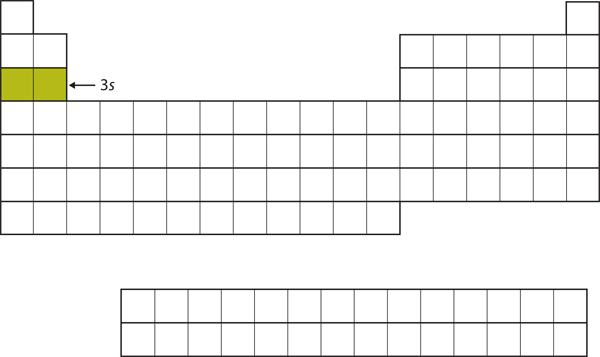
Nu är 3s-subskalet upptaget.
Nästan fylls 3p-subskalet med de nästa sex grundämnena (figur 8.16 ”The 3”).
Figur 8.16 3p-subskalet
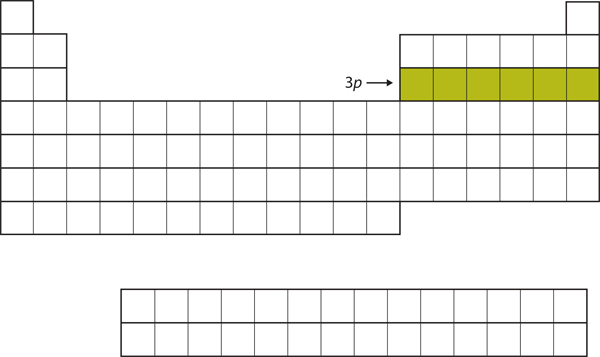
Nästan fylls 3p-subskalet med elektroner.
Istället för att fylla 3d-subskalet härnäst går elektronerna in i 4s-subskalet (Figur 8.17 ”The 4”).
Figur 8.17 Det 4s underskalet
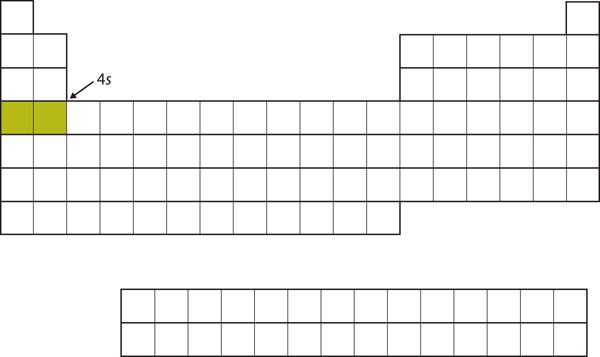
Det 4s underskalet fylls före 3d underskalet. Detta återspeglas i det periodiska systemets struktur.
När 4s-subskalet är fyllt fylls 3d-subskalet med upp till 10 elektroner. Detta förklarar avsnittet med 10 grundämnen i mitten av det periodiska systemet (figur 8.18 ”The 3”).
Figur 8.18 3d-subskalet
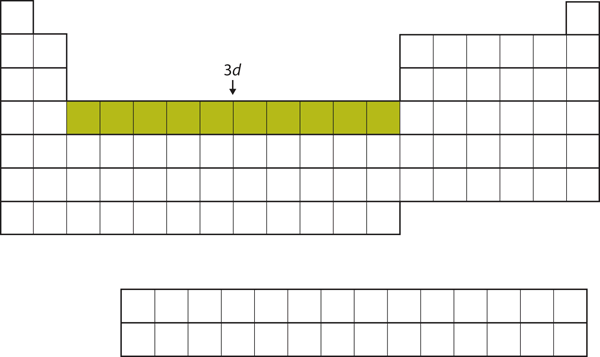
Det 3d-subskalet fylls i den mellersta delen av det periodiska systemet.
Och så vidare. När vi går över raderna i det periodiska systemet beskriver tabellens övergripande form hur elektronerna besätter skal och underskal.
De två första kolumnerna på den vänstra sidan av det periodiska systemet är de två första kolumnerna där s-underskalet är upptaget. På grund av detta kallas de två första raderna i det periodiska systemet för s-blocket. På samma sätt är p-blocket de sex kolumnerna längst till höger i det periodiska systemet, d-blocket de tio mittersta kolumnerna i det periodiska systemet, medan f-blocket är den sektion med 14 kolumner som normalt avbildas som fristående från huvuddelen av det periodiska systemet. Det skulle kunna vara en del av huvuddelen, men då skulle det periodiska systemet bli ganska långt och otympligt. Figur 8.19 ”Blocks on the Periodic Table” visar blocken i det periodiska systemet.
Figur 8.19 Blocks on the Periodic Table
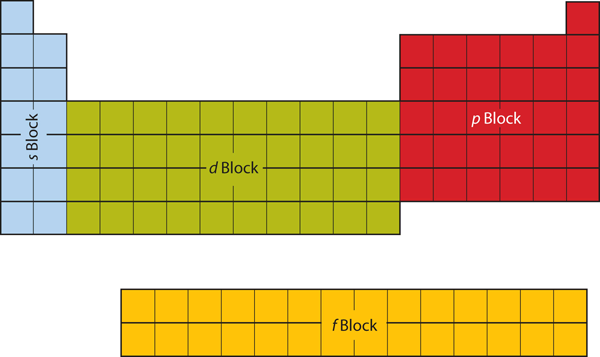
Det periodiska systemet är indelat i block beroende på vilket underskal som fylls för de atomer som hör hemma i den sektionen.
Elektronerna i det högst numrerade skalet, plus eventuella elektroner i det sista ofyllda underskalet, kallas för valenceelektroner; det högst numrerade skalet kallas för valenceskalet. (De inre elektronerna kallas kärnelektroner.) Valenceelektronerna styr till stor del kemin i en atom. Om vi bara tittar på valensskalets elektronkonfiguration finner vi att i varje kolumn är valensskalets elektronkonfiguration densamma. Ta till exempel grundämnena i den första kolumnen i det periodiska systemet: H, Li, Na, K, Rb och Cs. Deras elektronkonfigurationer (förkortat för de större atomerna) är följande, med valensskalets elektronkonfiguration markerad:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
De har alla en liknande elektronkonfiguration i sina valensskal: en enda s-elektron. Eftersom en stor del av ett grundämnes kemi påverkas av valenselektronerna skulle vi förvänta oss att dessa grundämnen skulle ha liknande kemi – och det har de. Elektronernas organisation i atomer förklarar inte bara formen på det periodiska systemet utan också det faktum att grundämnen i samma kolumn i det periodiska systemet har liknande kemi.
Samma koncept gäller för de andra kolumnerna i det periodiska systemet. Elementen i varje kolumn har samma elektronkonfigurationer i valensskalet, och elementen har vissa liknande kemiska egenskaper. Detta gäller strikt för alla grundämnen i s- och p-blocken. I d- och f-blocken är likartade valensskal inte absoluta i dessa block, eftersom det finns undantag från ordningen för fyllning av underskal med elektroner, och därför är likartade valensskal inte absoluta i dessa block. Många likheter finns dock i dessa block, så en likhet i kemiska egenskaper är förväntad.
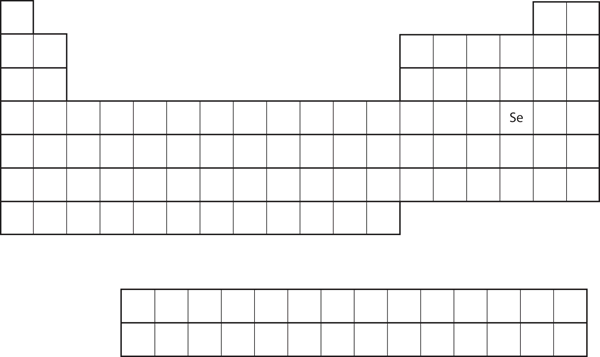
Likheten i valensskalets elektronkonfiguration innebär att vi kan bestämma elektronkonfigurationen hos en atom enbart genom dess position i det periodiska systemet. Ta Se, som visas i figur 8.20 ”Selen i det periodiska systemet”. Den befinner sig i den fjärde kolumnen i p-blocket. Detta innebär att dess elektronkonfiguration bör sluta i en p4-elektronkonfiguration. Elektronkonfigurationen för Se är faktiskt 4s23d104p4, som förväntat.
Figur 8.20 Selen i det periodiska systemet
Exempel 8
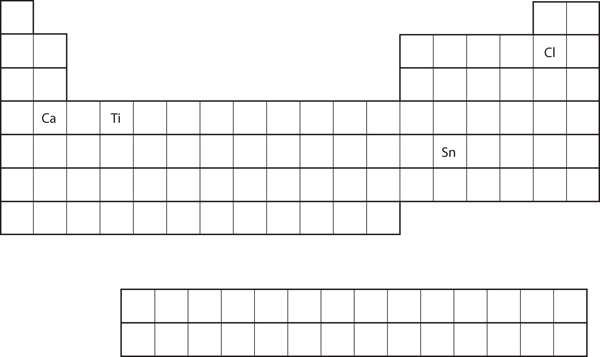
Utifrån grundämnets position i det periodiska systemet, förutsäga elektronkonfigurationen i valensskalet för varje atom. Se figur 8.21 ”Olika grundämnen i det periodiska systemet”.
- Ca
- Sn
Lösning
- Ca är placerad i andra kolumnen i s-blocket. Vi skulle förvänta oss att dess elektronkonfiguration skulle sluta med s2. Kalciums elektronkonfiguration är 4s2.
Sn ligger i den andra kolumnen i p-blocket, så vi förväntar oss att dess elektronkonfiguration skulle sluta med p2. Tins elektronkonfiguration är 5s24d105p2.
Testa dig själv
Utifrån grundämnets position i det periodiska systemet, förutsäg elektronkonfigurationen i valensskalet för varje atom. Se figur 8.21 ”Olika grundämnen i det periodiska systemet”.
- Ti
- Cl
Svar
- 4s23d2
- 3s23p5
Figur 8.21 Olika grundämnen i det periodiska systemet
Mat och dryck App: Konstgjorda färger
Färgen på föremål kommer från en annan mekanism än färgerna i neon och andra urladdningsljus. Även om färgade lampor producerar sina färger är föremålen färgade eftersom de företrädesvis reflekterar en viss färg från det vita ljuset som lyser på dem. En röd tomat är till exempel knallröd eftersom den reflekterar rött ljus samtidigt som den absorberar alla andra färger i regnbågen.
Många livsmedel, till exempel tomater, är starkt färgade; faktum är att det vanliga uttalandet ”man äter med ögonen först” är ett underförstått erkännande av att matens visuella attraktionskraft är lika viktig som dess smak. Men hur är det med bearbetade livsmedel?
Många bearbetade livsmedel har tillsatts färgämnen. Det finns två typer av färgämnen: naturliga och konstgjorda. Naturliga färgämnen är bland annat karamelliserat socker som ger brunt, annatto, gurkmeja och saffran som ger olika nyanser av orange eller gult, betanin från rödbetor som ger lila och till och med karmin, ett djupt rött färgämne som utvinns ur cochenill, en liten insekt som är en parasit på kaktusar i Central- och Sydamerika. (Det stämmer: du kanske äter insektsjuice!)
Vissa färgämnen är konstgjorda. I USA godkänner Food and Drug Administration för närvarande endast sju föreningar som konstgjorda färgämnen i livsmedel, drycker och kosmetika:
- FD&C Blue #1: Brilliant Blue FCF
- FD&C Green #3: Fast Green FCF
- FD&C Yellow #5: Tartrazin
FD&C Blue #2: Indigotine
RD&C Red #3: Erythrosine FD&C Red #40: Allura Red AC
FD&C Yellow #6: Sunset Yellow FCF
Färger med lägre nummer finns inte längre på marknaden eller har tagits bort av olika skäl. Vanligtvis är dessa konstgjorda färgämnen stora molekyler som absorberar vissa ljusfärger mycket starkt, vilket gör dem användbara även i mycket låga koncentrationer i livsmedel och kosmetika. Vissa kritiker hävdar att en liten del av befolkningen (särskilt barn) är känsliga för konstgjorda färgämnen, även i så låga mängder, och kräver att användningen av dem begränsas eller stoppas. Formella studier av konstgjorda färgämnen och deras effekter på beteendet har dock varit ofullständiga eller motsägelsefulla. Trots detta fortsätter de flesta människor att njuta av bearbetade livsmedel med konstgjorda färgämnen (som de som visas i figuren bredvid).

Konstgjorda livsmedelsfärgämnen finns i en mängd olika livsmedelsprodukter, till exempel bearbetade livsmedel, godis och äggfärgningsmedel. Till och med djurfoder innehåller konstgjorda livsmedelsfärger, även om det är troligt att djuret inte bryr sig!
Källa:
Nyckelresultat
- Elektronernas placering i atomer är ansvarig för det periodiska systemets form.
- Elektronkonfigurationer kan förutsägas genom en atoms position i det periodiska systemet.
Övningar
-
Var i det periodiska systemet är d-subskal upptagna av elektroner?
-
I vilket block finns Ra?
-
I vilket block finns Br?
-
Vad är valensskalets elektronkonfigurationer för grundämnena i den andra kolumnen i det periodiska systemet?
-
Vad är valensskalets elektronkonfigurationer för grundämnena i den näst sista kolumnen i det periodiska systemet?
-
Vad är valensskalets elektronkonfigurationer för grundämnena i den första kolumnen i p-blocket?
-
Vad är valensskalets elektronkonfigurationer för grundämnena i den sista kolumnen i p-blocket?
-
Utifrån grundämnets position i det periodiska systemet, förutse elektronkonfigurationen för varje atom.
Var på det periodiska systemet är s underskal upptagna av elektroner?
a) Sr
b) S
10. Utifrån grundämnets position i det periodiska systemet, förutsäg elektronkonfigurationen för varje atom.
a) Fe
b) Ba
11. Utifrån grundämnets position i det periodiska systemet, förutse elektronkonfigurationen för varje atom.
a) V
b) Ar
12. Utifrån grundämnets position i det periodiska systemet, förutse elektronkonfigurationen för varje atom.
a) Cl
b) K
13. Utifrån grundämnets position i det periodiska systemet, förutse elektronkonfigurationen för varje atom.
a) Ge
b) C
14. Utifrån grundämnets position i det periodiska systemet, förutse elektronkonfigurationen för varje atom.
a) Mg
b) I
Svar
de två första kolumnerna
s-blocket med s
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22p63s23p64s23d3
b) 1s22s22p63s23p613.
a) 1s22s22p63s23p64s23d104p2
b) 1s22s22p2