Introduktion
ß amyloid och fosforylerade tau-proteiner är patologiska kännetecken för Alzheimers sjukdom (AD) som ackumuleras och sprids på ett förutsägbart sätt genom distribuerade neurala nätverk, vilket leder till progressiva metabola abnormiteter, neuronala skador och cellulär död. Neuroimaging underlättar en detaljerad bedömning av dessa patologiska förändringar hos patienter som genomgår en utredning för kognitiv försämring. Tidigare var en definitiv diagnos av Alzheimers sjukdom endast möjlig genom postmortal observation och neuroanatomisk klassificering av dessa proteinaggregat. De senaste framstegen inom molekylär avbildning gör det dock möjligt att visualisera amyloid- och tau-avlagringar i levande mänsklig hjärna och har fört oss närmare en definitiv in vivo-diagnos av Alzheimers sjukdom.
Strukturell avbildning
Riktlinjerna från American Academy of Neurology (AAN) för diagnostisk utredning av personer med kognitiva besvär1 rekommenderar strukturell avbildning av hjärnan med icke-kontrast CT eller MRT hos alla personer med positiv klinisk historia och objektiva kognitiva förändringar. I detta sammanhang är den primära rollen för hjärnavbildning att utesluta icke-degenerativa strukturella lesioner, varav 5 % kanske inte framgår av klinisk historia eller fysisk undersökning2 och är potentiellt behandlingsbara. AAN rekommenderar också att man kliniskt utesluter vaskulär demens (VaD), demens med Lewykroppar (DLB) och frontotemporal demens (FTD). Strukturell avbildning kan förbättra den diagnostiska säkerheten och förändrar den kliniska diagnosen i 19 % till 28 % samt hanteringen av 15 % av de kliniska fallen.2
De avbildningsmodaliteter som är att föredra vid bedömning av strukturell atrofi är CT och MRT. Sjukdomsspecifika mönster av atrofi har beskrivits grundligt och validerats med hjälp av dessa modaliteter. Även om atrofi kan observeras på CT resulterar den inneboende lägre rumsliga upplösningen och den sämre kontrasten mellan grå och vit substans i att potentiellt användbara subtila observationer om neurodegenerativa förändringar går förlorade. Därför förlitar sig kliniker ofta på MRT för att bedöma mönstret och svårighetsgraden av strukturella förändringar, för att utesluta icke-neurodegenerativa orsaker till kognitiv försämring och för att utvärdera svårighetsgraden och omfattningen av förändringar i den vita substansen, vilket diskuteras närmare nedan.
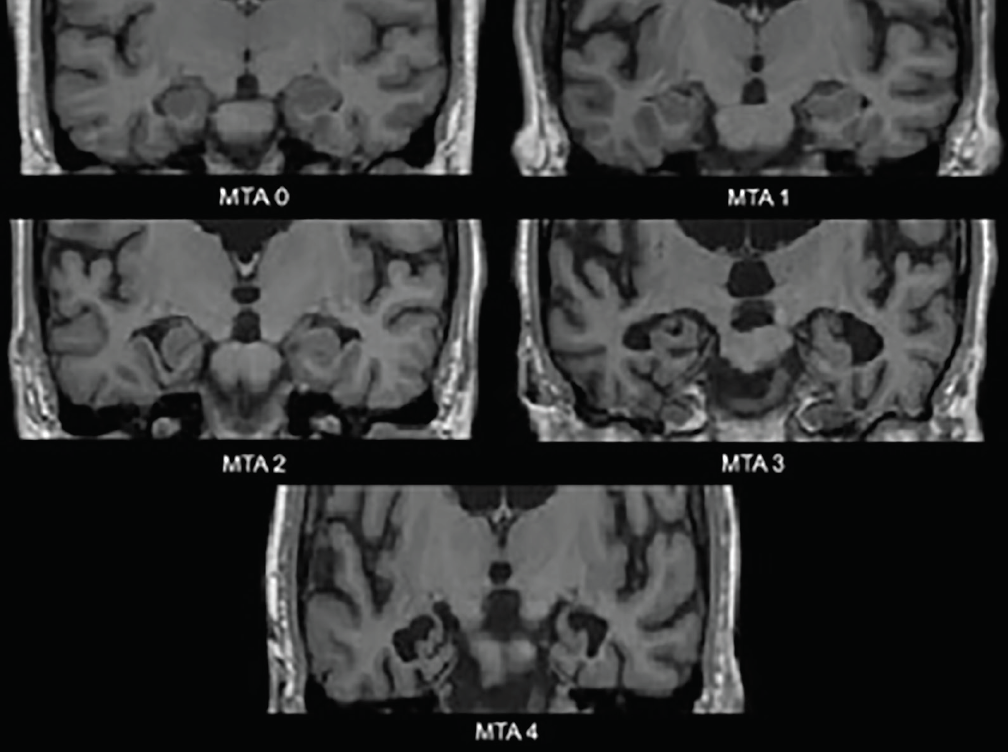
De tidigaste neurodegenerativa förändringarna vid Alzheimers sjukdom inträffar i de mediala tinningloberna – hippocampus, entorhinal cortex och parahippocampal gyrus. I takt med att atrofi inträder utvidgas koroidsprickan och det temporala hornet i den laterala ventrikeln; dessa förändringar bedöms bäst i det koronala planet. En allmänt använd visuell bedömningsskala baserad på dessa strukturer – MTA-skalan (medial temporal atrophy) (figur 1) – har validerats kliniskt3 och neuropatologiskt4 . Olika studier som använder denna skala eller de strukturer som den bedömer har visat sig ha en betydande förmåga att särskilja personer med Alzheimers sjukdom från åldersmatchade kontroller4 eller personer med DLB4 eller vaskulär kognitiv nedsättning (VCI).5 Medial temporal atrofi är också förutsägande för konvertering från amnestisk mild kognitiv nedsättning (MCI) till Alzheimers demens.3
Klicka för att se större
Figur 1. Betyg på skalan för medial temporal atrofi (MTA). MTA 0 – ingen eller minimal öppning av koroidsprickan, MTA 1 – svag utvidgning av koroidsprickan, MTA 2 – ytterligare utvidgning av koroidsprickan som övergår i den laterala ventrikelns temporala horn, mild minskning av hippocampusformationens höjd; MTA 3-måttlig minskning av hippocampusbildningens höjd, framträdande utvidgning av lateralkammarens temporalhorn, MTA 4-stor minskning av hippocampusbildningens höjd, framträdande utvidgning av lateralkammarens temporalhorn.
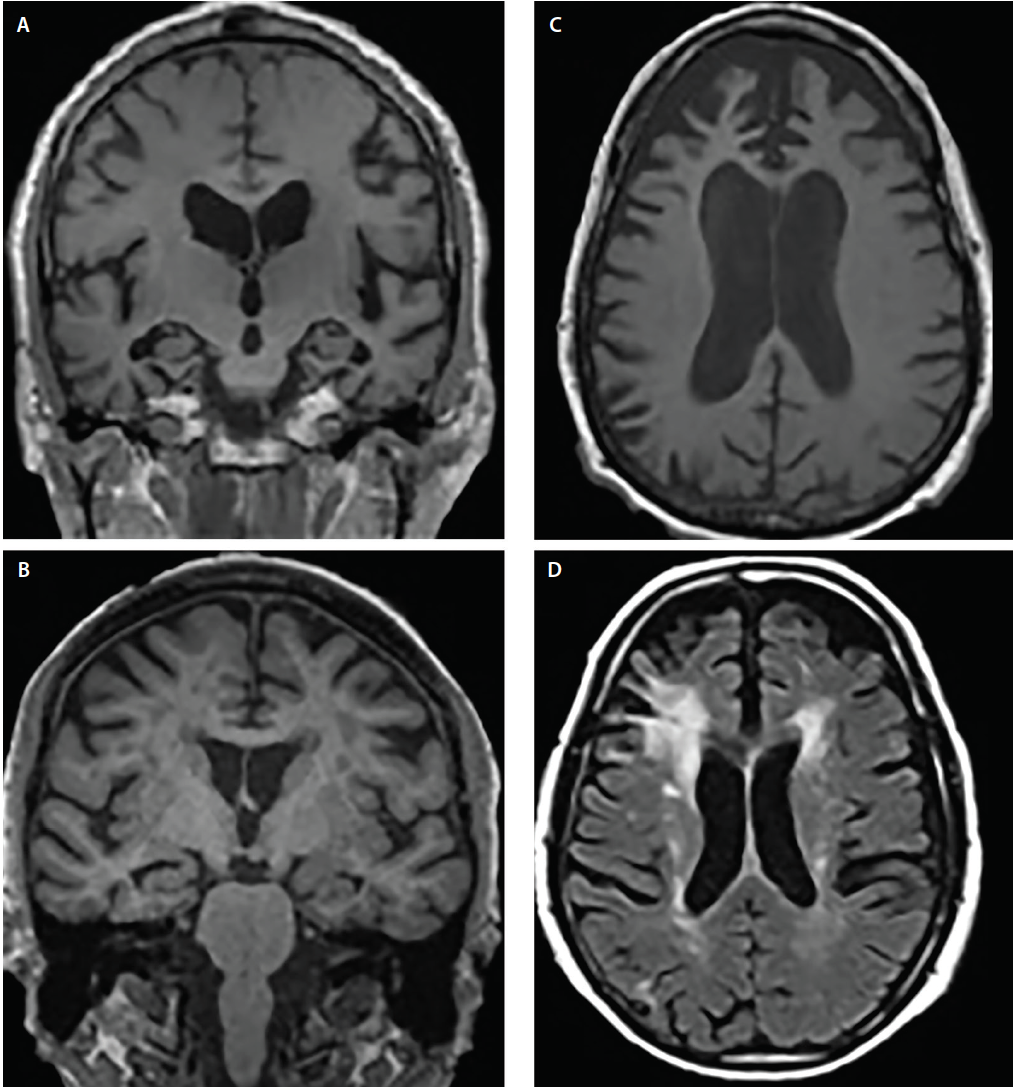
Demenssyndrom uppvisar vanligtvis kanoniska atrofimönster6 som motsvarar kognitiva och beteendemässiga symtom; de berörda strukturerna kan dock överlappa varandra. Till exempel uppvisar både AD och DLB engagemang i den mediala temporalloben, men flera avbildnings- och neuropatologiska studier har visat att DLB, i förhållande till AD, har betydligt mindre förkärlek för mediala temporala strukturer4,5 (figur 2).
Klicka för att se större
Figur 2. Strukturella atrofimönster över Alzheimers sjukdom (AD) (A), demens med Lewykroppar (DLB) (B), frontotemporal demens (FTD) (C) och vaskulär demens (VaD) (D). Koronal T1-viktad MRT visar generaliserad kortikal atrofi men olika grader av hippocampal atrofi i AD (A) och DLB (B). Axial T1-viktad MRT visar bvFTD-atrofi med en fokal förkärlek för de mediala och laterala prefrontala kortiklarna (C). Axial T2-viktad MRT visar konfluenta periventrikulära periventrikulära täckmantel- och halohypointensiteter i vit substans (WMH) som involverar corona radiata och som sträcker sig in i den laterala prefrontala neocortex, milda utspridda WMH och WMH i det subependymala ventrikelfodret och i septum pellucidum i VaD (D).
Både AD och frontotemporal lobardegeneration (FTLD) har överlappande områden med atrofi, inklusive områden i prefrontala, orbitofrontala och främre insulära cortices samt främre och mediala temporallober.6 I förhållande till varandra uppvisar dock AD betydligt mer atrofi i de laterala parietala och occipitala kortiklarna, medan FTLD uppvisar mer atrofi i frontalloberna (figur 2).6
Det är viktigt att systematiskt bedöma alla hjärnområden och notera regioner med både strukturell atrofi och anatomiskt sparande för att utnyttja den diagnostiska avbildningen på bästa sätt. I en stor multicenterstudie bedömdes nyligen förmågan hos 6 visuella skattningsskalor att korrekt klassificera 186 patologiskt bekräftade fall av AD, DLB och FTLD.6 Studien visade att samtidig bedömning av flera sjukdomsspecifika regioner gav betydligt bättre diskriminering än att fokusera på ett enskilt område.4
Kärlskador är ett viktigt övervägande när man bedömer personer med kognitiv nedsättning. Ischemiska förändringar är vanliga vid normalt åldrande och påskyndas av vanliga komorbiditeter (t.ex. högt blodtryck, diabetes och hyperkolesterolemi). Vaskulära bidrag till kognitiv nedsättning kan ofta antas när betydande hyperintensiviteter i vit substans (WMH), kortikala strokes eller strategiskt placerade lacunes upptäcks på T2-viktade sekvenser eller FLAIR-sekvenser (Fluid Attenuated Inversion Recovery). Lakunära stroke i de basala ganglierna och WMH i centrum semiovale och corona radiata är indikatorer på kronisk ischemisk skada i små kärl (figur 2). Däremot är periventrikulära kapslar ofta av ickeischemiskt ursprung och återspeglar subependymal glios.7 Det finns flera WMH-svårighetsskalor (t.ex. Fazekas-skalan)7 som kan användas i kliniska sammanhang. Sådana poängsättningsalgoritmer är alla överens om att utbredd konfluent WMH och subkortikala lacunära infarkter åtminstone delvis sannolikt är bidragande faktorer till kognitiv försämring.7
Diffusionstensorbildning (DTI) är en ny MRI-sekvens som är känslig för vattnets diffusion genom vävnad och som bedömer den vita substansens integritet eftersom axonernas arkitektur begränsar vattenflödet. Medelvärdet för diffusivitet och fraktionell anisotropi används ofta för att karakterisera neurodegenerativa förändringar på DTI. Det förstnämnda måttet mäter storleken på diffusionen och det sistnämnda måttet mäter om vattnet flödar företrädesvis i en enda riktning, vilket förväntas i friska axoner. Minskad genomsnittlig diffusivitet och minskad fraktionell anisotropi har konsekvent rapporterats i både MCI- och demenspopulationer med Alzheimers sjukdom.8 Flera studier har också identifierat DTI-förändringar hos asymtomatiska individer som löper risk att utveckla Alzheimers sjukdom9 , vilket tyder på att dessa förändringar inträffar tidigt i sjukdomsförloppet. Förutom att bedöma den vita substansens integritet kan DTI användas för att modellera grov strukturell konnektivitet mellan kortikala regioner med hjälp av algoritmer för traktografi. Detta har fått ökad betydelse inom området för Alzheimers sjukdom eftersom det finns bevis för att amyloid- och tau-patologi kan spridas via hjärnans förbindelser.10 Även om DTI visar potential som ett mått på den vita substansens integritet begränsar dess känslighet för rörelse och andra tekniska begränsningar dess kliniska tillämpning, åtminstone för tillfället.
Functional Imaging
Hjärnans hypometabolism observeras lätt vid neurodegenerativa sjukdomar och kan hjälpa till med differentialdiagnostik. Neuronernas funktion är beroende av syre och glukos från blodet, vars leverans underlättas av regional vasodilatation. 18F-fluorodeoxyglukos positronemissionstomografi (FDG-PET) återspeglar indirekt graden av kortikal aktivitet och kan lätt användas för att visualisera neurodegenerativa förändringar genom att utnyttja detta metaboliska beroende av glukos.
Den karakteristiska hypometabola kortikala signaturen för Alzheimers sjukdom består av tidiga förändringar i den bakre cingulära hjärnan (PCC), prekuneus, temporal-, parietal- och i senare stadier frontalkortiklarna. Detta mönster visar sig tidigt, till och med presymptomatiskt,11 och är kliniskt användbart för att skilja AD från FTD.12 Till skillnad från AD avslöjar den metabola signaturen för FTD frontal, främre temporal, basal gangliär och thalamisk hypometabolism med relativ skonsamhet i de bakre associativa kortiklarna.13 I kliniskt osäkra situationer kan kliniker använda dessa metaboliska signaturer för att särskilja AD från FTD.12 På samma sätt kan DLB:s neokortikala metaboliska signatur visserligen ha en förvirrande överlappning med AD:s, men DLB-fall kan också uppvisa occipital hypometabolism.14
Center for Medicare & Medicaid Services anser att FDG-PET är ”rimligt och nödvändigt” endast för dem som uppfyller kriterierna för både AD och FTD, där fullständig diagnostisk utredning enligt AAN:s riktlinjer1 inte slutgiltigt har fastställt en etiologi.15
Funktionell MRT (fMRI) kan också mäta hjärnaktivitet genom att använda sekvenser som är känsliga för temporala förändringar av syresatt/syrefattigt hemoglobin till följd av hjärnaktivitet. På detta sätt är fMRI besläktat med FDG-PET eftersom förändringarna i hemoglobin drivs av glukosmetabolismen som krävs för hjärnaktiviteten. Temporala beroenden mellan regioner kan användas för att härleda funktionell konnektivitet (dvs. vilka regioner som kommunicerar aktivt). Jämfört med FDG-PET erbjuder fMRI bättre rumslig upplösning, vilket gör det möjligt att kartlägga konnektiviteten mer exakt. En annan fördel med fMRI är att den kan förvärvas under utförandet av en uppgift eller i vila. I det förstnämnda fallet identifieras konnektivitetsmönster som drivs av specifika aktiva tillstånd, medan det sistnämnda fallet identifierar konnektivitetsmönster som finns i vila och som är kända som standardlägesnätverket (DMN). DMN definieras av funktionella knutpunkter, PCC och precuneus, som är kopplade till ett dorsalt medialis subsystem och ett medialis temporalt subsystem.16 Amyloiddepositionen tros börja i de funktionella knutpunkterna i DMN. Det är känt att DMN påverkas vid Alzheimers sjukdom.16 Däremot är DMN skonat vid FTD medan salience- eller uppmärksamhetsnätverken påverkas.17 För närvarande är fMRI-tekniken begränsad till forskningstillämpningar, men vägar för att utveckla relevanta kliniskt tillämpbara algoritmer utforskas aktivt.
Molekylär avbildning
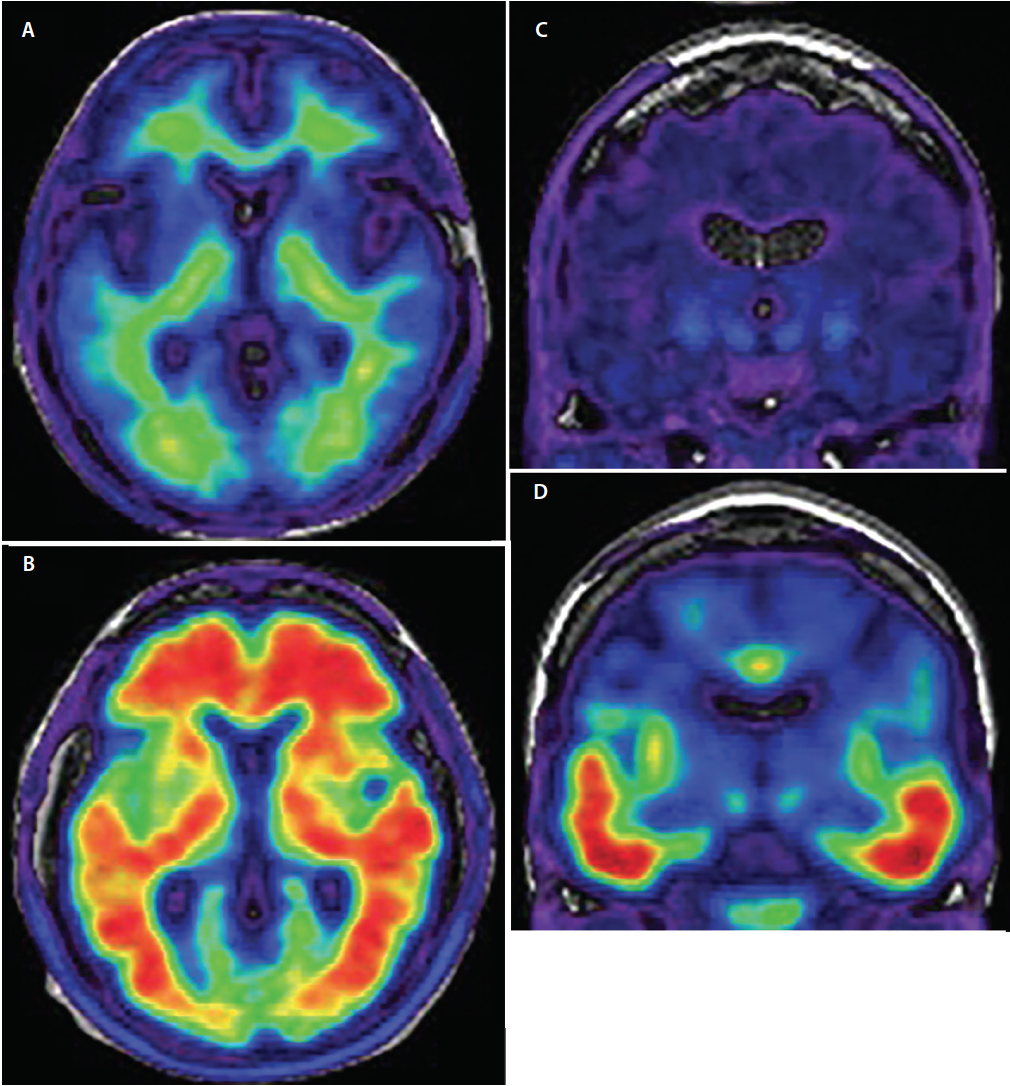
Kriteriestandarden för en slutgiltig diagnos av Alzheimers sjukdom är en neuropatologisk hjärnundersökning efter döden. Även i händerna på erfarna demensexperter når den kliniska diagnosen av Alzheimers sjukdom endast den oroväckande känsligheten på 70,9 % till 87,3 % och specificiteten på 44,3 % till 70,8 %.18 Det mest relevanta för förbättrad klinisk diagnostisk noggrannhet vid Alzheimers sjukdom har varit utvecklingen av radiomärkta spårämnen för PET-avbildning med specifik affinitet för AD-relaterade ß-amyloid- och fosforylerade tau-aggregat (figur 3), som gör det möjligt att in vivo påvisa den underliggande neuropatologin (tabell), vilket tidigare endast var möjligt postmortalt.
Klicka för att se större
Figur 3. Axial amyloid-PET som visar amyloidnegativa (A) och amyloidpositiva skanningar (B). I amyloidnegativa bilder (A) visar radiotracer-signalen låg intensitet och är begränsad till ospecifik bindning i vit substans. Övergången mellan grå och vit substans är bevarad. I amyloidpositiva bilder (B) är radiotracer-signalen av hög intensitet och sträcker sig diffust in i kortikala grå substansregioner och skymmer gränsen mellan grå och vit substans. Koronal tau-PET som visar tau-negativa (C) och tau-positiva (D) bilder. I tau-negativa skanningar finns det en minimal, ospecifik radiotracer-signal med låg intensitet i de mediala temporala, basala främre hjärnorna och de basala ganglierna. I tau-positiva skanningar (D) är radiotracer-signalen av högre intensitet och involverar de nedre och laterala temporala hjärnbarken enligt den kända progressionsbanan för neurofibrillära trassel.
Amyloid Positron Emission Tomography
Amyloid, och på senare tid, tau-avbildning har revolutionerat vår förmåga att visualisera AD-patologi även i presymptomatiska stadier.19 Amyloid PET-bildgivande spårämnen är giltiga och tillförlitliga för att upptäcka AD-patologi in vivo i olika stadier av sjukdomen. Dessa spårämnen binder specifika konformationsmotiv av amyloidproteinet och resulterar i ett spårämnesupptag som är nära korrelerat med postmortal amyloidavlagring.20
Till skillnad från tau börjar amyloidpatologin i ett mer diffust distribuerat regionalt mönster som sprider sig från de basala delarna av frontal-, temporal- och occipitala loberna till de dorsala neokortikala associationsområdena, med endast sen involvering av de primära sensoriska och motoriska hjärnbarken.21 De mest anmärkningsvärda områdena med spårämnesupptag är frontala, parietala och laterala temporala cortices (figur 3), med ett upptag som är 1,5 till 2 gånger större hos personer med Alzheimers sjukdom jämfört med kontrollgrupper22 eller personer med andra demenssjukdomar.23
Amyloid-PET-bilder bedöms för kortikalt spårämnesupptag i karakteristiska områden av AD:s amyloidutbredning. Positiva bilder visar en förlust av distinktionen mellan grå och vit substans när spårämnesupptagningen sträcker sig in i neocortex. Negativa bilder behåller skillnaden mellan grå och vit substans och visar endast bindning utanför måltavlan i vit substans.24 Amyloid PET-bildmönster kan på ett tillförlitligt sätt förutsäga kognitiv försämring hos både friska personer och personer med MCI.20
18F-florbetapir, 18F-florbetaben och 18F-flutemetamol är godkända av Food and Drug Administration (FDA) för klinisk användning.20 Försäkringsbolagen har dock inte anammat tekniken på grund av kostnaden och risken för klinisk överanvändning i avsaknad av sjukdomsmodifierande terapier och fastställda kostnadsfördelar. I en metaanalys rapporterades 95 % sensitivitet och 57 % specificitet för en positiv amyloid PET-scanning för att förutsäga omvandling från MCI till AD.25
Den osäkra relationen mellan kostnad, risk och nytta har lett till utvecklingen av kriterier för lämplig användning av amyloidbilddiagnostik, där behovet av amyloid PET-utvärdering tillskrivs personer med oförklarlig MCI, atypiska AD-presentationer och tidig demenssjukdom.26 Experter har också identifierat olämpliga indikationer för amyloidavbildning som omfattar fristående utvärdering av kognitiva problem före en grundlig klinisk, kognitiv, laboratorie- och strukturell neuroimagingutredning, vid avsaknad av objektiv kognitiv försämring, vid hög sannolikhet för Alzheimers sjukdom (dvs. vid avsaknad av klinisk jämvikt) och för stadieindelning av demenssjukdomens allvarlighetsgrad.
I IDEAS-studien (imaging dementia-evidence for amyloid scanning) – en pågående studie av Center for Medicare and Medicaid Services – validerar man för närvarande kriterierna för lämplig användning och utvärderar effekten av PET-bestämd amyloidstatus på sjukdomshantering och långtidsutfall för Medicare-berättigade med MCI eller atypiska presentationer. Interimsanalysen visade att integrering av amyloid-PET i den kliniska utredningen resulterade i förändringar av sjukdomshanteringen hos 60,2 % av personerna med MCI och 63,5 % av personerna med demens.27 Långsiktiga resultat håller fortfarande på att bestämmas.
Tau Positron Emission Tomography
Tau är det andra proteinet som avlagras i hjärnan hos de som lider av Alzheimers sjukdom. Tau PET-bildspårare för PET-avbildning är för närvarande under utveckling och är redan lovande. I likhet med amyloid-PET är Tau-PET-spårämnen inriktade på särskilda konformationella motiv av fosforylerat Tau. Specificiteten hos tau-spårämnena har validerats postmortalt,28 och den observerade tau PET-signalen stämmer väl överens med den anatomiska fördelningen av neurofibrillära trassel som för närvarande används för en neuropatologisk diagnos av Alzheimers sjukdom.29 De tidigaste stadierna av tau-patologin som kan visualiseras med tau PET-avbildning är avlagringarna av neurofibrillära trassel i entorhinal cortex och hippocampus. Därefter kan tau-avlagringar påvisas i den nedre och laterala temporala (figur 3), följt av den parietala och occipitala och slutligen den frontala cortexen enligt den väletablerade patologiska stadieindelningen av tau-avlagringar i hjärnan enligt Braak och Braak.21 Tau-spårämnen är inte utan diagnostiska begränsningar och de håller på att vidareutvecklas för att bättre kunna definiera sin kliniska roll. Med tanke på att bindningen av tau-spårämnen förändras dynamiskt under hela det kliniska förloppet av Alzheimers sjukdom kommer denna avbildningsmodalitet troligen att spela en viktig roll för att gradera sjukdomens svårighetsgrad in vivo.30
Framtida riktningar
Med tanke på att AD-patologi lätt kan upptäckas upp till 20 år före demensdiagnosen19 och följer en förutsägbar stegvis fördelning, är forskningen nu inriktad på tidig presymptomatisk upptäckt och förbättring av den diagnostiska noggrannheten genom användning av biomarkörer (tabell).31 Ett föreslaget ramverk för forskning kring amyloid-tau-neurodegeneration (ATN) med inriktning på att upptäcka 3 förändringar i hjärnan som är biomarkörer, ger en prognos om den kliniska relevansen av multimodal bildbehandling.31 ATN-klassificeringssystemet är oberoende av kliniska syndrom och fångar hela spektrumet av neurodegenerativa sjukdomar med hjälp av biomarkörer för Alzheimers sjukdom. Efter ytterligare utveckling och förfining förväntas ATN, genom objektiv kategorisering av biomarkörer in vivo, dramatiskt förbättra den kliniska diagnostiska noggrannheten och förbättra vårdkvaliteten.
Slutsats
Neuroimaging erbjuder unik information om den underliggande etiologin för kognitiv nedsättning och underlättar vägledning för patienter och familjer genom en fruktad och osäker upplevelse. Alla neurodegenerativa sjukdomar uppvisar betydande klinisk heterogenitet, och före de senaste framstegen inom molekylär avbildning kunde ingen av dem diagnostiseras slutgiltigt före döden. Den moderna tekniken för avbildning av hjärnan kan upptäcka många epifenomena som återspeglar den underliggande neuropatologin, varav en del ligger ganska nära sjukdomskällan. Den säkraste kliniska diagnosen bygger för närvarande på en integrering av klinisk historia, läkarens observationer, fysisk undersökning, medicinsk utredning, neuropsykologisk testning och informerad tolkning av diagnostisk neuroimaging. I takt med att ATN-biomarkörerna förfinas ytterligare kommer de kliniska diagnoserna att ställas tidigare och mer definitivt hos levande patienter, vara mindre beroende av symtomklassificering och ge möjligheter till tidigare behandlingsinsatser som kan förändra den neurodegenerativa sjukdomens förlopp.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Praxisparameter: diagnos av demens (en evidensbaserad genomgång). Rapport från underkommittén för kvalitetsstandarder vid American Academy of Neurologi. Neurology. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation of dementia: a systematic study of the usefulness of the American Academy of Neurology’s practice parameters. Neurology. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. 3D comparison of low, intermediate, and advanced hippocampal atrophy in MCI. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. MRI visual rating scales in the diagnosis of dementia: evaluation in 184 post-mortem confirmed cases. Brain. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. Medial temporal lobe atrophy on MRI differentiates Alzheimer’s disease from dementia with Lewy bodies and vascular cognitive impairment: a prospective study with pathological verification of diagnosis. Brain. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Patterns of atrophy in pathologically confirmed dementias: a voxelwise analysis. J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Pathologic correlates of incidental MRI white matter signal hyperintensities. Neurology. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. Diffusionstensoravbildning av vit substans som ser normal ut vid mild kognitiv nedsättning och tidig Alzheimers sjukdom: preliminära bevis för axonal degeneration i temporalloben. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. White matter imaging changes in subjective and mild cognitive impairment. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Structural tract alterations predict downstream tau accumulation in amyloid-positive older individuals. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Surface feature-guided mapping of cerebral metabolic changes in cognitively normal and mildly impaired elderly. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PET förbättrar precisionen när det gäller att skilja frontotemporal demens och Alzheimers sjukdom. Brain. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Cerebral glukosmetabolism hos patienter med frontotemporal demens. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Multicenter standardiserad 18F-FDG PET-diagnostik av mild kognitiv svikt, Alzheimers sjukdom och andra demenssjukdomar. J Nucl Med. 2008;49(3):390-398.
15 . Centers for Medicare & Medicaid Serivces. Decision Memo for Positron Emission Tomography (FDG) and Other Neuroimaging Devices for Suspected Dementia (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Tillgänglig den 4 maj 2019.
16. Buckner RL, Sepulcre J, Talukdar T, et al. Cortical hubs revealed by intrinsic functional connectivity: mapping, assessment of stability, and relation to Alzheimer’s disease. J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. Neurodegenerativa sjukdomar riktar sig mot storskaliga mänskliga hjärnnätverk. Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Exakthet i den kliniska diagnosen av Alzheimers sjukdom vid National Institute on Aging Alzheimer Disease Centers, 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Imaging the evolution and pathophysiology of Alzheimer disease. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. Det diagnostiska värdet av FDG- och amyloid-PET vid Alzheimers sjukdom – en systematisk genomgång. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Neuropatologisk stadieindelning av Alzheimerrelaterade förändringar. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Imaging brain amyloid in Alzheimer’s disease with Pittsburgh Compound-B. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prevalens av amyloid PET-positivitet i demenssyndrom: en metaanalys. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. SNMMI procedurstandard/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Li J, et al. Predictive accuracy of amyloid imaging for progression from mild cognitive impairment to Alzheimer disease with different lengths of follow-up: a meta-analysis. . Medicin (Baltimore). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Kriterier för lämplig användning av Amyloid PET: en rapport från Amyloid Imaging Task Force, Society of Nuclear Medicine and Molecular Imaging och Alzheimer’s Association. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Association of amyloid positron emission tomography with subsequent change in clinical management among medicare beneficiaries with mild cognitive impairment or dementia. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Autoradiografisk validering av ny tau PET-tracer -MK-6240 på mänsklig postmortal hjärnvävnad. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. Tidiga kliniska PET-avbildningsresultat med den nya PHF-tau-radioliganden -T807. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Utvärdering av tau-avbildning vid stadieindelning av Alzheimers sjukdom och avslöjande av interaktioner mellan beta-amyloid och tauopati. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr., Bennett DA, Blennow K, et al. NIA-AA Research Framework: Mot en biologisk definition av Alzheimers sjukdom. Alzheimers Dement. 2018;14(4):535-562.
MRA och DS rapporterar inga upplysningar.
LGA har varit medlem i ett rådgivande organ för Eli Lilly.