- Bakgrund och introduktion
- Fallpresentation
- Diskussion
- Patofysiologi för ADI
- Litteratursökning
- Causer till ADI
- Klinisk presentation av ADI
- Associerade komplikationer till ADI
- Hanteringsmetoder för ADI
- Slutsats
- Datatillgänglighet
- Etikutlåtande
- Samtycke till deltagande
- Författarbidrag
- Finansiering
- Intressekonfliktförklaring
- Acknowledgments
Bakgrund och introduktion
Hypothalamisk Adipsic Diabetes Insipidus (ADI), ett sällsynt syndrom med heterogen klinisk presentation, kännetecknas av en samling av defekter i de homeostatiska mekanismerna för vattenbalans. Dessa inkluderar osmoregulering av törstmekanismen, argininvasopressinsekretion och njurarnas förmåga att koncentrera urinen. Mindre än hundra allvarliga fall har rapporterats över hela världen under de senaste fyra decennierna (1).
Hanteringen av sådana patienter är extremt utmanande eftersom dessa patienter tenderar att drabbas av stora svängningar i plasmanatrium även när DI är välkontrollerad (2).
Vi rapporterar ett fall av allvarlig ADI som inträffade postoperativt efter operation av en cerebral arteriovenös malformation (AVM). Vi beskriver den möjliga patogenesen i detta fall och går igenom litteraturen för alla liknande rapporterade fall och beskriver de potentiella mekanismerna som är inblandade, klinisk presentation, akut såväl som kronisk hantering och prognos.
Fallpresentation
En 27-årig kvinna presenterades med vänster frontal intracerebral blödning med intraventrikulär utbredning sekundärt till ett stort komplex (AVM) i basala ganglier med komplexa arteriella matare från vänstra mellersta cerebrala artärer (MCA) och främre cerebrala artärer (ACA) med Spetzler-Martin Grading Scale på 3 (3).
Efter initial återhämtning efter dekompressiv kraniotomi och operation för evakuering av proppar genomgick hon en elektiv AVM-excisionskirurgi ~2 veckor senare. Under AVM-kirurgin rapporterade kirurgerna en livlig blödning från matningskärlen (MCA, ACA och choroidalskärlen) med allvarlig intracerebral blödning och intraventrikulär blödning som krävde massiv blodtransfusion av upp till 32 enheter intraoperativt. Hon placerades i barbituratinducerad koma och inducerad hypotoni för att minimera cerebralt ödem (4).
Hon började få polyuri med stora urinvolymer intraoperativt strax efter episoden med kraftig intraoperativ blödning. Även om hennes natriumkoncentrationer preoperativt var normala, var natriumkoncentrationerna högre omedelbart (inom den första timmen) postoperativt inom intervallet 151-160 mmol/L i kombination med en låg osmolalitet i urinen <130 mosm/L. Transient DI övervägdes och hon påbörjades med intravenöst desmopressin (IV desmopressin) 1 mcg som gavs dagligen tillsammans med 3,5-4 L halvstark saltvatteninfusion under tre på varandra följande dagar.
Hur som helst utvecklade hon sedan lungödem (sannolikt en följd av massiv blodtransfusion intraoperativt, intravenösa hypotona vätskor och samtidigt intravenöst desmopressin) på postoperativ dag 4, intravenöst desmopressin avbröts, och färsk fryst plasma och diuretika (intravenöst furosemid 40 mg) administrerades för att minska det extravaskulära ödemet. Under den efterföljande timmen började hon återigen utveckla polyuri med en urinproduktion på 800 ml under en enda timme och hennes natriumkoncentrationer steg trendmässigt till 172 mmol/L. Med tanke på det samtidiga postoperativa hjärnödemet beslutades det att natriumkoncentrationerna skulle sänkas på ett målinriktat sätt så att natriumminskningen förblev inom 5-10 mmol/L/dag, med en målnivå på 155 mmol/L. En låg dos desmopressin 0,25 mcg administrerades och en titreringsregim föreslogs i syfte att bibehålla ett urinflöde per timme på mindre än 100 mL/h. Hon behövde IV 0,75 mcg desmopressin på postoperativ dag 5 och sedan IV 0,25 mcg två gånger dagligen på dag 6 när hon nådde en målnivå på 155 mmol/L. Denna natriumkoncentration kunde bibehållas med desmopressindoseringen i ytterligare 2 dagar.
På dag 9 postoperativt avbröts desmopressin eftersom hon kunde bibehålla ett lågt urinflöde utan desmopressin och natriumkoncentrationerna var stabila. I detta skede ansågs det att hon hade utvecklat syndrom med olämplig sekretion av antidiuretiskt hormon (SIADH) och vätskor begränsades till 1 l/dag. Hennes natriumkoncentrationer förblev stabila på 134-138 mmol/L under denna vecka.
På postoperativ dag 14 utvecklade hon polyuri igen med stigande natriumkoncentrationer och serumosmolalitet. Vid denna tidpunkt återupptogs IV desmopressin med 0,25 mcg två gånger dagligen. Natriumkoncentrationerna kunde hållas på 138-150 mmol/L med IV desmopressin (0,25 mcg två gånger dagligen) och vätska. Hon hade genomgått en trifasisk fas med en period av övergående DI, följt av SIADH och därefter permanent DI (se figur 1). Serumkortisol-, tillväxthormon-, insulinliknande tillväxtfaktor-1-, sköldkörtelfunktionen och prolaktinnivåerna låg alla inom normalområdet.

Figur 1. Diagram som visar alla seriella mätningar hos vår patient under hela sjukhusvistelsen.
Efter insättning av en ventrikuloperitoneal shunt (gjordes för att bibehålla det intrakraniella trycket) 6 veckor efter AVM-excisionen överfördes hon till rehabiliteringsavdelningen och den intravenösa desmopressinregimen konverterades till en subkutan (SC)-regim (se figur 1). När den nasogastriska sondmatningen upphörde försökte vi reglera vätskorna med hjälp av törst. Blodundersökningar visade stigande natriumnivåer upp till 165 mmol/L och hon kände ingen törst under denna period av hypernatraemi trots en serumosmolalitet på 350 mosm/kg. Hon förblev adipsisk trots återhämtning av afasi. En törstskala användes inte eftersom hon vid förhör verbaliserade att hon inte kände någon törst alls, och en törstskala kunde inte användas. Därför var man tvungen att reglera vätskorna för att upprätthålla natriumbalansen. Hennes urinproduktion fastställdes och hennes natriumbalans reglerades väl med en SC-regim av desmopressin 0,5 mcg på morgonen och 0,375 mcg på kvällen, med reglerade vätskor på 1,5-2 L per dag. Hon hade inga tecken på termoregleringsstörningar. Kranioplastik av polyetereterketon (PEEK) utfördes ~4 månader efter den första operationen.
Efter 5 månaders intensiv multidisciplinär rehabilitering hade hon fortfarande en icke-funktionell dominant högerhand och betydande kvarstående kognitiva brister, och säker dosering och självadministrering av subkutant desmopressin var inte möjlig på lång sikt.
En prövning av nasalt desmopressin och oralt desmopressin visade en betydande varierande absorption som ledde till större fluktuationer i natriumkoncentrationerna. Hädanefter beslutade vi att använda det sublinguala desmopressin som finns tillgängligt som desmopressin Melt. Efter flera försök med olika doseringsscheman kunde vi fastställa urinproduktionen till cirka 2 l/dag genom att använda desmopressin Melt oral lyophilizate 120 mcg (2 tabletter) på morgonen och 60 mcg (1 tablett) på kvällen. Vid denna dos hade hon dock hyponatremi vid vissa tider på dagen. Vi utförde ytterligare dostitrering genom att skära desmopressintabletterna med hjälp av en pincett/tång för att lyfta upp tabletterna ur blisterförpackningen och skära tabletterna i exakta kvartsbitar (vardera 15 mcg) med hjälp av en tablettskärare. Med en regim på 90 mcg (1,5 tabletter) på morgonen och 75 mcg (1,25 tabletter) på kvällen lyckades vi uppnå liknande resultat som med den subkutana regimen. Med denna regim och ett reglerat vätskeintag på 2 l/dag hölls hennes natriumkoncentrationer inom intervallet 135-150 mmol/L utan större fluktuationer eller kognitiva symtom. Denna dosering gjorde det också möjligt för henne att ha ökad aktivitet på dagtid för rehabilitering och hon kunde sova bra ostörd av polyuri på natten.
Se figur 1 för de seriella natriummätningarna hos den här patienten under hela sjukhusperioden med de ovan beskrivna händelserna.
Med tanke på den kliniska anamnesen och det faktum att hypofysen och hypotalamus i stort sett är intakta, är det osannolikt att hon hade betydande defekter i baroregulationen.
Diskussion
Patofysiologi för ADI
Under fysiologiska förhållanden upprätthålls plasmanatrium, osmolaliteten och vattenbalansen inom snäva intervall sekundärt till ett noggrant samspel mellan törst- och vattenintag, neurohypofysisk vasopressinsekretion och antidiuresen vid de renala distala kollektortubuli.
Perifera signaler (oropharyngeala, tarmens osmosensorer, blodets osmolalitet) kodar information om det aktuella hydreringstillståndet i realtid och dessa integreras centralt (5). Ett tillstånd av uttorkning leder till stimulerande signaler till subfornical-organet (SFO) som hierarkiskt sänder signaler till organum-vasculosum of lamina terminalis (OVLT) och den mediala preoptiska kärnan (MnPO) (6). MnPO, som kan fungera som en ”central detektor”, sänder stimulerande signaler till de hypotalamiska kärnorna för att öka frisättningen av vasopressin och sänder också en ökad törstsignal genom SFO och OVLT (7, 8). De törstrelaterade neurala vägar som förbinder SFO och OVLT med den cingulära och insulära hjärnbarken resulterar i den medvetna uppfattningen av törst (7, 8). I ett tillstånd med tillräcklig vätsketillgång leder signalerna från de perifera sensorerna tvärtom till en hämning av dessa områden och negativ återkoppling från MnPO, vilket leder till att törsten dämpas och att vasopressin utsöndras och frisätts i mindre utsträckning (röd krets). Neuronerna i MnPO, OVLT och SFO är i själva verket omfattande och ömsesidigt sammankopplade eftersom optogenetisk och kemogenetisk aktivering av neuroner i något av dessa områden kan stimulera törst (9). Därför kommer störningar i blodtillförseln som leder till cellskador att leda till adipsi. Fall av ADI på grund av autoimmunitet mot neuronala celler från SFO och OVLT har också publicerats, vilket visar på den funktionella betydelsen av dessa neuronala sensorer i törstkontrollen (10).
AVP-neuronerna uppvisar ”fasisk” aktivitet av aktionspotentialer med intervaller där AVP frisätts vid axonterminalerna. Frisättningen av vasopressin regleras av de osmosensoriska inflödena från MnPO, genom baroreceptorer och det finns också en förutseende reglering där frisättningen av vasopressin stimuleras före måltider (prandial), vid hypertermi och i ett cirkadiskt mönster (11). Det finns ett cirkadiskt dygnsmönster för utsöndring av vasopressin i cirkulationen med en ökning av nivåerna mellan kl. 24.00 och 02.00, och nivåerna sjunker successivt under dagen med ett bottenläge mellan kl. 16.00 och 20.00 (12). Denna cirkadiska midnattsökning som orsakas av en ökad frisättning av vasopressin beror delvis på ökad synaptisk excitation av magnocellulära neurosekretoriska neuroner av suprachiasmatiska kärnan som är känd för att reglera den cirkadiska rytmen (11). Vid ADI påverkas den osmosensoriska regleringen av vasopressinsekretionen mest och andra effekter kan variera beroende på skadans plats och omfattning, medan baroreceptorsvaret är känt för att vara bevarat hos många patienter med begränsad skada, vilket visades i en studie (13).
AVP verkar på njurarnas samlingsgångar via vasopressin-2 (V2)-receptorer för att öka vattenpermeabiliteten, vilket leder till minskad urinbildning. Återabsorptionen av vatten styrs genom reglering av vattenkanalen aquaporin-2 (AQP2). AVP inducerar på kort sikt intracellulär translokation av AQP2-bärande vesiklar till det apikala plasmamembranet och reglerar därmed AQP2-trafiken. På lång sikt med adekvata AVP-koncentrationer reglerar det transkriptionen av AQP2-genen för att öka förekomsten av AQP2-protein i samlingsröret (14). Vid ADI postulerar vi att det är troligt att det akuta osmosensoriska svaret påverkas mer än det kroniska svaret. Därför kommer det att finnas ett relativt överflöd av aquaporin men den akuta trafiken till det apikala membranet kommer att påverkas.
Se figur 2 för detaljerad illustration av mekanismerna.
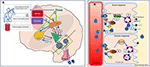
Figur 2. Schematisk framställning av regleringen av vätskebalansen hos människor. (A) Styrning och reglering av vasopressinsekretionen i hjärnan. (A) Perifera signaler (oropharyngeala, tarmens osmosensorer, blodets osmolalitet) kodar information om det aktuella hydreringstillståndet i realtid (1) och integreras centralt (2). Ett tillstånd av uttorkning leder till stimulerande signaler till SFO som hierarkiskt skickar signaler till OVLT och MnPO (3). MnPO, som kan fungera som en ”central detektor”, sänder stimulerande signaler till de hypotalamiska kärnorna för att öka frisättningen av vasopressin (4) och sänder också en ökad törstsignal genom SFO och OVLT (5, blå krets i diagrammet). I ett tillstånd med adekvat hydreringssignaler från de perifera sensorerna sker tvärtom en hämning av dessa områden och en negativ återkoppling från MnPO, vilket leder till att törsten dämpas och att vasopressinutsöndringen och -frisättningen minskar (röd krets 6). De törstrelaterade neurala vägarna som förbinder SFO och OVLT med cingulära och insulära hjärnbarken resulterar i den medvetna uppfattningen av törst (7). Vid adipsisk DI är i avsaknad av osmosensoriska stimuli associerade neurala kretsar på grund av cellskador, stimulerande frisättning eller hämning av vasopressin och den medvetna uppfattningen av törst båda störda. (B) Vasopressins verkningsmekanism på de renala samlingstubuli. (B) Vasopressin i blodcirkulationen fäster vid vasopressinreceptor 2 på luminalytan av huvudcellerna i den distala kollektortubuli i njurarna (1). I den akuta fasen bildas via syntesen av cAMP från ATP genom AC (adenylatcyklas) proteinkinas A (2) som stimulerar translokationen av aquaporin från lagringsvesikeln till det apikala membranet och blodets luminalyta (3). Detta leder till att vatten transporteras in i cellen (4) och därefter absorberas i cirkulationen (5). I den kroniska fasen kan man via cAMP-medierad transkriptionskontroll av aquaporin-genen (6) hitta ökade nivåer av vattenkanalen aquaporin i huvudcellerna (7). Vid adipsisk DI är den akuta responsen sannolikt mer påverkad än den kroniska responsen eftersom den osmosensoriskt relaterade vasopressinsekretionen påverkas.
Litteratursökning
Vi utförde en systematisk litteratursökning som inkluderade Pubmed, Scopus och Embase för fall som rapporterats som en fallrapport eller en fallserie av ADI från åren 1980 till 2018. Vi använde sökordet: Adipsia, Adipsic disorder och Adipsic DI och vi begränsade sökningen till engelska språket och till människor. Vi sökte också alla andra referenser som identifierades under läsningen av varje fallrapport/fallserie. Vi hittade 25 referenser (10, 13, 15-39) med sammanlagt 45 fall som rapporterats i litteraturen. Vi har sammanfattat alla fallrapporter i tabell 1.
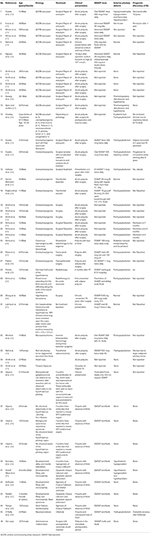
Tabell 1. Demografi, etiologi, klinisk presentation, hantering och prognos för patienter med adipsisk diabetes insipidus som rapporterats i litteraturen.
Causer till ADI
Forttio procent (17/46) av de fall av ADI som beskrivits i litteraturen inträffade sekundärt till ruptur av aneurysm i den främre kommunicerande artären (ACOM) och efter kirurgisk klippning med hjälp av en frontal kraniektomi. I ett fall beskrevs dubbel patologi av kraniopharyngiom och ACOM-aneurysm (15). OVLT:s arteriella försörjning har beskrivits komma från fyra källor (40): (1) en övre median källa som förgrenar sig från den främre kommunicerande artären, (2) och (3) två laterala källor som kommer från artärer som förgrenar sig från varje främre cerebral artär under den främre kommunicerande artären, och (4) en nedre median källa som stiger upp från under det optiska chiasmet. Kapillärerna som kantar detta organ ligger utanför blod-hjärnbarriären och därför kan en förändring av osmolaliteten lätt uppfattas av dessa organ (41). Det bör noteras att förbättringar av den kirurgiska tekniken och användning av coiling i stället för clipping kan minska dessa komplikationer. För patienter i goda kliniska förhållanden med rupturerade aneurysm i främre cirkulationen som är lämpliga för coiling visar data från en metaanalys att coiling är förknippat med ett bättre resultat (42). Jämfört med clipping där båda ändarna av ACA klipps med avbrott i blodtillförseln till hypotalamus, kan förfarandet med att föra in en spole i aneurysmet bevara matarna till hypotalamus i de flesta fall.
Den andra orsaken till ADI har beskrivits som suprasellärt kraniopharyngiom (17/46). Dessa fall innebär ofta en transfrontal excision och återhämtning efter operationen har beskrivits i vissa fall. Ett fall av cavernöst hemangiom med liknande manifestation efter en blödningsepisod har också beskrivits (26).
Hypotalamiska tumörer inklusive hamartom, tallkottkörteltumör och groddcellstumör kan uppvisa ADI (26, 29, 30). Ett fall av hepatocellulärt karcinom med metastaser till hypotalamus och resulterande ADI har rapporterats (31).
Interessant nog har endast två fall av hypofysetumörer med ADI beskrivits (18, 32). Båda dessa fall hade en aggressiv tumör med flera transfrontala resektioner och intrakraniell blödning intraoperativt. Ett fall vardera har beskrivits i samband med huvudskada och toluenexponering också (13).
Fyra fall har beskrivits med plötslig akut presentation av polyuri och hypernatremi. Dessa patienter hade inga strukturella avvikelser i hypotalamus och detaljerade undersökningar visade tecken på antikroppar mot OVLT-organen. Dessa fall har postulerats ha en underliggande autoimmun patologi (10, 33).
Angenitala fall eller fall i tidig barndom hos patienter med utvecklingsproblem i corpus callosum har också beskrivits med manifestation av ADI (34-38). Ett fall av neurosarcoidos med omfattande påverkan på främre hypofysen, bakre hypofysen och hypotalamus med ADI har också beskrivits (39).
Klinisk presentation av ADI
Den kliniska presentationen i de flesta av de beskrivna fallen är polyuri i den omedelbara veckan efter kirurgisk klippning för AVM eller efter kraniotomi. Den biokemiska presentationen är hypernatremi med ökad serumosmolalitet i närvaro av olämpligt utspädd urin i stora volymer. Om törstkänslan bedöms med hjälp av en törstskala rapporterar dessa ADI-patienter låg eller minimal törst trots hypernatremi. Intressant nog har dessa patienter ett normalt svar på hypotoni och deras baroreceptormekanism är intakt (13).
Vår patient genomgick en trefasig fas med initial DI, följt av SIADH och sedan permanent DI. Detta mönster som beskrivs som trifasisk respons har beskrivits efter hypofys- och kraniopharyngiomoperationer. Patofysiologin bakom det trefasiga svaret tycks förklaras av tidig hypotalamisk dysfunktion (kännetecknad av polyuri och hypernatremi), efterföljande frisättning av förbildat vasopressin från lagringsblåsorna i hypofysens bakre del (som inte är relaterad till något stimulus) (kännetecknad av SIADH) och slutligen uttömning av vasopressinlagren (permanent DI) (43). Hos vår patient är det troligt att i den tredje fasen avmaskeras bristen i svaret på osmolalitet vid frisättning av vasopressin efter att SIADH försvinner, snarare än en absolut utarmning av vasopressin.
Associerade komplikationer till ADI
Få fallrapporter har beskrivit termoregulatoriska störningar. Panhypopopituitarism har endast rapporterats i fall av kraniopharyngiom och i fall av hypofysetumörer och förekom inte hos vår patient.
Och även om det inte konsekvent rapporteras, omfattar andra viktiga komplikationer av hypernatremi djupa ventromboser; därför kan lågmolekylärt heparin vara indicerat under akut sjukdom och immobilisering (18).
Hypotalamisk obesitas och sömnapné har också rapporterats allmänt (18). I en fallserie (13), där man utvärderade AVP-svaret vid hypotension, fann man att patienterna med kraniopharyngiom också hade en förlust av det baro-reglerade AVP-svaret. Dessa patienter hade tecken på panhypopituitarism, vilket tyder på att operationen av deras tumörer hade lämnat mer utbredda skador på hypofysen, inklusive den bakre hypofysen som är den sista gemensamma vägen för AVP-sekretion.
Hanteringsmetoder för ADI
Hanteringen av dessa fall har beskrivits (15, 18). Utbildning av patienten och familjen om principerna för vattenbalans och hantering är avgörande. Vattenintaget kan fastställas till 1,5-2 L dagligen och därefter kan titrering av desmopressin utföras. Daglig viktuppföljning är användbar för att upptäcka uttorkning eller vätskeöverbelastning. Det rekommenderas att man varje vecka gör plasmanatriumkoncentrationer för att övervaka fluktuationer. Trots strikt övervakning är det svårt att reproducera en dygnet runt-kontroll av plasmanatriumkoncentrationer som efterliknar fysiologisk osmoreglering. Med tanke på risken för snabba svängningar i natriumkoncentrationerna och de symtom på hyponatremi som ses vid det låga referensintervallet är det tillrådligt att hålla natriumkoncentrationerna inom det högre referensintervallet.
Desmopressin, den syntetiska analogen av AVP, introducerades för första gången för behandling av DI 1972 (44). De flesta patienter mår bra av låga doser desmopressin som ges två gånger dagligen. Det finns en fin balans och natriumnivåerna kan svänga till mycket låga nivåer med små doseskaleringar.
Vår patient klarade sig mycket bra på mycket låga doser av parenterala administreringar som är kända för att ha den lägsta variabiliteten i biotillgänglighet (45). Absorptionen av intranasala formuleringar är mycket varierande, särskilt hos barn eller vuxna med kognitiva problem eftersom de kanske inte inhalerar lösningen på ett konsekvent sätt (46, 47). Orala formuleringar är ett bra alternativ eftersom en ökning av dosen leder till en längre verkningstid men har ingen toppeffekt (48-50). Vi provade denna form i varierande doser på 50-100 mcg men vi fann betydande variationer från dag till dag i effekterna med denna formulering. Sublingualt desmopressin (Minirin Melt) har funnits tillgängligt sedan 2005. Farmakologiska studier har visat att sublingual väg resulterar i en högre biotillgänglighet med ~60 % jämfört med oral väg (49, 50). Förfinade doser av sublingualt desmopressin skulle kunna uppnås genom att skära upp varje 60 mcg-tablett, vilket möjliggör dosjusteringar på 65 till 90 mcg sublingualt. En liknande farmakokinetisk profil för sådana delade tabletter har beskrivits (51). Det är känt att samtidig intagning av mat minskar absorptionshastigheten och -omfattningen med 40 %, varför det är bäst att undvika all matintag inom en timme före och efter administrering av de sublinguala desmopressintabletterna. Nyligen beskrevs ett detaljerat protokoll för vätskeadministration med daglig natriumövervakning med subkutan desmopressin i fast dos (28), vilket visar på svårigheten med daglig övervakning. I en annan nyligen publicerad fallrapport (27) har man också rapporterat om användning av den sublinguala desmopressinformen för ADI i doserna 60 och 120 mcg dagligen. Användningen av sublingualt desmopressin kan vara ett användbart alternativ i fall där optimala effekter inte kan uppnås med andra formuleringar. dessa patienter kräver strikt övervakning av daglig vikt, urinvolym och vätskeintag dygnet runt. Med tanke på de kognitiva och minnesmässiga defekter som dessa patienter tenderar att ha behöver de vanligtvis en vårdare som övervakar vätskeintaget för att se till att de dricker den volym som krävs.
I vår genomgång av fall hade 6 patienter en remission av ADI varav 2 var relaterade till ACOM-aneurysm (15, 16) och 4 var relaterade till kraniopharyngiom (15, 26). En patient med neurosarcoidos hade en remission med infliximabbehandling (39). Sådana observationer kan tyda på att både osmoreceptorer som reglerar törst och deras efferenta vägar uppvisar mer neuroplasticitet än de som reglerar AVP-produktionen (26).
Slutsats
ADI är en ytterst sällsynt komplikation till hypotalamusrubbningar som resulterar i funktionsbortfall i törstcentrum. På grund av hierarkisk kontroll från törstcentret är avsaknaden av törst också förknippad med förlust av vasopressinreglering och polyuri. Personer som lider av ADI måste hanteras försiktigt med låga doser desmopressin och vätskebalans. Med nuvarande övervakning och personliga vårdmetoder är det fortfarande inte möjligt att efterlikna kvasifysiologisk osmoreglering dygnet runt.
Datatillgänglighet
Alla dataset som genererats för den här studien ingår i manuskriptet/tilläggsfilerna.
Etikutlåtande
Skrivet informerat samtycke har erhållits från individen/individerna för publicering av alla potentiellt identifierbara bilder eller data som ingår i den här artikeln.
Samtycke till deltagande
Vi har erhållit skriftligt tillstånd från patientens närmaste anhöriga för att skriva och publicera detta manuskript.
Författarbidrag
RD var den primära endokrinologen som skötte patientens vätskebalans, konceptualiserade idén, skrev manuskriptet, gjorde litteraturgenomgången, inhämtade data, skrev och granskade det slutgiltiga manuskriptet. HC, AC och JH var ST-läkare som deltog i hanteringen av denna patient och granskade det slutliga manuskriptet. HT var den anestesiolog som ansvarade för denna patient under intensivvårdsfasen, konceptualiserade idén och kritiskt granskade det slutliga manuskriptet. KC var huvudansvarig rehabiliteringsspecialist för patienten hon konceptualiserade idén och kritiskt utvärderade det slutliga manuskriptet. BB konceptualiserade idén och kritiskt utvärderade det slutliga manuskriptet.
Finansiering
RD stöddes delvis av Center Grant från National Medical Research Council (NMRC/CG/017/2013) och National Medical Research Council Clinician Scientist Award (MOH-CSAINV17nov-0006).
Intressekonfliktförklaring
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Vi tackar patienten och hennes föräldrar för att de lät oss skriva och publicera det här manuskriptet.
1. Eisenberg Y, Frohman LA. Adipsisk diabetes insipidus: en översikt. Endocr Pract. (2016) 22:76-83. doi: 10.4158/EP15940.RA
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Robertson GL. Störningar i regleringen av törst. Kidney Int. (1984) 25:460-9. doi: 10.1038/ki.1984.39
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Spetzler RF, Martin NA. Ett föreslaget klassificeringssystem för arteriovenösa missbildningar. J Neurosurg. (1986) 65:476-83. doi: 10.3171/jns.1986.65.4.0476
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Ellens NR, Figueroa BE, Clark JC. Användningen av barbituratinducerad koma vid cerebrovaskulära neurokirurgiska ingrepp: en genomgång av litteraturen. Brain Circ. (2015) 1:140-6. doi: 10.4103/2394-8108.172887
CrossRef Full Text | Google Scholar
5. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. En signal från tarmen till hjärnan om vätskans osmolaritet styr törstmättnad. Nature. (2019) 568:98-102. doi: 10.1038/s41586-019-1066-x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Augustine V, Gokce SK, Lee S, Wang B, Davidson TJ, Reimann F, et al. Hierarkisk neuronal arkitektur som ligger till grund för törstreglering. Nature. (2018) 555:204-9. doi: 10.1038/nature25488
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Bichet DG. Reglering av törst och frisättning av vasopressin. Annu Rev Physiol. (2019) 81:359-73. doi: 10.1146/annurev-physiol-020518-114556
PubMed Abstract | CrossRef Full Text | Google Scholar
8. McKinley MJ, Denton DA, Ryan PJ, Yao ST, Stefanidis A, Oldfield BJ. Från sensoriska circumventrikulära organ till hjärnbarken: neurala vägar som kontrollerar törst och hunger. J Neuroendocrinol. (2019) 31:e12689. doi: 10.1111/jne.12689
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. Den mediala preoptiska kärnan: front och centrum för regleringen av kroppsvätska, natrium, temperatur, sömn och kardiovaskulär homeostas. Acta Physiol. (2015) 214:8-32. doi: 10.1111/apha.12487
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. Autoimmunitet mot natriumnivå-sensorn i hjärnan orsakar essentiell hypernatremi. Neuron. (2010) 66:508-22. doi: 10.1016/j.neuron.2010.04.017
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Baylis PH, Thompson CJ. Osmoreglering av vasopressinsekretion och törst vid hälsa och sjukdom. Clin Endocrinol. (1998) 29:549-76. doi: 10.1111/j.1365-2265.1988.tb03704.x
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gizowski C, Bourque CW. Den neurala grunden för homeostatisk och förutseende törst. Nat Rev Nephrol. (2018) 14:11-25. doi: 10.1038/nrneph.2017.149
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J, et al. Baroregulering av vasopressinfrisättning vid adipsisk diabetes insipidus. J Clin Endocrinol Metab. (2002) 87:4564-8. doi: 10.1210/jc.2002-020090
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Jung HJ, Kwon TH. Molekylära mekanismer som reglerar aquaporin-2 i njurens samlingsrör. Am J Physiol Renal Physiol. (2016) 311:F1318-28. doi: 10.1152/ajprenal.00485.2016
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Cuesta M, Gupta S, Salehmohamed R, Dineen R, Hannon MJ, Tormey W, et al. Heterogena mönster för återhämtning av törst hos vuxna patienter med adipsisk diabetes insipidus. QJM. (2016) 109:303-8. doi: 10.1093/qjmed/hcv175
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Imai E, Kaneko S, Tsukamoto Y. Renal kompensatorisk anpassning för vattenhantering hos en patient med adipsisk diabetes insipidus efter klippning av ett rupturerat aneurysm i den främre kommunicerande artären. Clin Nephrol. (2017) 88:112-6. doi: 10.5414/CN108963
PubMed Abstract | CrossRef Full Text | Google Scholar
17. McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Adipsic hypothalamic diabetes insipidus after clipping of anterior communicating artery aneurysm. BMJ. (1991) 303:1465-7. doi: 10.1136/bmj.303.6815.1465
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Ball SG, Vaidya B, Bayliss PH. Hypotalamiskt adipsiskt syndrom: diagnos och behandling. Clin Endocrinol. (1997) 47:405-9. doi: 10.1046/j.1365-2265.1997.2591079.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Nguyen BN, Yablon SA, Chen CY. Hypodipsisk hypernatremi och diabetes insipidus efter klippning av aneurysm i främre kommunikationsartären: diagnostiska och terapeutiska utmaningar hos den amnestiska rehabiliteringspatienten. Hjärnskada. (2001) 15:975-80. doi: 10.1080/02699050110063459
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nussey SS, Ang VT, Jenkins JS. Kronisk hypernatremi och hypotermi efter subarachnoidalblödning. Postgrad Med J. (1986) 62:467-741. doi: 10.1136/pgmj.62.728.467
CrossRef Full Text | Google Scholar
21. Spiro SG, Jenkins JS. Adipsi och hypotermi efter subarachnoidalblödning. BMJ. (1971) 3:411-2. doi: 10.1136/bmj.3.5771.411
CrossRef Full Text | Google Scholar
22. Crowley RK, Sherlock M, Agha D, Smith D, Thompson CJ. Kliniska insikter om adipsisk diabetes insipidus: en stor fallserie. Clin Endocrinol. (2007) 66:475-82. doi: 10.1111/j.1365-2265.2007.02754.x
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Colleran K, Sanchez-Goettler L, Sloan A. Hypotalamisk fetma komplicerad av adipsisk central diabetes insipidus efter kirurgisk resektion av ett kraniopharyngiom. J Clin Hypertens. (2009) 11:608-10. doi: 10.1111/j.1751-7176.2009.00057.x
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Svår rhabdomyolys på grund av adipsisk hypernatremi efter kraniopharyngiomkirurgi. Arq Bras Endocrinol Metabol. (2007) 51:7. doi: 10.1590/S0004-27302007000700023
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. From cerebral salt wasting to diabetes insipidus with adipsia: case report of a child with craniopharyngioma. J Pediatr Endocrinol Metab. (2015) 28:323-6. doi: 10.1515/jpem-2014-0224
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T. Objektiv bedömning av törståterhämtning hos patienter med adipsisk diabetes insipidus. Hypofysen. (2011) 14:307-11. doi: 10.1007/s11102-011-0294-3
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Pérez MA, Millán HA, Naranjo JA, Flórez Romero A. Adipsic diabetes insipidus sekundärt till resektion av kraniopharyngiom. BMJ Case Rep. (2019) 12:e225903. doi: 10.1136/bcr-2018-225903
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pabich S, Flynn M, Pelley E. Daily sodium monitoring and liquid intake protocol: preventing recurrent hospitalization in adipsic diabetes insipidus. J Endoc Soc. (2019) 3:882-6. doi: 10.1210/js.2018-00406
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pereira MC, Vieira MM, Pereira JS, Salgado D. Adipsi hos en patient med diabetes insipidus. Case Rep Oncol. (2015) 8:385-8. doi: 10.1159/000440611
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Zhang Y, Wang D, Feng Y, Zhang W, Zeng X. Juvenile-onset gout and adipsic diabetes insipidus: a case report and literature review. J Int Med Res. (2018) 46:4829-36. doi: 10.1177/0300060518800114
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Latcha S, Lubetzky M, Weinstein AM. Svår hyperosmolaritet och hypernatremi hos en adipsisk ung kvinna. Clin Nephrol. (2011) 76:407-11. doi: 10.5414/CN106617
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Sherlock M, Agha A, Crowley R, Smith D, Thompson CJ. Adipsisk diabetes insipidus efter hypofyseskirurgi för ett makroprolaktinom. Pituitary. (2006) 9:59-64. doi: 10.1007/s11102-006-8280-x
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al. Adipsic hypernatremia without hypothalamic lesions accompanied by autoantibodies to subfornical organ. Brain Pathol. (2017) 27:323-31. doi: 10.1111/bpa.12409
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Komatsu H, Miyake H, Kakita S, Ikuta H. Hypoplasia of the corpus callosum associated with adipsic hypernatremia and hypothalamic hypogonadotropinism: a case report and review of the literature. Pediatr Int. (2001) 43:683-7. doi: 10.1046/j.1442-200X.2001.01453.x
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Schaff-Blass E, Robertson GL, Rosenfield RL. Kronisk hypernatremi till följd av en medfödd defekt i osmoreglering av törst och vasopressin. J Pediatr. (1983) 102:703-8. doi: 10.1016/S0022-3476(83)80237-6
PubMed Abstract | CrossRef Full Text | Google Scholar
36. AvRuskin TW, Tang SC, Juan C. Essential hypernatremia, antidiuretic hormone and neurohypophysin secretion: response to chlorpropamide. Acta Endocrinol. (1981) 96:145-53. doi: 10.1530/acta.0.0960145
CrossRef Full Text | Google Scholar
37. Radetti G, Rizza F, Mengarda G, Pittschieler K. Adipsisk hypernatremi hos två systrar. Am J Dis Child. (1991) 145:321-5. doi: 10.1001/archpedi.1991.02160030091028
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Takeya T, Hamano K, Iwasaki N, Kitazawa R, Tsuji C, Jougamoto M. Ett fall av kronisk hypernatremi med agenesi av corpus callosum. Nippon Shounikagakkai Zasshi. (1996) 100:1392-5.
Google Scholar
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Radiologisk remission och återhämtning av törstuppskattning efter infliximabbehandling vid adipsisk diabetes insipidus sekundärt till neurosarkoidos. QJM. (2015) 108:657-9. doi: 10.1093/qjmed/hct023
PubMed Abstract | CrossRef Full Text | Google Scholar
40. Duvernoy H, Koritké JG, Monnier G. . Zeitschrift für Zellforschung und mikroskopische Anatomie. (1969) 102:49-77. doi: 10.1007/BF00336416
PubMed Abstract | CrossRef Full Text | Google Scholar
41. Duvernoy HM, Risold PY. De circumventrikulära organen: en atlas över jämförande anatomi och vaskularisering. Brain Res Rev. (2007) 56:119-47. doi: 10.1016/j.brainresrev.2007.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al. Endovaskulär coiling kontra neurokirurgisk klippning för personer med aneurysmal subarachnoidalblödning. Cochrane Database Syst Rev. (2018) 8:CD003085. doi: 10.1002/14651858.CD003085.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Ewout JH, Robert Z. Vattenbalansstörningar efter neurokirurgi: det trefasiga svaret omprövas. NDT Plus. (2010) 3:42-4. doi: 10.1093/ndtplus/sfp117
CrossRef Full Text | Google Scholar
44. Andersson KE, Arner B. Effekter av DDAVP, en syntetisk analog av vasopressin, hos patienter med kranial diabetes insipidus. Acta Med Scand. (1972) 192:21-7. doi: 10.1111/j.0954-6820.1972.tb04772.x
PubMed Abstract | CrossRef Full Text | Google Scholar
45. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Farmakokinetik och farmakodynamik för desmopressin administrerat oralt respektive intravenöst dagtid respektive natt hos friska män i åldern 55-70 år. Eur J Clin Pharmacol. (2004) 60:397-402. doi: 10.1007/s00228-004-0781-9
PubMed Abstract | CrossRef Full Text | Google Scholar
46. Vande Walle J, Stockner M, Raes A, Nørgaard JP. Desmopressin 30 år i klinisk användning: en säkerhetsgranskning. Curr Drug Saf. (2007) 2:232-8. doi: 10.2174/157488607781668891
PubMed Abstract | CrossRef Full Text | Google Scholar
47. Yutaka O, Robertson GL, Nørgaard JP, Juul KV. Behandling av neurohypofysisk diabetes insipidus. J Clin Endocrinol Metabol. (2013) 98:3958-67. doi: 10.1210/jc.2013-2326
CrossRef Full Text | Google Scholar
48. Fjellestad-Paulsen A, Höglund P, Lundin S, Paulsen O. Farmakokinetik för 1-deamino-8-D-arginin vasopressin efter olika administreringsvägar hos friska frivilliga. Clin Endocrinol. (1993) 38:177-82. doi: 10.1111/j.1365-2265.1993.tb00990.x
CrossRef Full Text | Google Scholar
49. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Farmakokinetik, farmakodynamik, långtidseffekt och säkerhet hos oralt 1-deamino-8-D-arginin vasopressin hos vuxna patienter med central diabetes insipidus. Br J Clin Pharmacol. (1996) 42:379-85. doi: 10.1046/j.1365-2125.1996.39914.x
PubMed Abstract | CrossRef Full Text | Google Scholar
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Plasmafarmakokinetik för desmopressin efter sublingual administrering: en explorativ doseskalationsstudie på friska frivilliga män. Int J Clin Pharmacol Ther. (2006) 44:172-9. doi: 10.5414/CPP44172
PubMed Abstract | CrossRef Full Text | Google Scholar
51. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al. Desmopressin lyophilisate for the treatment of central diabetes insipidus: first experience in very young infants. Int J Endocrinol Metab. (2014) 12:e16120. doi: 10.5812/ijem.16120
PubMed Abstract | CrossRef Full Text | Google Scholar