- Introduktion
- Material och metoder
- Inklusionskriterier
- Ovariell stimulering och oocytuttag
- Policy för embryoöverföring
- Primära utfallsmått och statistisk analys
- Resultat
- Parametrar för oocyter och embryon
- Graviditetsutfall och kumulativt antal levande födda (CLBR)
- Diskussion
- Slutsats
- Datatillgänglighet
- Etiskt uttalande
- Författarnas bidrag
- Finansiering
- Intressekonfliktförklaring
- Acknowledgments
Introduktion
Nyligen utvecklades ett nytt system, POSEIDON-kriterierna, för att klassificera infertilitetspatienter med låg prognos som genomgår behandling med assisterad reproduktionsteknologi (ART) (1). Det är ett användbart system för identifiering och klassificering av patienter med nedsatt ovariereserv eller dålig ovariell respons (POR), vilket ger vägledning för diagnos och behandling av dessa patienter (2). Fyra undergrupper har föreslagits baserat på kvantitativa och kvalitativa parametrar, bland annat ålder, biomarkörer för ovarialreserv och ovarial respons. De nya kriterierna, genom att införa en mer detaljerad stratifiering av POR, minskade avsevärt heterogeniteten hos de patienter som uppfyller Bolognakriterierna (3), vilket kan differentiera patientundergrupper inom POR-populationen som skulle kunna identifieras och dra nytta av specifika interventioner (4). Även om POSEIDON-kriterierna fastställdes, tillsammans med vissa specifika behandlingsrekommendationer som föreslogs för de specifika patientsubgrupperna (5), finns det fortfarande otillräckliga bevis för att stödja giltigheten av de parametrar som används i POSEIDON-kriterierna, liksom utfallsbedömningen av olika subgrupper.
Av de fyra grupperna baserade på POSEIDON-kriterierna är grupp 1 otvivelaktigt den grupp som har den bästa prognosen med tanke på deras yngre ålder och normala ovariereserv, medan grupp 4 har den sämsta prognosen på grund av den höga åldern och den minskade ovariereserven. En intressant fråga är dock vem som skulle uppnå bättre graviditetsresultat, de äldre kvinnorna (grupp 2) med normal ovariereserv eller de unga kvinnorna (grupp 3) med minskad ovariereserv. Det kumulativa antalet levande födda barn (CLBR) anses vara ett lämpligt mått på IVF-behandlingens framgång (6). Hittills har det funnits mycket få rapporter om CLBR för de fyra patientgrupper som definieras av POSEIDON-kriterierna.
Patienternas egenskaper och prognos bör användas för att utveckla kliniska behandlingsstrategier. Syftet med denna studie är att karaktärisera patienter med låg prognos för att underlätta behandlingsbeslut. I den här studien analyserades utgångsegenskaperna och resultaten för patientgrupper som definierats enligt POSEIDON-kriterierna, och CLBR som resulterade i en cykel med aspirerad in-vitrofertilisering (IVF)/intracytoplasmatisk spermieinjektion (ICSI) föreslogs som det primära utfallsmåttet för patienter med låg prognos som genomgår IVF-behandling (7).
Material och metoder
Denna retrospektiva studie omfattade 18 455 färska aspirerade IVF-cykler med efterföljande frysta embryoöverföringar från januari 2014 till januari 2017 i vårt center. Utfallet för levande födda följdes upp i minst 2 år fram till januari 2019. Studien godkändes av den etiska kommittén för klinisk tillämpning av mänsklig assisterad reproduktionsteknik vid Northwest Women’s and Children’s Hospital (nr 2018002). Den etiska kommittén godkände studien och avstod från att inhämta informerat samtycke. All forskning utfördes i enlighet med relevanta riktlinjer och bestämmelser.
Inklusionskriterier
Patienterna kategoriserades enligt POSEIDON-kriterierna:
Patienter med låg prognos
Grupp 1 (n = 879 cykler): Grupp 1 (n = 879 cykler): Ålder < 35, antralt follikelantal (AFC) ≥ 5, antal oocyter hämtade ≤ 9 i föregående cykel;
Grupp 2 (n = 482 cykler): Grupp 2 (n = 482 cykler): Grupp 2 (n = 482 cykler): Ålder ≥ 35, AFC≥5, tidigare antal oocyter hämtade ≤ 9 i föregående cykel;
Grupp 3 (n = 858 cykler): Grupp 3 (n = 858 cykler): Grupp 2 (n = 858 cykler):
Grupp 4 (n = 1 306 cykler): Ålder < 35, AFC < 5;
Grupp 4 (n = 1 306 cykler): Ålder ≥ 35, AFC < 5;
Patienter utan låg prognos
Grupp 5 (n = 664 cykler): AFC ≥ 5, tidigare ovariell stimulering > 9 oocyter;
Grupp 6 (n = 13708 cykler): AFC ≥ 5, ingen tidigare ovariell stimulering.
Flödesschema och databehandlingsförfarande anges i figur 1. Demografiska uppgifter och basala egenskaper hos patienterna presenteras i tabell 1.
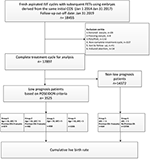
Figur 1. Flödesschema och databehandling.
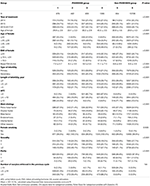
Tabell 1. Demografiska uppgifter och grundläggande egenskaper.
Ovariell stimulering och oocytuttag
Protokollet för ovariell stimulering (OS) fastställdes individuellt enligt kvinnans ålder, kroppsmasseindex (BMI), basalt follikelstimulerande hormon (FSH) och antral follikelantal (AFC). 94,33 % av IVF-patienterna fick rekombinanta och/eller urindrivna gonadotrofiner (rFSH/hMG) i GnRH-agonistprotokoll eller GnRH-antagonistprotokoll följt av IVF eller ICSI. För kvinnor med minskad ovariereserv användes det milda stimuleringsprotokollet eller ovariestimulering i lutealfas eller en naturlig cykel. Humant menopausalt gonadotrofin (hMG, Li Zhu, Kina) tillsattes i milt ägglossningsprotokoll eller Shanghai-protokoll enligt patienternas svar på stimulering. Humant choriongonadotrofin (hCG) 4 000-10 000 IE eller rekombinant hCG (r-hCG, MerckSerono S.p.A.) 250μg administrerades när 2-3 folliklar nådde storleken 17 mm eller högre. Trettiosex timmar senare utfördes oocytuttagningen med hjälp av transvaginal ultraljudsstyrd aspiration. Parametrarna för ovariell stimulering i varje grupp anges i tabell 2.

Tabell 2. Parametrar för äggstocksstimulering.
Policy för embryoöverföring
Förfarandena för oocytbehandling och embryoutveckling samt systemet för embryopoängsättning har beskrivits i våra tidigare artiklar (8, 9). Embryon av grad 1-3 på dag 3 ansågs vara användbara embryon och embryon av grad 1-2 ansågs vara embryon av god kvalitet. Alla färska embryoöverföringar (ET) genomfördes dag 3 eller dag 5. I fall med tillräckligt antal (≥ 3-4) embryon av god kvalitet på dag 3, skulle blastocystöverföring på dag 5 praktiseras. Förutom de överförda embryona vitrifierades patienternas extra embryon dag 3 eller på blastocyststadiet (dag 5-6). Embryon i klyvningsstadium 1-3 på dag 3 och blastocyster med Gardner-poäng över 4CC kryokonserverades (Cryo-top, öppet system, Kuwayama). Metoderna och förfarandet för Frozen ET beskrivs i detalj i vår grupps tidigare verifieringsstudie (8, 9). Om implantationen misslyckades i en färsk cykel, skulle den frysta upptinade embryoöverföringen (FET) utföras med hjälp av de återstående vitrifierade embryona eller blastocysterna. Patienter under 35 år med embryon av god kvalitet uppmuntrades att få en single-embryo transfer. En policy för överföring av ett enda embryo tillämpades också på patienter med onormal livmoder (t.ex. ärrad livmoder, missbildning av livmodern) och/eller andra fall som stod i konflikt med en tvillinggraviditet. Progesteron intramuskulär injektion (60 mg/dag) gavs för stöd i lutealfasen från dagen för oocytuttagningen fram till ett negativt serum beta-hCG eller 8 veckors graviditet.
Primära utfallsmått och statistisk analys
Det primära utfallet var kumulativa levande födslar (CLB), definierat som minst en levande födsel till följd av en aspirerad ART-cykel i färsk ET eller i efterföljande FET i förhållande till antalet uttagna oocyter. Täljaren för CLBR-beräkningen var summan av levande födslar som uppnåddes i FET och levande födslar i färska cykler. Endast den första förlossningen räknades med i analysen om en patient fick flera förlossningar. CLBR definierades som den kumulativa levande födelsen per transvaginal oocytaspirering i enlighet med terminologins definition (7, 10) En behandlingscykel definierades som en oocytuttagningscykel. Med en fullständig behandlingscykel menades en behandlingscykel som ledde till levande födelse eller en behandlingscykel som inte ledde till levande födelse med alla överförda embryon. Det kumulativa antalet levande födda barn i den här studien beräknades utifrån den fullständiga behandlingscykeln, så patienterna (n = 337) med icke-komplett behandling exkluderades.
Databearbetningen och den statistiska analysen utfördes med hjälp av programvaran EmpowerStats (www.empowerstats.com) och de statistiska programvarupaketen R. För att bedöma oddskvoten (OR) för CLBR i olika patientgrupper upprättades en regressionsmodell med flera variabler med potentiella förväxlingsfaktorer som variabler och justerades för behandlingsår, kvinnors BMI, typ av infertilitet, längden på infertiliteten, graviditet, paritet, huvudsaklig etiologi, OS-protokoll, gonadotrofintyp och FSH-startdos. Patienterna registrerades under 3 år, under vilka IVF-förfarandet reviderades. För att eliminera bias orsakad av denna faktor justerades det kumulativa antalet levande födda för behandlingsåret. Kvinnans BMI, typ av infertilitet, längden på infertiliteten, graviditet, paritet och huvudsaklig etiologi var viktiga faktorer som påverkade graviditet och levande födelse genom erfarenhet eller litteratur. OS-protokoll, gonadotropintyp och FSH-startdos är de viktigaste indikatorerna för att påverka antalet hämtade oocyter och i slutändan den kumulativa chansen till levande födslar.
Resultat
Parametrar för oocyter och embryon

Tabell 3. Parametrar för oocyter och embryon och CLBRs.
Graviditetsutfall och kumulativt antal levande födda (CLBR)
I motsats till fördelningsmönstret för antalet oocyter och embryon per grupp, var CLBRs i ordningen från högst till lägst 44.6 % i grupp 1 (n = 879), 35,5 % i grupp 3 (n = 858), 24,5 % i grupp 2 (n = 482) och 12,7 % i grupp 4 (n = 1306). En regressionsanalys med flera variabler utfördes med variabler som kan fungera som förväxlingsfaktorer som beskrivs i tabellerna 1 och 2. De justerade oddskvoterna (OR) för CLBR med deras 95-procentiga konfidensintervall (CIs) visas i tabell 4. I överensstämmelse med trenden i de icke-justerade resultaten var CLBR i grupp 3 (OR 0,9, 95 % CI 0,7-1,2, p = 0,615) något lägre och grupp 5 (OR 1,3, 95 % CI 0,9-1,7, p = 0,111) något högre än CLBR i grupp 1 utan signifikant statistisk skillnad. CLBR i grupp 2 var signifikant lägre än i grupp 1 (OR 0,6, 95 % CI 0,4-0,8, p = 0,004) och CLBR i grupp 4 var lägst (OR 0,4, 95 % CI 0,3-0,6, p < 0,001) jämfört med grupp 1. Tabell 5 visade graviditetsutfallet per färsk överföring eller FET hos patienter med låg prognos. Implantationsfrekvensen i de äldre grupperna (grupp 2 och grupp 4) var betydligt lägre än i de yngre grupperna (grupp 1 och grupp 3).

Tabell 4. Logistisk regressionsanalys för CLBRs.

Tabell 5. Graviditetsutfall per överföring både färsk och fryst embryoöverföring hos patienter med låg prognos.
Figur 2 visade trenddiagrammet för nyckelhändelser hos patienter med låg prognos. Det fanns en korsning av trendlinjerna mellan grupp 2 och grupp 3 efter embryoöverföring. Patienter i grupp 2 (ålder ≥35; AFC ≥ 5) hade högre AFC, fler hämtade oocyter, fler embryon och fler embryon av god kvalitet, men minskad implantationsfrekvens och CLBR. Tvärtom, även om patienterna i grupp 3 (ålder < 35; AFC < 5) hade färre oocyter och embryon, visade sig CLBR vara högre än i grupp 2. SWOT-analysen av 4 grupper av patienter med låg prognos definierade enligt POSEIDON-kriterierna visas i figur 3.
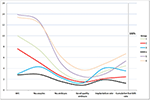
Figur 2. Trenddiagram över nyckelhändelser hos patienter med låg prognos. Det fanns en korsning av trendlinjerna mellan grupp 2 (röd) och grupp 3 (blå) efter embryoöverföring. X-axeln representerar genomsnittligt antal AFC, antal oocyter, antal embryon, antal embryon av god kvalitet, implantationsfrekvens och frekvensen av kumulativa levande födslar. Y-axeln till vänster representerar antalet av de fyra första variablerna (n) och Y-axeln till höger representerar andelen av de två sista variablerna (%).

Figur 3. SWOT-analys av 4 grupper av patienter med låg prognos definierade enligt POSEIDON-kriterierna.
Diskussion
Det viktigaste resultatet av denna retrospektiva studie i den population som definierats enligt POSEIDON-kriterierna var att CLBR var högst i grupp 1, följt av grupp 3 och grupp 2, och lägst i grupp 4. Enligt våra resultat var CLBR från de unga kvinnorna med dålig ovariereserv (grupp 3) något lägre än från unga kvinnor med god ovariereserv och tidigare låg responder (grupp 1). Även om patienterna i grupp 2 (ålder ≥ 35; AFC ≥ 5) hade bättre ovariereserv, fler oocyter och fler embryon var CLBR och implantationsfrekvensen å andra sidan lägre än hos patienterna i grupp 3 med sämre ovariereserv, färre oocyter och färre embryon. Detta resultat kan underlätta utvecklingen av hanteringsstrategier för patienter med låg prognos.
De innovativa POSEIDON-kriterierna syftar till att identifiera och stratifiera patienter med låg prognos i fyra olika grupper baserat på kvinnans ålder, AFC och ovarierespons i den föregående cykeln (4). Patienterna i grupp 2 kännetecknades av god ovariereserv och hög ålder, precis tvärtom mot grupp 3 patienter med dålig ovariereserv men är i yngre ålder. Studier (11-13) har visat att CLBR ökar med antalet hämtade oocyter även hos kvinnor i hög ålder (14). Det föreslogs att antalet oocyter som tagits fram är en mycket viktig variabel som är oberoende förknippad med CLBR. Patienter i grupp 2 med ett högre antal oocyter förväntades ha en bättre prognos än patienter i grupp 3, eftersom patienterna i grupp 2 hade fler embryon att överföra. CLBR och implantationsfrekvensen var dock omvänt högre i grupp 2 än i grupp 3.
Våra resultat överensstämmer med tidigare studier (15, 16) om sambandet mellan ovariereserv och graviditetsutfall. Chang et al. (15) fann att det fanns lägre andelar normal befruktning, klyvning, embryon av hög kvalitet, implantation och graviditet hos äldre kvinnor än hos yngre kvinnor med minskad ovariereserv. Den främsta orsaken var den åldrande oocytens negativa inverkan på graviditetsutfallet (låg implantationsfrekvens och hög graviditetsförlustfrekvens) på grund av kromosomavvikelser (17) och cytoplasmatisk dysfunktion (18). Minskningen av fertiliteten med åldrandet gäller både kvantitet och kvalitet på oocyten. Implantation och missfall är relaterade till oocyternas kvalitet men inte nödvändigtvis till den ovariella reserven (16). Den rättvisa ovariereserven i grupp 2 skulle öka möjligheten att få fler oocyter och embryon att överföra, men samtidigt skulle den högre aneuploidiefrekvensen leda till låg implantationsfrekvens och hög abortfrekvens.
När det gäller behandlingen av patienter i grupp 2 bör mer uppmärksamhet ägnas åt att utveckla strategier för att förbättra oocytkvaliteten snarare än oocytkvantiteten eller embryokvantiteten. Eftersom fler embryon uppnås på dag 3 i grupp 2 är odling av embryon till blastocyststadium för överföring ett bra alternativ. Embryon från dag 5-6 har lägre grad av segmentell aneuploidi (19) och högre livsduglighet för implantation (20) än embryon från dag 2-3. Preimplantatorisk genetisk testning för aneuploidi (PGT-A) är också fördelaktigt för avancerade kvinnor för att välja ett euploid embryo för överföring (21). En optimal ovariestimuleringsregim för att förbättra kvaliteten på oocyter (22, 23) kan vara ett alternativt alternativ. Tillägg som dehydroepiandrosteron har prövats för att förbättra follikelutvecklingen (24), även om det inte finns tillräckliga bevis för att stödja deras användning hos dessa patienter.
Patienterna i grupp 3 (ålder < 35; AFC < 5) hade en dålig ovariereserv, som förväntades vara dåliga respondenter med dåligt graviditetsutfall. Intressant nog var oocyternas utmatningsgrad (145,3 % oocyter hämtade per AFC) i grupp 3 signifikant högre än i de andra grupperna, även om FSH-startdosen inte ökades signifikant (tabell 2). Detta tyder på att svaret från antrala folliklar på gonadotropin kan ha nått gränsen för sin förmåga, varför det inte kommer att finnas någon ytterligare fördel i antalet oocyter att ytterligare öka de dagliga gonadotropindoserna (25). Att utvärdera ovariernas känslighet för FSH är en nyckelfaktor för att förbättra IVF-succéerna hos dessa patienter med låg prognos och öppna nya behandlingsperspektiv (26). Den höga oocytproduktionstakten per AFC i grupp 3 stödde också den rapporterade rekommendationen om maximal daglig dos på 300 IE rFSH (5). För patienterna i grupp 3 bör mer insatser fokuseras på att öka antalet oocyter, eftersom det kliniska graviditetsutfallet är betryggande när oocyter har erhållits.
Patienterna i grupp 5 var de patienter som inte hade låg prognos och som hade ett bra ovariesvar (mer än 9 oocyter vid föregående hämtning), men de flesta av dessa patienter misslyckades dock med att föda levande barn vid föregående IVF-cykel. Om man jämför med en annan icke-låg prognospatient med första IVF-behandling (grupp 6), även om patienterna i grupp 5 har mer AFC och antal hämtade oocyter, var embryoutvecklingen och graviditetsutfallet sämre än i grupp 6. Därför kan misslyckandet hos de första IVF-patienterna med gott ovariesvar vara den dåliga prognosen för efterföljande IVF-behandling.
Pelvic-tubal faktor är den vanligaste orsaken till infertilitet, och står för cirka 10,8-78,3 % av infertila kvinnor i Kina (27, 28). Tubal faktor innefattar huvudsakligen tubal ocklusion och peritoneal patologi som orsakar adhesioner, vilket diagnostiserades med hysterosalpingografi och laparoskopi. Den vanligaste orsaken till tubalfaktorinfertilitet tillskrivs bäckeninflammation (PID), salpingit och endometrios (29). I patientgrupperna i den här studien är tubalfaktor den huvudsakliga infertilitetsetiologin, som varierar mellan 62,9 och 71,4 %, vilket var högre än hos infertilitetskvinnor i andra länder och regioner. Därför bör man vara försiktig med att tolka de bredare konsekvenserna av resultaten.
Begränsningar är relaterade till studiens retrospektiva karaktär och det faktum att uppgifterna kom från ett enda center försvagar också universaliteten i våra observationer. Andra potentiella begränsningar kan vara att icke-GnRH-analoga protokoll användes hos vissa kvinnor med minskad ovariereserv snarare än hos dem med normal ovariereserv. De färska cykler som inte gav någon oocyt ingick inte i den här studien, till exempel cykler med avbruten ovariestimulering.
Resultaten av den här studien kan ge nya insikter för utveckling av hanteringsstrategier för patienter med låg prognos. En SWOT-analys utfördes för att underlätta hanteringen för patienter med låg prognos på kliniken, som utgick från POSEIDON-rapporterna (1, 2, 4, 5) och uppgifterna i denna studie. Antralfolliklernas responsivitet för gonadotrofin var extremt mycket högre i grupp 3 än i de andra grupperna. Med tanke på det glädjande CLBR-resultatet i grupp 3 föreslår vi att man för att öka oocytavkastningen försöker med fler ovarialstimuleringar men inte hårdare ovarialstimulering genom en alltför hög daglig gonadotrofin-dos. Även om patienterna i grupp 2 har större ovariell reserv samt fler oocyter och embryon var CLBR lägre än förväntat. Behandlingsstrategin för grupp 2 bör vara att förbättra antalet levande födslar snarare än att öka antalet hämtade oocyter.
Slutsats
Slutsatsen, som inte stämmer överens med fördelningsmönstret för oocytkvantitet och embryokvantitet per patientgrupp, var CLBR i ordningen från högst till lägst i grupp 1 (unga kvinnor med god ovariereserv), grupp 3 (unga kvinnor med dålig ovariereserv), grupp 2 (kvinnor i avancerad ålder med god ovariereserv), och till sist grupp 4 (kvinnor i avancerad ålder med dålig ovariereserv.
Datatillgänglighet
Rådata som stöder slutsatserna i detta manuskript kommer att göras tillgängliga av författarna, utan onödiga förbehåll, för alla kvalificerade forskare.
Etiskt uttalande
Studien godkändes av etikkommittén för klinisk tillämpning av mänsklig assisterad reproduktionsteknologi vid Northwest Women’s and Children’s Hospital (No. 2018002). Etikkommittén som godkände studien avstod från att inhämta informerat samtycke. All forskning utfördes i enlighet med relevanta riktlinjer och bestämmelser.
Författarnas bidrag
WS och JS tänkte ut och utformade studien. WS och WZ utarbetade och reviderade manuskriptet. WS, ZZ och WZ analyserade och tolkade data. LT, ZZ och HZ samlade in och rensade data. Alla författare har läst och godkänt den slutliga versionen av manuskriptet.
Finansiering
Studien finansierades av General Projects of Social Development in Shaanxi Province (No. 2018SF-247) och Personnel Training Program of Northwest women and children’s Hospital (2018ZD02).
Intressekonfliktförklaring
Författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller ekonomiska relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Vi tackar alla kliniker, forskare och embryologer på Northwest Women and Children’s Hospital för deras hjälp med datainsamlingen, och alla patienter för deras bidrag till denna studie. Vi tackar tacksamt Dr Xinglin Chen från Department of Epidemiology and Biostatistics, X&Y solutions Inc. i Boston för hennes bidrag till det statistiska stödet.
1. Alviggi C, Andersen CY, Buehler K, Conforti A, De Placido G, Esteves SC, et al. En ny mer detaljerad stratifiering av personer som svarar lågt på ovariestimulering: från ett dåligt ovariesvar till ett koncept med låg prognos. Fertil Steril. (2016) 105:1452-3. doi: 10.1016/j.fertnstert.2016.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Humaidan P, Alviggi C, Fischer R, Esteves SC. Den nya POSEIDON-stratifieringen av ”patienter med låg prognos vid assisterad befruktningsteknik” och dess föreslagna markör för ett lyckat resultat. F1000Res. (2016) 5:2911. doi: 10.12688/f1000research.10382.1
CrossRef Full Text | Google Scholar
3. Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund G, Gianaroli L, et al. ESHRE konsensus om definitionen av ”dåligt svar” på ovariestimulering för in vitro-fertilisering: Bologna-kriterierna. Hum Reprod. (2011) 26:1616-24. doi: 10.1093/humrep/der092
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Esteves SC, Roque M, Bedoschi GM, Conforti A, Humaidan P, Alviggi C. Definition av patienter med låg prognos som genomgår assisterad reproduktionsteknik: POSEIDON-kriterierna – varför. Front Endocrinol. (2018) 9:461. doi: 10.3389/fendo.2018.00461
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Shi W, Zhang S, Zhao W, Xia X, Wang M, Wang H, et al. Faktorer relaterade till klinisk graviditet efter vitrifierad-varm embryoöverföring: en retrospektiv och multivariat logistisk regressionsanalys av 2313 överföringscykler. Hum Reprod. (2013) 28:1768-75. doi: 10.1093/humrep/det094
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Polyzos NP, Drakopoulos P, Parra J, Pellicer A, Santos-Ribeiro S, Tournaye H, et al. Cumulative live birth rates according to the number of oocytes retrieved after the first ovarian stimulation for in vitro fertilization/intracytoplasmic sperm injection: a multicenter multinational analysis including approximately 15 000 women. Fertil Steril. (2018) 110:661-70 e1. doi: 10.1016/j.fertnstert.2018.04.039
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Zhou J, Wang B, Hu Y, Sun H. Samband mellan antalet hämtade oocyter och kumulativt antal levande födda hos kvinnor i åldern 35-40 år som genomgår långa IVF/ICSI-cykler med GnRH-agonister. Arch Gynecol Obstet. (2017) 296:1005-12. doi: 10.1007/s00404-017-4503-9
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. Cumulative live birth rate prognosis based on the number of aspirated oocytes in previous ART cycles. Hum Reprod. (2019) 34:171-80. doi: 10.1093/humrep/dey341
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Devesa M, Tur R, Rodriguez I, Coroleu B, Martinez F, Polyzos NP. Kumulativa levande födelsetal och antal oocyter som tagits ut hos kvinnor i hög ålder. En analys från ett enda centrum med 4500 kvinnor >/= 38 år gamla. Hum Reprod. (2018) 33:2010-17. doi: 10.1093/humrep/dey295
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Chang Y, Li J, Li X, Liu H, Liang X. Äggkvalitet och graviditetsresultat hos unga infertila kvinnor med minskad ovariereserv. Med Sci Monit. (2018) 24:7279-84. doi: 10.12659/MSM.910410
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bishop LA, Richter KS, Patounakis G, Andriani L, Moon K, Devine K. Diminished ovarian reserve as measured by means of baseline follicle-stimulating hormone and antral follicle count is not associated with pregnancy loss in younger in vitro fertilization patients. Fertil Steril. (2017) 108:980-7. doi: 10.1016/j.fertnstert.2017.09.011
CrossRef Full Text | Google Scholar
17. Igarashi H, Takahashi T, Nagase S. Oocyte aging underlies female reproductive aging: biological mechanisms and therapeutic strategies. Reprod Med Biol. (2015) 14:159-69. doi: 10.1007/s12522-015-0209-5
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Babariya D, Fragouli E, Alfarawati S, Spath K, Wells D. The incidence and origin of segmental aneuploidy in human oocytes and preimplantation embryos. Hum Reprod. (2017) 32:2549-60. doi: 10.1093/humrep/dex324
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Zeng M, Su S, Li L. Comparison of pregnancy outcomes after vitrification at the cleavage and blastocyst stage: a meta-analysis. J Assist Reprod Genet. (2018) 35:127-34. doi: 10.1007/s10815-017-1040-1
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Lin LT, Vitale SG, Chen SN, Wen ZH, Tsai HW, Chern CU, et al. Luteal phase ovarian stimulation may improve oocyte retrieval and oocyte quality in poor ovarian responders undergoing in vitro fertilization: preliminary results from a single-center prospective pilot study. Adv Ther. (2018) 35:847-56. doi: 10.1007/s12325-018-0713-1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Narkwichean A, Maalouf W, Baumgarten M, Polanski L, Raine-Fenning N, Campbell B, et al. Efficacy of dehydroepiandrosterone (DHEA) to overcome the effect of ovarian ageing (DITTO): a proof of principle double blinded randomized placebo controlled trial. Eur J Obstet Gynecol Reprod Biol. (2017) 218:39-48. doi: 10.1016/j.ejogrb.2017.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Grynberg M, Labrosse J. Understanding follicular output rate (FORT) and its implications for POSEIDON criteria. Front Endocrinol. (2019) 10:246. doi: 10.3389/fendo.2019.00246
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Hou LY. Epidemiologisk studie om infertilitet i tre provinser i Kina. Phd Thesis, Graduate School of Peking Union Medical College, Beijing, Kina (2011).
Google Scholar
28. Zhu Hui-li HW. Epidemiologi och etiologi för oviduct infertilitet. J Int Reprod Health/Family Plann. (2016) 35:212-216.
Google Scholar