När väte är kovalent bundet till en mycket elektronegativ atom, t.ex. fluor, klor, syre eller kväve, har H-atomen en partiell positiv laddning, skrivet Hδ+.
Hδ+ är fysiskt sett mycket liten, så laddningstätheten på den är ovanligt hög.
Föreställ dig att en annan negativ eller elektronegativ atom, till exempel på en annan molekyl, närmar sig Hδ+; det kommer att ske en ömsesidig attraktion, vilket resulterar i en särskilt stark dipol-dipolattraktion.Denna attraktion kallas vätebindning.
I allmänhet är vätebindningar svagare än joniska och kovalenta bindningar, men starkare än van der Waals-krafter.

Vätevätebindning i vatten
Det mest kända exemplet på vätebindning är vatten:
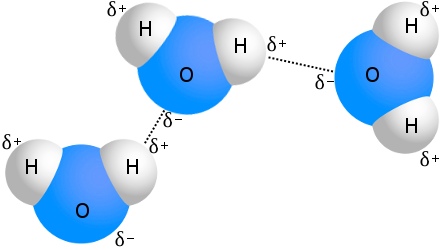
Varje vattenmolekyl kan vara vätebunden till så många som fyra andra vattenmolekyler.I vatten vid rumstemperatur är det genomsnittliga antalet vätebindningar per vattenmolekyl 3,6,
Molekylernas slumpmässiga termiska rörelse gör att livslängden för varje enskild vätebindning i vatten är kort, i genomsnitt endast 10 pikosekunder.Tiden för att bilda en ny bindning är dock ännu kortare.
För att permanent bryta en enskild vätebindning i vatten krävs 21 kJ mol-1, vilket är en betydande energitillförsel.Resultatet är att vattnets smält- och kokpunkt är mycket högre än vad man skulle kunna förvänta sig för en molekyl med så låg molekylvikt.
Konsultera vatten vs metan: Vattenmolekyler dras ganska starkt till varandra genom vätebindning, medan van der Waals-krafter råder i metan. så även om deras molekylmassor är likartade, 18 för vatten och 16 för metan, är deras fysikaliska egenskaper mycket olika.Till exempel smälter vatten vid 0,00 °C och kokar vid 99,98 °C; metan smälter vid -182,5 °C och kokar vid -161,5 °C.
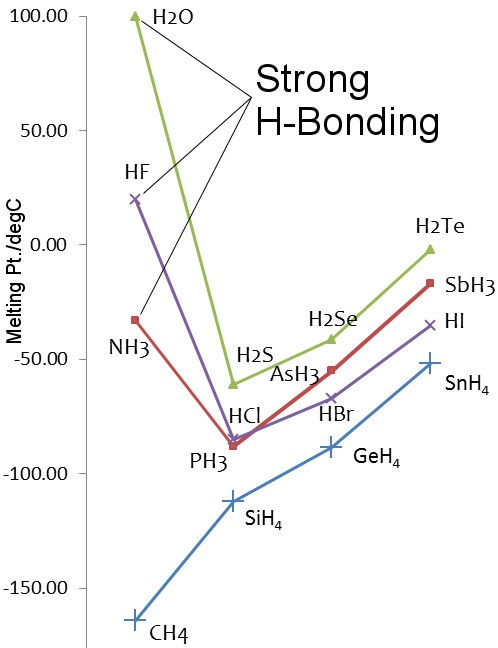
Vätevätebindning i vatten jämfört med vätesulfid
Svaveln finns i grupp 16 i det periodiska systemet, samma som syre. Svavel är tyngre än syre, såH2S borde ha högre smält- och kokpunkt än H2O.Detta är dock inte fallet eftersom svavel är mindre elektronegativt än syre, och därför är vätebindningen i H2S svag.

Mol. Mass: 16
Smältpunkt: 0,00 °C
Kokpunkt: 99,98 °C
Elektronegativitet för O (Pauling): 3,44
Vätgasbindningsenthalpi: 21 kJ mol-1

Mol. Mass: 34
Smältpunkt: -82 °C
Kokpunkt: -60 °C
Elektronegativitet för S (Pauling): 2.58
Vätgasbindningsenthalpi: ≅ 3 kJ mol-1
Vätgasbindning i ammoniak och vätefluorid
Fluor och kväve är de mest elektronegativa grundämnena i sina grupper i det periodiska systemet och vätebindning observeras i vätefluorid och ammoniak.
Som för vatten är vätefluoridens och ammoniakens smält- och kokpunkter högre än hydriderna av tyngre grundämnen i deras grupper.
Smältpunkter för hydriderna av grundämnen i grupp 14-17
Hydrogenbindning i DNA
DNA:s baspar binder samman dess två helixkedjor. basparen bär DNA:s genetiska information.
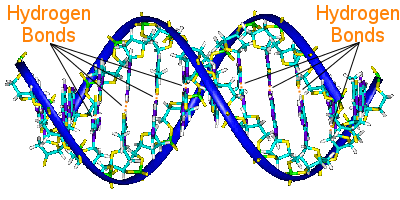
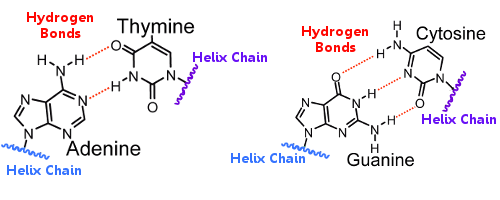
Basparen på den ena helixen är kopplade till basparen på den andra helixen med hjälp av vätebindningar.På så sätt håller vätebindningen ihop helixerna, vilket skapar den berömda dubbelhelixen.
När DNA replikeras bryts vätebindningarna, vilket gör att de två helixerna kan separeras.På så sätt spelar vätebindning en viktig roll i basparens lås-och-nyckel-mekanism vid DNA-replikation.
Vätevätebindning i ull
Likt andra proteinfibrer uppvisar ull vätebindning. bilden nedan visar hur vätebindningar (orange prickar) binder samman spolarna i ullens α-helixkedja (grön).
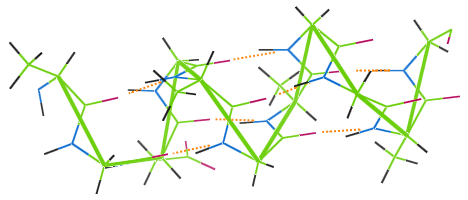
Om ett ullplagg tvättas vid hög temperatur förstörs vätebindningarna, spolarna förlorar sin elasticitet och plagget blir misskött.
