Lärandemål
- Utvidga tidigare introducerade jämviktsbegrepp till syror och baser som kan ge eller ta emot mer än en proton
Vi kan också använda de relativa styrkorna hos konjugerade syra-baspar för att förstå syra-basegenskaperna hos lösningar av salter. En neutraliseringsreaktion kan definieras som en reaktion mellan en syra och en bas som ger upphov till ett salt och vatten. Det innebär att en annan katjon, till exempel \(Na^+\), ersätter syrans proton. Ett exempel är reaktionen av \(\ce{CH3CO2H}\), en svag syra, med \(\ce{NaOH}\), en stark bas:
\
Avhängigt av syra-basegenskaperna hos dess beståndsdeljoner kan dock ett salt lösas upp i vatten för att producera en neutral lösning, en basisk lösning eller en sur lösning.
När ett salt som \(NaCl\) löser sig i vatten bildar det \(Na^+_{(aq)}\) och \(Cl^-_{(aq)}\) joner. Med hjälp av en Lewis-metod kan \(Na^+\)-jonen betraktas som en syra eftersom den är en elektronparacceptor, även om dess låga laddning och relativt stora radie gör den till en mycket svag syra. \(Cl^-\)-jonen är konjugerad bas till den starka syran \(HCl\), så den har i princip ingen basisk karaktär. Följaktligen har upplösning av \(NaCl\) i vatten ingen effekt på \(pH\) i en lösning, och lösningen förblir neutral.
Nu ska vi jämföra detta beteende med beteendet hos vattenlösningar av kaliumcyanid och natriumacetat. Återigen har katjonerna (\(K^+\) och \(Na^+\)) i princip ingen sur karaktär, men anjonerna (\(CN^-\) och \(CH_3CO_2^-\)) är svaga baser som kan reagera med vatten eftersom de är konjugerade baser till de svaga syrorna \(HCN\) respektive ättiksyra.
\
\
Ingen av reaktionerna går särskilt långt åt höger som skrivet eftersom bildandet av det svagare syra-basparet gynnas. Både \(HCN\) och ättiksyra är starkare syror än vatten, och hydroxid är en starkare bas än antingen acetat eller cyanid, så i båda fallen ligger jämvikten till vänster. Trots detta genererar var och en av dessa reaktioner tillräckligt många hydroxidjoner för att producera en basisk lösning. Till exempel är \(pH\) för en 0,1 M lösning av natriumacetat eller kaliumcyanid vid 25°C 8,8 respektive 11,1. Av tabell E1 och E2 framgår att \(CN^-\) är en starkare bas (\(pK_b = 4,79\)) än acetat (\(pK_b = 9,24\)), vilket stämmer överens med att \(KCN\) ger en mer basisk lösning än natriumacetat vid samma koncentration.
Däremot bör den konjugerade syran till en svag bas vara en svag syra. Ammoniumklorid och pyridiniumklorid är till exempel salter som framställs genom att ammoniak respektive pyridin reagerar med \(HCl\). Som du redan vet är kloridjonen en så svag bas att den inte reagerar med vatten. Däremot är katjonerna i de två salterna svaga syror som reagerar med vatten på följande sätt:
\
Figur \(\(\PageIndex{2}\) visar att \(H_3O^+\) är en starkare syra än antingen \(NH_4^+\) eller \(C_5H_5NH^+\), och omvänt är ammoniak och pyridin båda starkare baser än vatten. Jämvikten kommer därför att ligga långt till vänster i båda fallen, vilket gynnar det svagare syra-basparet. Den koncentration \(H_3O^+\) som produceras av reaktionerna är dock tillräckligt stor för att minska lösningens \(pH\) avsevärt: \(pH\) för en 0,10 M lösning av ammoniumklorid eller pyridiniumklorid vid 25 °C är 5,13 respektive 3,12.
Vad händer med vattenlösningar av ett salt som ammoniumacetat, där både katjonen och anjonen kan reagera separat med vatten för att producera en syra respektive en bas? Enligt figur 16.10 kommer ammoniumjonen att sänka \(pH\), medan acetatjonen enligt figur 16.9 kommer att höja \(pH\). Detta särskilda fall är ovanligt, eftersom katjonen är en lika stark syra som anjonen är en bas (pKa ≈ pKb). Följaktligen upphävs de två effekterna och lösningen förblir neutral. Med salter där katjonen är en starkare syra än anjonen är en bas har den slutliga lösningen ett \(pH\) < 7,00. Omvänt, om katjonen är en svagare syra än anjonen är en bas, har den slutliga lösningen ett \(pH\) > 7,00.
Akida metalljoner
Lösningar av enkla salter av metalljoner kan också vara sura, även om en metalljon inte kan donera en proton direkt till vatten för att producera \(H_3O^+\). Istället kan en metalljon agera som en Lewis-syra och interagera med vatten, en Lewis-bas, genom att koordinera till ett ensam elektronpar på syreatomen för att bilda en hydrerad metalljon (figur \(\(\PageIndex{1a}\)). En vattenmolekyl som är samordnad med en metalljon är surare än en fri vattenmolekyl av två skäl. För det första gör repulsiva elektrostatiska interaktioner mellan den positivt laddade metalljonen och de delvis positivt laddade väteatomerna i den koordinerade vattenmolekylen det lättare för det koordinerade vattnet att förlora en proton.
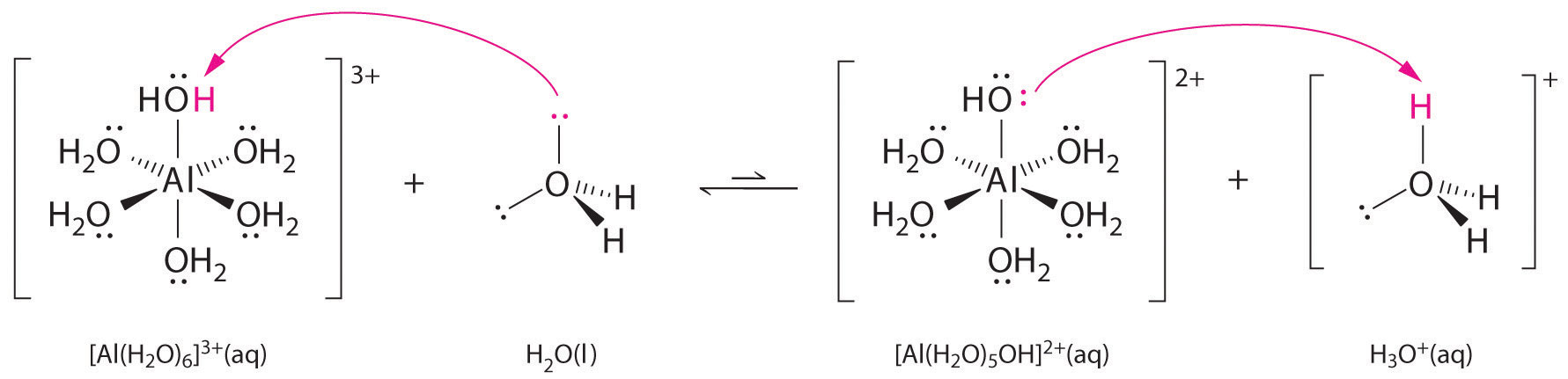
För det andra drar den positiva laddningen på \(Al^{3+}\)-jonen till sig elektrontäthet från vattenmolekylernas syreatomer, vilket minskar elektrontätheten i \(\ce{O-H}\)-bindningarna, vilket visas i figur \(\PageIndex{1b}\). Med mindre elektrontäthet mellan \(O\)-atomerna och H-atomerna är \(\ce{O-H}\)-bindningarna svagare än i en fri \(H_2O\)-molekyl, vilket gör det lättare att förlora en \(H^+\)-jon.
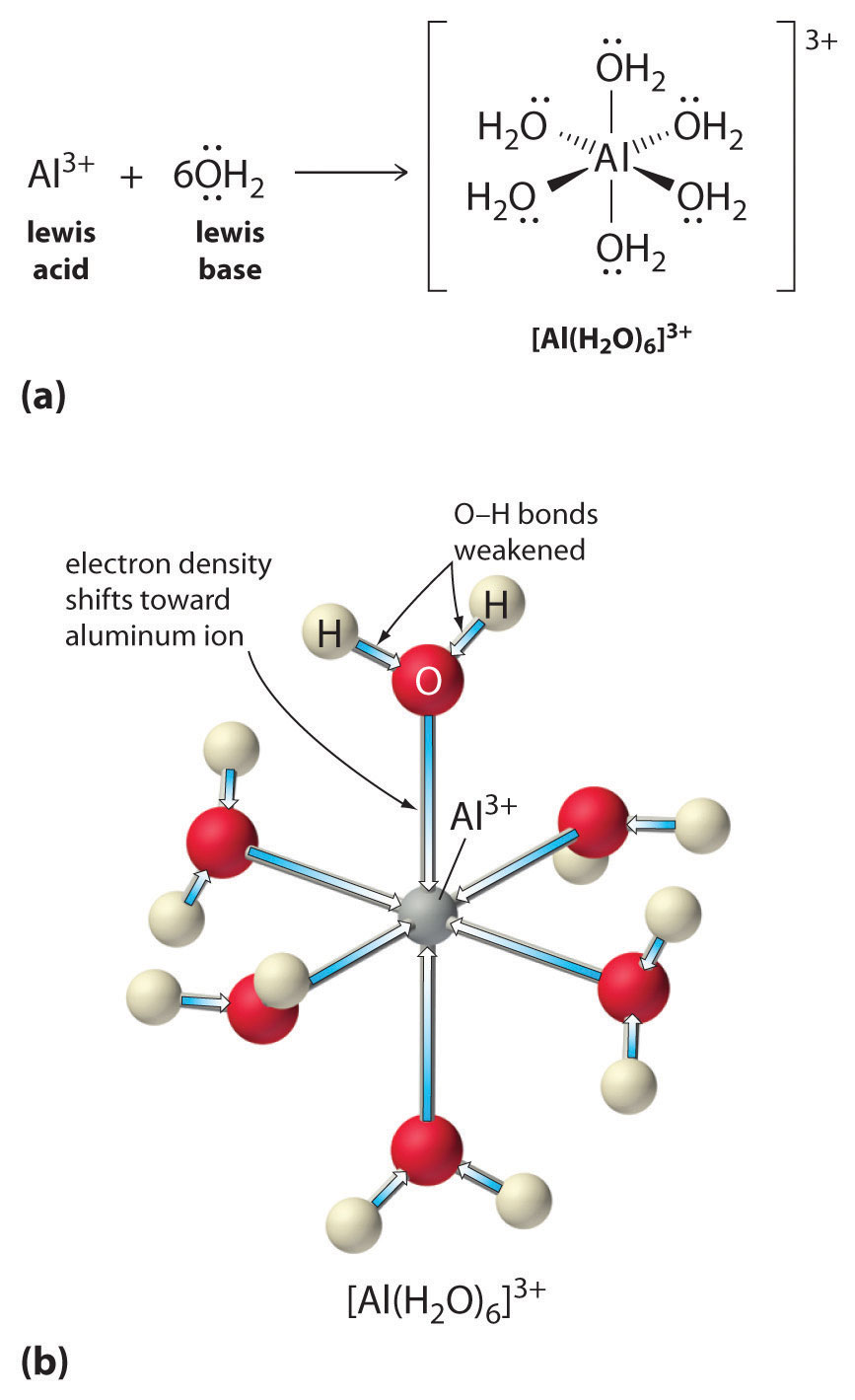
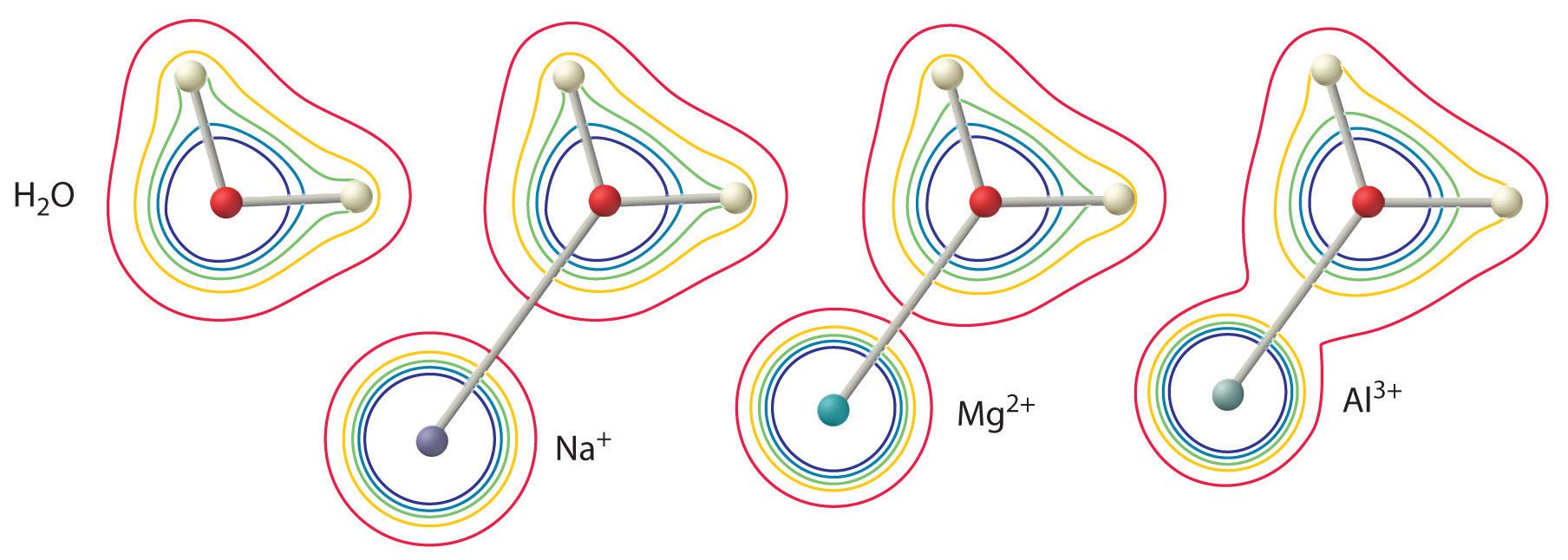
Storleken på denna effekt beror på följande två faktorer (Figur \(\(\PageIndex{3}\)):
- Laddningen på metalljonen. En divalent jon (\(M^{2+}\)) har ungefär dubbelt så stark effekt på elektrontätheten i en koordinerad vattenmolekyl som en monovalent jon (\(M^+\)) med samma radie.
- Metalljonens radie. För metalljoner med samma laddning gäller att ju mindre jonen är, desto kortare är det mellankärniga avståndet till vattenmolekylens syreatom och desto större är metallens effekt på elektrontäthetsfördelningen i vattenmolekylen.
Därmed är vattenlösningar av små, högt laddade metalljoner, såsom \(Al^{3+}\) och \(Fe^{3+}\), sura:
\^{3+}_{(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \label{16.36}\]
Den \(^{3+}\) jonen har en \(pK_a\) på 5,0, vilket gör den nästan lika stark syra som ättiksyra. På grund av de två faktorer som beskrivits tidigare är den viktigaste parametern för att förutsäga effekten av en metalljon på surheten hos koordinerade vattenmolekyler metalljonens förhållande mellan laddning och radie. Ett antal par metalljoner som ligger på en diagonal linje i det periodiska systemet, t.ex. \(Li^+\) och \(Mg^{2+}\) eller \(Ca^{2+}\) och \(Y^{3+}\), har olika storlekar och laddningar, men likartade förhållande mellan laddning och radie. Därför har dessa par av metalljoner liknande effekter på surheten hos koordinerade vattenmolekyler, och de uppvisar ofta även andra betydande likheter i kemin.
Acida metalljoner
Lösningar av små, högt laddade metalljoner i vatten är sura.
Reaktioner som de som diskuteras i det här avsnittet, där ett salt reagerar med vatten för att ge en sur eller basisk lösning, kallas ofta för hydrolysreaktioner. Att använda ett separat namn för denna typ av reaktioner är olyckligt eftersom det antyder att de på något sätt är olika. I själva verket är hydrolysreaktioner bara syra-basreaktioner där syran är en katjon eller basen en anjon; de lyder under samma principer och regler som alla andra syra-basreaktioner.
Hydrolys
En hydrolysereaktion är en syra-basreaktion.
Exempel \(\PageIndex{1}\)
Förutsäg om vattenlösningar av dessa föreningar är sura, basiska eller neutrala.
- \(KNO_3\)
- \(CrBr_3 \cdot H_2O\)
- \(Na_2SO_4\)
Givna: förening
Fråga om: Syra eller basicitet i vattenlösning
Strategi:
- Bedöm kationens och anjonens syra-basiska egenskaper. Om katjonen är en svag Lewis-syra kommer den inte att påverka lösningens \(pH\). Om katjonen är den konjugerade syran till en svag bas eller en relativt högt laddad metallkatjon kommer den dock att reagera med vatten och ge en sur lösning.
- Om anjonen är den konjugerade basen till en stark syra kommer den inte att påverka lösningens \(pH\). Om anjonen däremot är den konjugerade basen till en svag syra kommer lösningen att vara basisk.
Lösning:
a
- Den \(K^+\)-katjonen har en liten positiv laddning (+1) och en relativt stor radie (eftersom den står i den fjärde raden i det periodiska systemet), så den är en mycket svag Lewis-syra.
- Den \(NO_3-\) anjonen är den konjugerade basen till en stark syra, så den har i princip ingen basisk karaktär (tabell 16.1). Därför kommer varken katjonen eller anjonen att reagera med vatten för att producera \(H^+\) eller \(OH^-\), och lösningen kommer att vara neutral.
b.
- Den \(Cr^{3+}\)-jonen är en relativt högladdad metallkatjon som bör uppträda på samma sätt som \(Al^{3+}\)-jonen och bilda 3+-komplexet, som kommer att bete sig som en svag syra: \^{3+}_{(aq)} \ce{ <=>>} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_({aq)}\]
- Anjonen \(Br^-\) är en mycket svag bas (den är konjugerad bas till den starka syran \(HBr\)), så den påverkar inte lösningens \(pH\). Därför kommer lösningen att vara sur.
c.
- Ionen \(Na^+\) är liksom \(K^+\) en mycket svag syra, så den bör inte påverka lösningens surhet.
- Däremot är \(SO_4^{2-}\) den konjugerade basen till \(HSO_4^{2-}\), som är en svag syra. Därför kommer \(SO_4^{2-}\)-jonen att reagera med vatten enligt figur 16.6 för att ge en svagt basisk lösning.
Övningsuppgift \(\(\PageIndex{1}\)
Förutsäg om vattenlösningar av följande är sura, basiska eller neutrala.
- \(KI\)
- \(Mg(ClO_4)_2\)
- \(NaHS\)
Svar a
neutralt
Svar b
syra
Svar c
basiskt (på grund av reaktionen av \(HS^-\) med vatten för att bilda \(H_2S\) och \(OH^-\))
Sammanfattning
Ett salt kan lösas upp i vatten för att producera en neutral, en basisk eller en sur lösning, beroende på om det innehåller den konjugerade basen till en svag syra som anjon (\(A^-\)), den konjugerade syran till en svag bas som katjon (\(BH^+\)), eller båda. Salter som innehåller små, starkt laddade metalljoner ger sura lösningar i vatten. Reaktionen av ett salt med vatten för att producera en sur eller basisk lösning kallas hydrolysereaktion.