Semnele intracelulare, cum ar fi deteriorarea ADN-ului celulei, determină apoptoza în principal prin calea intrinsecă. Calea intrinsecă de apoptoză, care implică proteine de semnalizare conservate, este asociată fizic cu mitocondriile și, la vertebrate, este sensibilă la stresul oxidativ mitocondrial. Calea este influențată de membrii familiei Bcl legați de membrana mitocondrială, inclusiv de gena Bax și Bcl-2, care acționează ca proteine de reglare pro- sau, respectiv, anti-apoptotică.
Vizualizare generală a căii apoptozei intrinseci
Calea apoptozei intrinseci este inițiată, de exemplu, de chimioterapie și/sau radioterapie. Ea este activată de o serie de stimuli exogeni și endogeni, cum ar fi deteriorarea ADN-ului, ischemia și stresul oxidativ. Mai mult, joacă o funcție importantă în dezvoltare și în eliminarea celulelor deteriorate.
În calea intrinsecă, consecința funcțională a semnalizării pro-apoptotice este perturbarea membranei mitocondriale și eliberarea citocromului c în citoplasmă, unde acesta formează un complex sau apoptosom cu factorul de activare a proteazei apoptotice 1 (APAF1) și forma inactivă a caspazei-9. Acest complex hidrolizează adenozin trifosfatul pentru a cliva și activa caspaza-9. Inițiatorul caspazei-9 clivează și activează apoi caspazele executante-3/6/7, ceea ce duce la apoptoza celulară. Este total diferită de semnalele extracelulare, care sunt de obicei generate de celulele citotoxice ale sistemului imunitar și care declanșează apoptoza în principal prin intermediul căii extrinseci.
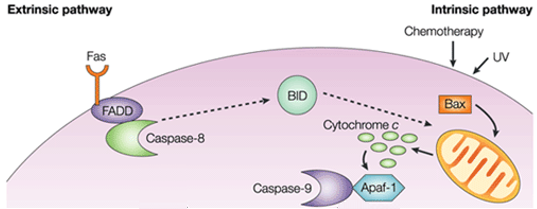
Figura 1. Diferența dintre calea extrinsecă și calea intrinsecă.
Procesul și reglarea căii de apoptoză intrinsecă
Calea de apoptoză intrinsecă induce apoptoza prin activarea directă a caspazei-3 sau prin clivarea bid (agonist de moarte cu domeniu de interacțiune BH3), ceea ce duce la disfuncție mitocondrială și eliberarea ulterioară de citocrom c și activarea caspazelor-9 și caspazelor-3. Caspaza-3 promovează caracteristicile tipice ale apoptozei, inclusiv fragmentarea ADN-ului și moartea celulară în mai multe țesuturi.
Familia proteică B-cell lymphoma 2 (Bcl-2) controlează strâns activarea căii intrinseci. Se găsește în limfomul folicular și a fost identificată pentru prima dată ca fiind una dintre genele implicate în moartea celulară, fie prin activarea apoptozei proapoptotice, fie prin inhibarea apoptozei antiapoptotice. Proteinele dintr-un subgrup, inclusiv Bid, Bad, Bim, Bmf, Puma și Noxa, conțin un singur domeniu Bcl-2 homologie 3 (proteine BH3-only) și au activitate proapoptotică. Alte două subgrupe de proteine au mai multe domenii BH. Primul subset, care include proteina X asociată cu Bcl-2 (Bax), Bcl-2 homologous antagonist/killer (Bak) și regulatorul de apoptoză din familia Bcl-2 (Bok), este proapoptotic; celălalt subset, care include Bcl-2, Bcl-XL și Mcl-1, este antiapoptotic. Calea mitocondrială este parțial influențată de membrii familiei Bcl legați de membrana mitocondrială, incluzând atât proteinele reglatoare pro-apoptotice Bax, cât și proteinele reglatoare anti-apoptotice Bcl-2.
Molenuțele pro-apoptotice determină permeabilizarea membranei mitocondriale externe, ceea ce duce la efluxul de citocrom c, care se leagă de adaptorul Apaf-1 și de inițiatorul caspazei-9 din citosol pentru a forma complexul apoptosom. Aceasta stimulează caspaza-9, care, la rândul ei, activează caspazele efectoare. Mitocondrionul eliberează, de asemenea, o proteină numită Smac/DIABLO în citosol. Smac/DIABLO promovează indirect apoptoza prin blocarea efectelor unui grup de proteine anti-apoptotice numite proteine inhibitoare ale apoptozei (IAPs).
Proteinele anti-apoptotice Bcl-2 și Bcl-XL inhibă eliberarea citocromului c, în timp ce Bax, Bak și Bid, toate proteine pro-apoptotice, promovează eliberarea acestuia din mitocondrie. Citocromul c și deoxiadenozin trifosfat (dATP) se leagă de APAF-1 pentru a forma un complex multimeric care recrutează și activează pro-caspaza-9, o protează de execuție care mediază apoptoza și care, la rândul său, activează cascada caspazelor, ceea ce duce la apoptoza celulară. În timpul acestui proces, caspaza-2, caspaza-8, caspaza-9 și caspaza-10 sunt implicate în inițierea apoptozei. Caspaza-3, caspaza-6 și caspaza-7 sunt implicate în apoptoză. Caspaza-3 și caspaza-7 reglează inhibarea reparării ADN-ului și inițiază degradarea ADN-ului. În plus, caspaza-6 reglează dezintegrarea lamei și a citoscheletului.
Calea apoptozei intrinseci în fiziopatologie
Majoritatea terapiilor chimioterapeutice și a celor țintite împotriva cancerului ucid celulele tumorale prin generarea de semnale pro-moarte care inițiază calea apoptotică intrinsecă a morții celulare programate. Punctul de neîntoarcere în cascada apoptotică este permeabilizarea membranei exterioare mitocondriale (MOMP); odată ce a avut loc, permeabilizarea mitocondrială duce la formarea unui apoptosom, care facilitează activarea caspazelor și declanșează ulterior celelalte semne distinctive ale morții celulare apoptotice. Decizia celulară de a iniția MOMP este controlată de un echilibru delicat între moleculele pro- și anti-apoptotice din familia BCL-2.
Unul dintre motivele rezistenței la chimioterapie este eșecul celulelor tumorale de a intra în apoptoză din cauza unor defecte în calea apoptotică intrinsecă (de exemplu, modificări ale p53). În ciuda îmbunătățirilor semnificative în tratament, ratele de vindecare pentru multe tipuri de cancer rămân sub nivelul optim. Apariția chimioterapiei citotoxice a dus la o terapie curativă pentru un subset de cancere, deși rezistența intrinsecă la tratament este dificil de prezis pentru fiecare pacient în parte. Valul de terapii cu țintă moleculară s-a concentrat pe mutațiile care activează gablele medicamentoase și, prin urmare, este limitat la anumite subgrupuri de pacienți. Calea mitocondrială intrinsecă a apoptozei reprezintă o țintă promițătoare pentru noile terapii, iar țintirea cu succes a acestei căi are potențialul de a modifica peisajul terapeutic al terapiei pentru o varietate de cancere.
.