Sistemul imunitar
Sistemul imunitar este alcătuit din țesuturi, celule și molecule a căror funcție principală este de a detecta, răspunde și elimina agenții patogeni și celulele transformate.
Răspunsul imunitar înnăscut și adaptativ
Există două componente principale ale sistemului imunitar-1) sistemul imunitar înnăscut și 2) sistemul imunitar adaptativ. Sistemul imunitar înnăscut acționează ca primă linie de apărare și detectează agenții patogeni prin intermediul receptorilor de recunoaștere a tiparelor codificați de linia germinală, nu formează memorie și răspunde rapid (în câteva minute sau ore). Sistemul imunitar adaptativ răspunde lent (în decurs de câteva zile), utilizează receptori specifici antigenului care trec prin multiple rearanjări genetice în timpul dezvoltării și formează memorie imunologică – „învățând” din insulta inițială și pregătind organismul pentru a lupta împotriva expunerii viitoare la materiale dăunătoare similare. Ambele tipuri de răspunsuri imune pot fi determinate fie de macromoleculele din lichidul extracelular, fie de activarea unor celule imune specifice. Aceste răspunsuri sunt cunoscute sub numele de imunitate umorală și, respectiv, imunitate mediată de celule.
Sub umbrela răspunsului imun mediat celular, celulele imune se stratifică în principal pe baza faptului că răspunsul este înnăscut sau adaptativ. Sistemul imunitar înnăscut este format în principal din celule fagocitare, cum ar fi neutrofilele, macrofagele, celulele ucigașe naturale, bazofilele și altele care țintesc organismele invadatoare periculoase. Celulele sistemului imunitar adaptiv sunt celulele T și celulele B. Celulele T natural killer (NK) au caracteristici atât ale celulelor imunitare înnăscute, cât și ale celor adaptative. În plus, majoritatea celorlalte tipuri de celule, care nu sunt specifice sistemului imunitar, pot găzdui funcții imune înnăscute intrinseci sub forma unor receptori citoplasmatici și a unor molecule de semnalizare și efectoare, cum ar fi membrii familiilor RIG-I, STING și NLR. După cum vom trece în revistă în continuare, celulele ambelor sisteme provin din diferite linii mieloide și limfoide ale celulelor stem hematopoietice.
Componente ale sistemului imunitar
Celulele imune mature se diferențiază din ceea ce se numește celule stem hematopoietice. Acestea sunt celule progenitoare nediferențiate pluripotente și nediferențiate care se găsesc în măduva osoasă, în sângele periferic și în placentă. Aceste celule stem hematopoietice se pot diferenția în celule progenitoare mieloide comune sau în celule progenitoare limfoide comune.
Celule limfoide
Celulele progenitoare limfoide comune se pot diferenția în patru populații majore de limfocite care pot fi distinse prin expresia receptorilor de suprafață celulară: Celulele T, celulele B, celulele natural killer (NK) și celulele NK-T.
Celulele T
Celulele T joacă un rol critic în imunitatea mediată celular. Aceste celule sunt identificate prin exprimarea lanțurilor de semnalizare a celulelor T CD3.
Celulele T provin din celule progenitoare limfoide care se dezvoltă inițial din celulele stem hematopoietice din măduva osoasă. Odată ce progenitorul limfoid se angajează să devină o celulă T, acesta migrează din măduva osoasă în timus (de unde și numele de celulă T). Timusul oferă micro-mediul adecvat în care celulele T se pot dezvolta în diferitele lor subtipuri, definite de receptorii specifici exprimați pe suprafața celulară. Celulele T aflate la maturitate în stadii incipiente, sau timocite, nu au receptori atât pentru CD4, cât și pentru CD8 și, prin urmare, sunt numite celule dublu negative (DN). Celulele DN suferă apoi rearanjamente genetice și mutații la nivelul genelor care codifică pentru receptorii alfa și beta ai celulelor T (TCR), ceea ce le inițiază pe o cale de angajare a liniei prin care rezultatul final este un receptor de celule T cu afinitate specifică pentru un antigen unic.
Timocitele sunt apoi selectate, atât pozitiv, cât și negativ, pentru a se asigura că recunosc antigene „străine”, dar nu și antigene ale gazdei, care sunt prezentate sub formă de peptide prin intermediul MHC de pe suprafața celulară. Numai celulele care trec ambele teste vor fi apoi declanșate pentru a exprima CD4 și CD8, devenind celule dublu-pozitive. La sfârșitul maturării, celulele T vor exprima fie CD4, fie CD8 (și vor pierde expresia celeilalte), devenind astfel celule monopozitive. Aceste celule T mature CD4 sau CD8-pozitive sunt apoi eliberate în fluxul sanguin și se află inițial în stare naivă, ceea ce înseamnă că nu s-au angajat încă la un anumit subtip de celule T.
Dacă timocitul în curs de maturare prezintă o cantitate intermediară de afinitate pentru peptidele MHC proprii în timpul maturării, atunci acesta poate fi selectat pentru a deveni o celulă T reglatoare (Treg) pentru capacitatea sa de a recunoaște antigene „proprii” dăunătoare. Celulele T din sânge sau din țesuturile periferice pot fi, de asemenea, induse local pentru a deveni Tregs. Sarcina principală a Tregs este de a menține toleranța față de antigene proprii, precum și de a limita funcția și proliferarea celulelor T efectoare.
Odată ajunse în sânge sau în țesuturile periferice, celulele T naive pot fi induse să devină o celulă T-helper. Celulele prezentatoare de antigen (APC), cum ar fi macrofagele, celulele dendritice și celulele B, vor arăta antigenul celulei T, iar dacă receptorul său are afinitate, celula T va recunoaște antigenul. În mod obișnuit, celulele T CD4+ sunt potrivite pentru a recunoaște antigene peptidice legate de proteinele MHC de clasă II. Odată ce complexul peptidă-MHC este recunoscut, celula T va activa o serie de căi interne care permit verificarea recunoașterii antigenului. Abia apoi celula T-helper va prolifera, extinzând grupul de celule disponibile care sunt specifice pentru antigenul dăunător, cum ar fi diferite bacterii și paraziți.
Odată ce celulele T-helper și-au recunoscut antigenul și s-au activat, ele vor elibera o varietate de citokine, care sunt molecule care semnalează altor celule imunitare cum să răspundă în mod corespunzător la molecula dăunătoare. Există mai multe subseturi de celule T ajutătoare, inclusiv Th1, Th2 și Th17. Aceste subseturi produc și secretă citokine distincte care ajută la adaptarea răspunsului imunitar în funcție de tipul de agent patogen. De exemplu, celulele Th1 se bazează pe citokina efectoare IFN-γ pentru a semnala macrofagelor să digere și să distrugă materialul dăunător, în timp ce celulele Th2 secretă o combinație de IL-4, IL-5, IL-9, IL-10 și IL-13 pentru a declanșa bazofilele, eozinofilele și alte celule care să atace infecția. Cantitatea și varietățile specifice de citokine vor determina răspunsul adecvat la infecție sau la celula dăunătoare. Celulele T pot răspunde, de asemenea, la celulele proprii devenind celule T citotoxice (sau celule T ucigașe naturale). De obicei, acestea sunt celule CD8+ care recunosc celulele infectate cu virusuri sau celulele tumorale. Celulele T natural killer (NKT) vor fi discutate mai în detaliu într-o secțiune ulterioară. Aceste și alte tipuri de celule T își îndeplinesc diferitele sarcini sau funcții efectoare în moduri disparate pentru a recunoaște materialul dăunător și a recruta alte celule imunitare pentru a-l distruge, precum și pentru a construi un răspuns imunitar de durată la același tip de insultă.
Calea interactivă de semnalizare a receptorilor celulelor T este analizată în detaliu aici.
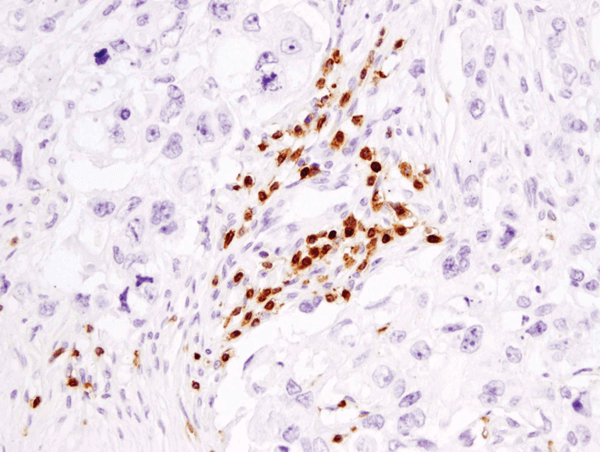
CD3ε (D7A6E™) XP® Rabbit mAb #85061: Analiza IHC a carcinomului mamar uman încorporat în parafină utilizând #85061.
CD3ε (D7A6E™) XP® Rabbit mAb #85061: Analiza IHC a carcinomului mamar uman încorporat în parafină folosind #85061.
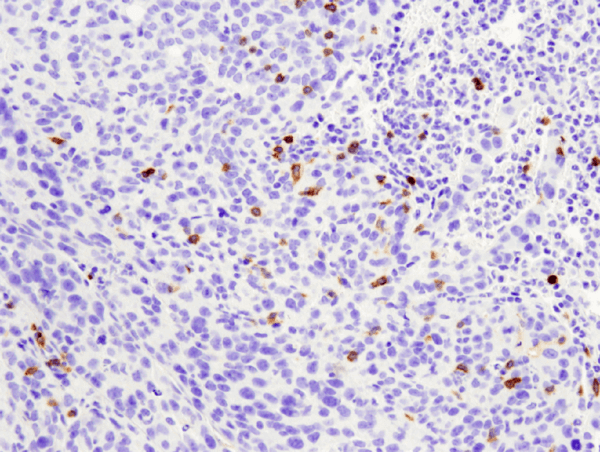
CD4 (D7D2Z) Rabbit mAb #25229: Analiza IHC a tumorii metastatice 4T1 din plămân de șoarece încorporate în parafină folosind #25229.
CD4 (D7D2Z) Rabbit mAb #25229: Analiza IHC a tumorii metastatice 4T1 încorporate în parafină în plămânul de șoarece folosind #25229.
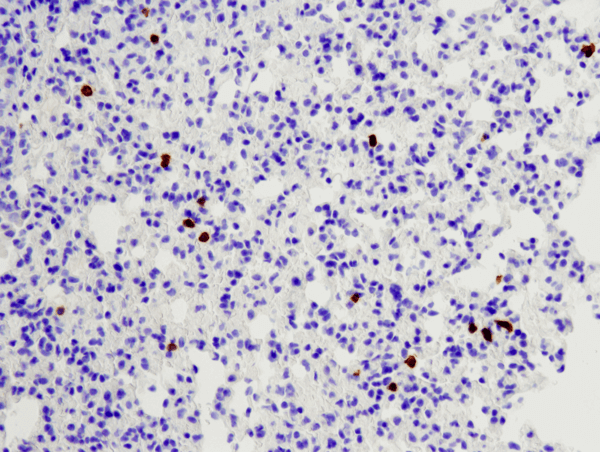
CD8α (D4W2Z) XP® Rabbit mAb (specific șoarecilor) #98941: Analiza IHC a plămânului de șoarece încorporat în parafină folosind #98941.
CD8α (D4W2Z) XP® Rabbit mAb (Mouse Specific) #98941: Analiza IHC a plămânului de șoarece încorporat în parafină folosind #98941.
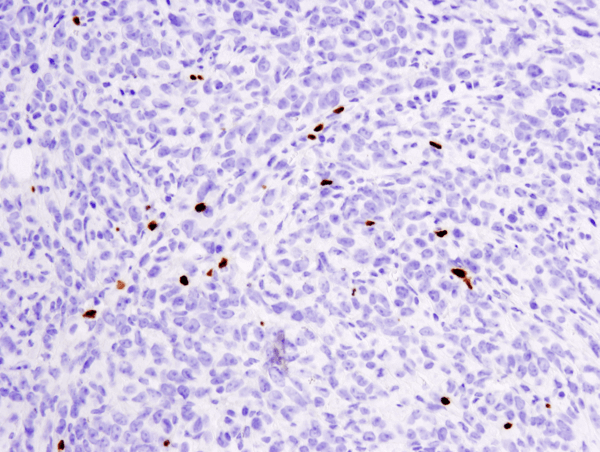
FoxP3 (D6O8R) Rabbit mAb #12653: Analiză IHC a tumorii metastatice 4T1 din plămân de șoarece încorporate în parafină folosind #12653.
FoxP3 (D6O8R) Rabbit mAb #12653: Analiza IHC a tumorii metastatice 4T1 încorporate în parafină în plămânul de șoarece folosind #12653.
Celule B
Celulele B sunt celulele critice din sânge care mediază producția de anticorpi. Atunci când un material dăunător este prezent în fluxul sanguin, acesta este recunoscut ca antigen de către receptorii specifici de pe celulele B. Apoi, după procesarea antigenului și cu ajutorul celulelor T, celula B se maturizează în celule plasmatice care secretă anticorpi. Celulele B pot juca, de asemenea, un rol în prezentarea antigenelor și în secreția de citokine. Vor fi discutate atât dezvoltarea, cât și diferitele funcții ale celulei B.
15% din leucocitele care se găsesc în sângele periferic sunt celule B. Celulele B produc imunoglobuline (Ig), care sunt proteine de legare a antigenului (cunoscute și sub numele de anticorpi) compuse din două lanțuri grele identice și două lanțuri ușoare identice. Aceste imunoglobuline conțin situsuri specifice de fixare a antigenului care variază în secvența de aminoacizi de la o moleculă de anticorp la alta. Aceste situsuri conferă specificitate fiecărui anticorp pentru recunoașterea unui antigen distinct.
După cum s-a menționat mai sus, celulele B se diferențiază din celulele hematopoietice care se găsesc în măduva osoasă. În cadrul măduvei osoase se asamblează receptorii Ig de suprafață (anticorpi) printr-un proces de rearanjare genetică. Celulele B utilizează îmbinarea somatică a diferitelor gene de pe o multitudine de cromozomi care codifică diferitele părți ale lanțurilor grele și ușoare care alcătuiesc Ig. Celulele B sunt împinse spre diferențiere prin producerea de IL-7 de către celulele stromale din măduva osoasă. Aceste celule B în curs de dezvoltare urmează un program de rearanjări secvențiale ale lanțurilor grele și ușoare, mediate de expresia diferențiată a receptorilor de pe suprafața celulară. De exemplu, expresia unui receptor specific al celulelor pre-B previne anumite rearanjări genetice pe cromozomi neînrudiți pentru a se asigura că celula B matură poate exprima un anumit receptor de suprafață Ig capabil să recunoască în mod specific un singur antigen. Acest proces se numește excludere alelică. Asamblarea incorectă a lanțurilor grele și a lanțurilor ușoare Ig poate induce rearanjamente secundare pentru editarea receptorului.
În afară de exprimarea la suprafața celulară a unui receptor Ig, celulele B conțin, de asemenea, proteine transmembranare care pot induce semnale intracelulare după ce un antigen se leagă de porțiunea extracelulară a receptorului Ig. Celulele B utilizează cascade de semnalizare intracelulară similare cu cele ale celulelor T, care induc modificări transcripționale ce duc la proliferare și maturare. Mai exact, domeniile intracelulare ale receptorului Ig pot fi fosforilate de către familia src de kinaze, inițiind o cascadă care este transmisă de tirozin-kinaza Syk și de o proteină de legătură cunoscută sub numele de BLINK către fosfolipază C și factori de schimb de guanină, activând în cele din urmă proteina kinaza C, mobilizând calciul și activând MAP kinaza într-o manieră dependentă de Ras/Rac.
O caracteristică unică a celulelor B este capacitatea lor de a suferi schimbări de izotip. Aceasta se referă în mod specific la un proces de rearanjare a ADN-ului care poate genera lanțuri grele ușor diferite. În plus, splicarea alternativă a exonilor lanțului greu poate permite ca Ig să rămână legată la suprafața celulară sau să devină secretată dacă exonul transmembranar este eliminat. Splicingul alternativ și comutarea izotipică sunt induse de citokinele derivate din celulele T. În plus, celulele T pot induce mutații somatice care duc la modificări în situsurile de legare la antigen ale Ig din celulele B. O funcție de autocorecție a celulelor B poate detecta dacă aceste mutații aparent aleatorii duc la o pierdere de afinitate pentru antigen și inițiază un program de moarte celulară. Astfel, antigenele care activează atât celulele T, cât și celulele B declanșează maturarea celulelor B mediată de celulele T prin schimbarea de izotip și mutații somatice, ambele fiind foarte asociate cu memoria celulelor B.
Răspunsurile de memorie sunt caracterizate de o producție rapidă și extinsă de Ig de înaltă afinitate pentru astfel de antigene. Dezvoltarea acestor răspunsuri de memorie sunt esențiale pentru succesul vaccinării. Cu toate acestea, ele pot crește, de asemenea, autoimunitatea și reacțiile alergice.
Poate avea loc, de asemenea, activarea celulelor B independente de celulele T de către un antigen; cu toate acestea, acest tip de activare este legat de o memorie imunitară slabă. În plus, acești antigeni trebuie să fie polimerici pentru a activa celulele B.
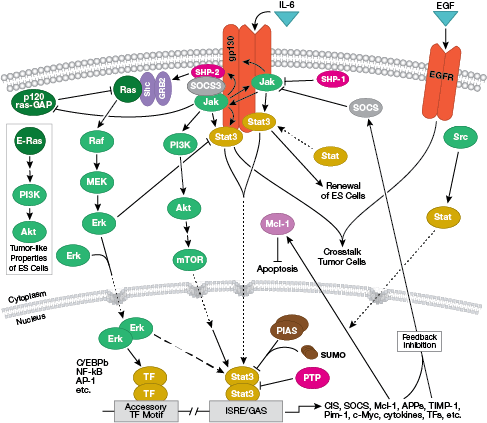
NB: Citokinele, sau interleukinele (IL), sunt molecule secretate care acționează pe receptorii transmembranari de pe suprafața celulară. După legare, aceste citokine activează căile de transducție a semnalului intracelular care depind de obicei de semnalizarea Jak-STAT.
Calea interactivă de semnalizare a receptorilor celulelor B este analizată în detaliu aici.
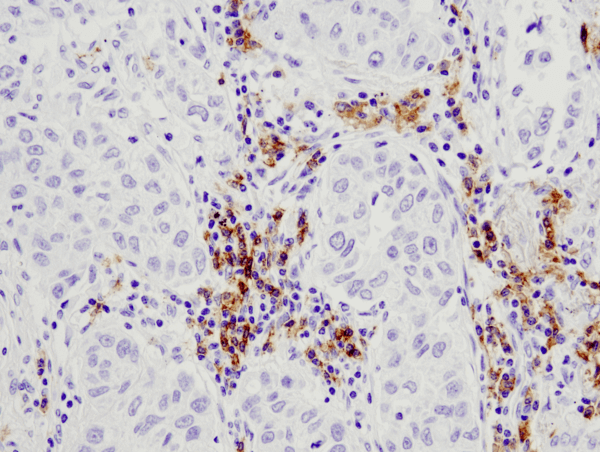
CD19 (D4V4B) XP® Rabbit mAb #90176: Analiză IHC a carcinomului pulmonar uman încorporat în parafină utilizând #90176.
CD19 (D4V4B) XP® Rabbit mAb #90176: Analiza IHC a carcinomului pulmonar uman încorporat în parafină folosind #90176.
Celule NK
Celulele natural killer, sau NK, sunt un alt tip de celule derivate din linia limfoidă. Similar cu celulele B, acestea se dezvoltă în măduva osoasă într-o manieră dependentă de citokine și de celulele stromale din măduva osoasă. Ele reprezintă o proporție mică din sângele periferic și nu au receptori specifici antigenului. În schimb, celulele NK se bazează pe un set complex de receptori transmembranari. În special, ele conțin receptori inhibitori de suprafață celulară care recunosc moleculele HLA de clasă I și sunt astfel inhibate de moleculele MHC proprii, ucigând numai celulele care au expresia HLA de clasă I reglată în jos. Prin urmare, ele au rolul important de a ținti celulele infectate viral și celulele tumorale a căror expresie HLA de clasă I este reglată pentru a evita moartea de către celulele T natural killer CD8+ (NK-T). De asemenea, celulele NK pot fi activate într-o manieră dependentă de anticorpi, interferon sau citokine și, prin urmare, pot juca un rol important în combaterea tumorilor. Mecanismul de acțiune al celulelor NK se bazează pe eliberarea din citoplasma lor a unor mici granule care conțin granzime și perforină. În urma eliberării lor, aceste proteine pot face pori și pot descompune proteinele intracelulare pentru a induce apoptoza. Ca atare, se spune despre celulele NK că sunt citotoxice.
Celulele NK-T sunt un subtip special de celule T care exprimă anumiți receptori și markeri exprimați de obicei de celulele NK în combinație cu un repertoriu limitat de receptori de celule T. Prin urmare, acest subtip unic împărtășește proprietăți atât ale celulelor T, cât și ale celulelor NK. Spre deosebire de celulele NK, care se dezvoltă în măduvă, celulele NK-T se dezvoltă în timus.
Celule mieloide
Celulele progenitoare mieloide comune, care sunt descendente ale celulelor stem hematopoietice, dau naștere la mai multe tipuri diferite de celule mieloide, inclusiv macrofage, celule dendritice și alte câteva celule imunitare înnăscute și celule sanguine.
Macrofagele
Macrofagele pot fi declanșate pentru a recunoaște antigene, cum ar fi celule deteriorate sau material străin, pentru distrugere la cerere. Macrofagele sunt prezente în majoritatea țesuturilor și răspund la nevoie la infecții și la celulele muribunde. Materialul recunoscut este distrus prin fagocitoză în macrofage, ceea ce dă numele celulelor („mare mâncător” în limba greacă). Macrofagele iau diverse forme atunci când sunt prezente în diferite locații și pot îndeplini funcții suplimentare în afară de fagocitoză.
În cazul unei leziuni tisulare sau al unei infecții cu agenți patogeni, monocitele din sânge vor fi recrutate în țesutul afectat și se vor diferenția pentru a deveni macrofage. În funcție de localizarea tisulară, există diferite tipuri de macrofage, cum ar fi celulele Kupffer în ficat, macrofagele alveolare în plămâni, microglia în creier etc. Aceste tipuri diferite de macrofage provin toate din monocite, dar își specializează funcția în funcție de țesutul rezident. Cea mai mare parte a funcției generale de fagocitoză este îndeplinită de macrofagele tisulare rezidente. Pe lângă fagocitarea celulelor moarte și a materialului străin, macrofagele pot, de asemenea, să transmită semnale către alte celule imune prin intermediul citokinelor. Într-o anumită măsură, macrofagele îndeplinesc funcția critică de prezentare a antigenului, lucrând în consecință împreună cu celulele T pentru a susține imunitatea adaptivă. În plus, macrofagele pot secreta citokine cum ar fi IL-12 și joacă un rol în răspunsurile imune locale, în timp ce altele secretă cantități mari de IL-10, care mediază rolul lor în repararea țesuturilor. Astfel, „marii mâncători” joacă o varietate de roluri în sistemul imunitar, în plus față de sarcina principală de fagocitoză.
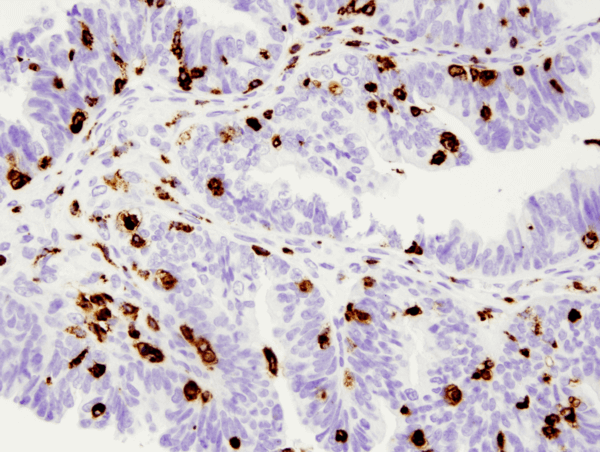
CD68 (D4B9C) XP® Rabbit mAb #76437: Analiză IHC a carcinomului papilar seros uman de ovar, încorporat în parafină, utilizând #76437.
CD68 (D4B9C) XP® Rabbit mAb #76437: Analiză IHC a carcinomului papilar seros uman de ovar încorporat în parafină folosind #76437.
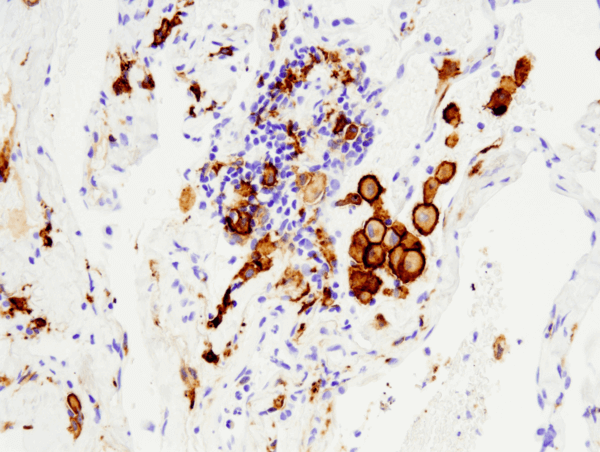
CD163 (D6U1J) Rabbit mAb #93498: Analiză IHC a carcinomului pulmonar uman fără celule mici încorporat în parafină folosind #93498 efectuată pe Leica® Bond™ Rx.
CD163 (D6U1J) Rabbit mAb #93498: Analiză IHC a carcinomului pulmonar uman fără celule mici încorporat în parafină folosind #93498 efectuată pe Leica® Bond™ Rx.
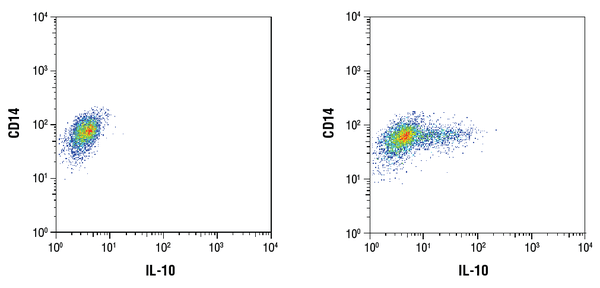
IL-10 (D13A11) XP® Rabbit mAb #12163: Analiza citometrică în flux a celulelor mononucleare purificate CD14+ din sângele periferic uman netratate (stânga) sau tratate cu LPS (100ng/mL, 16 ore; dreapta) utilizând un anticorp CD14 și #12163. Brefeldin A #9972 (300ng/mL) a fost adăugat la celulele netratate și tratate după 1 oră de stimulare cu LPS. Anti-rabbit IgG (H+L), F(ab’)2 Fragment (Alexa Fluor® 647 Conjugat) #4414 a fost utilizat ca anticorp secundar.
IL-10 (D13A11) XP® Rabbit mAb #12163: Analiza citometrică în flux a celulelor mononucleare purificate CD14+ din sângele periferic uman netratate (stânga) sau tratate cu LPS (100ng/mL, 16 ore; dreapta) utilizând un anticorp CD14 și #12163. Brefeldin A #9972 (300ng/mL) a fost adăugat la celulele netratate și tratate după 1 oră de stimulare cu LPS. Anti-rabbit IgG (H+L), F(ab’)2 Fragment (Alexa Fluor® 647 Conjugat) #4414 a fost utilizat ca anticorp secundar.
Celule dendritice
Asemănătoare macrofagelor, celulele dendritice au capacitatea de a înghiți material celular și străin, dar în loc să îl digere pentru a fi eliminat, celulele dendritice procesează materialul și îl prezintă sub formă de antigene celulelor T. Ca atare, celulele dendritice servesc drept celule prezentatoare de antigen, sau celule accesorii, și astfel transmit informații despre agenții patogeni între sistemul imunitar înnăscut și cel adaptiv. Celulele dendritice își primesc numele de la proiecțiile lor celulare distincte care se întind și prind materialul dăunător pentru a fi digerat.
Apărând din progenitorii hematopoietici ai măduvei osoase, celulele dendritice inițial imature trec printr-o fază de „învățare” în care eșantionează zona lor locală pentru a găsi material străin și inițiază un răspuns de recunoaștere prin intermediul receptorilor de recunoaștere a tiparelor (un set comun al acestor receptori sunt receptorii de tip Toll). Aceste celule dendritice imature pot locui în diferite locații cu acces la mediul extern, cum ar fi mucoasa nasului, a stomacului, a plămânilor și chiar în piele. La recunoașterea antigenului, celulele dendritice vor migra apoi în ganglionul limfatic, unde vor antrena celulele T să recunoască antigenul și să răspundă în consecință. Celulele dendritice sunt singurele celule prezentatoare de antigen care activează atât celulele T cu memorie, cât și cele naive. Receptorii Toll-like sunt o clasă bine studiată de receptori prezenți pe macrofage și pe celulele dendritice, care mediază recunoașterea și răspunsul la agenții patogeni străini. Pe lângă interacțiunea directă cu celulele T, celulele dendritice pot transmite semnale și prin intermediul citokinelor, cum ar fi IL-12, care acționează pentru a pregăti sistemul imunitar pentru atacul ulterior asupra materialului dăunător. Alte tipuri de celule dendritice pot secreta citokine care semnalează pentru a recruta mai multe macrofage pentru a curăța o supraîncărcare de material rezidual. În calitate de principali mediatori celulari pentru prezentarea antigenului, celulele dendritice joacă astfel un rol indispensabil în interacțiunea dintre sistemul imunitar înnăscut și cel adaptiv.
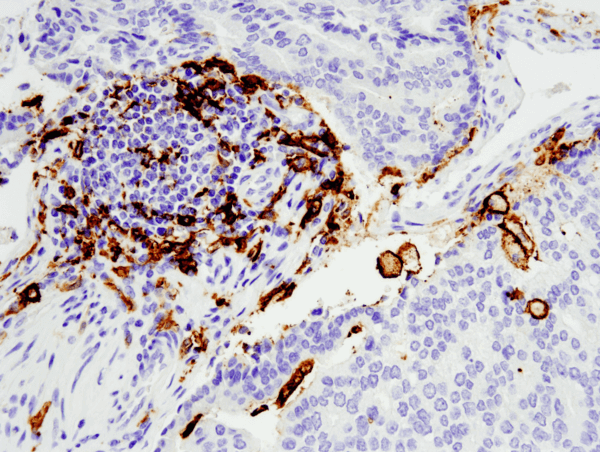
CD11c (D3V1E) XP® Rabbit mAb #45581: Analiză IHC a adenocarcinomului de prostată uman încorporat în parafină folosind #455812 realizată pe Leica® Bond™ Rx.
CD11c (D3V1E) XP® Rabbit mAb #45581: Analiză IHC a adenocarcinomului de prostată uman încorporat în parafină folosind #455812 realizată pe Leica® Bond™ Rx.
Alte celule ale sistemului imunitar înnăscut și semnalizare
Alte celule ale sistemului imunitar înnăscut includ mastocitele, care funcționează în vindecarea rănilor și ajută la asigurarea unei protecții împotriva agenților patogeni. Atunci când sunt declanșate de un agent patogen, mastocitele pot secreta citokine, precum și granule care conțin histamină și heparină, care mediază răspunsul imunitar ulterior, cum ar fi recrutarea macrofagelor și dilatarea vaselor de sânge. Neutrofilele, eozinofilele și bazofilele sunt denumite în mod colectiv granulocite datorită granulelor caracteristice din citoplasma lor. La neutrofile, granulele acționează pentru a elibera compuși toxici care țintesc agenții patogeni, cum ar fi ciupercile și bacteriile.
Imunologie în sănătate și boală
Imunologia cancerului
Exploatarea celulelor imune pentru a lupta împotriva cancerului a devenit un subiect de cercetare foarte fierbinte datorită succesului înregistrat în clinică. Un obiectiv recent al imunoterapiei actuale implică țintirea proteinelor de semnalizare a punctelor de control, cum ar fi PD-1, care, în mod normal, împiedică activarea celulelor T și răspunsul. Terapia celulară adoptivă este o altă abordare interesantă care implică imunoeditarea celulelor T recoltate de la pacient. Celulele T sunt modificate pentru a exprima un receptor de antigen chimeric specific care este specific pentru celulele canceroase ale pacientului. Celulele T sunt apoi reinfuzate în pacient și sunt acum programate să caute celulele canceroase și să le ucidă, în conformitate cu funcția normală a celulelor T. Aceste și alte abordări de manipulare a sistemului imunitar pentru a ataca celulele canceroase dăunătoare ale pacientului reprezintă o clasă revoluționară de terapii pentru tratarea cancerului.