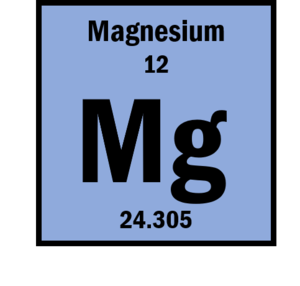
Magneziul este al 12-lea element din tabelul periodic al elementelor și este al optulea cel mai abundent element din scoarța terestră. Unele dintre proprietățile sale sunt enumerate mai jos:
| Greutate atomică | 24,305 | |
| Densitate (la 0oC) | 1.74 g/cm3 | |
| Punctul de fierbere | 1363 K | |
| Punctul de topire | 923 K |
Magneziul este un metal alcalin al Pământului și se găsește în mod natural în roci și minerale.
Magneziul este un element important pentru oameni, animale și plante. Oamenii și animalele au nevoie de el pentru ca multe dintre enzimele lor să funcționeze corect și pentru a menține oasele sănătoase. Plantele conțin magneziu ca moleculă centrală în clorofilă, compusul care face ca plantele să fie verzi.
Utilizări ale magneziului

Magneziul este folosit ca agent de aliere cu alte metale. Este rezistent și ușor, astfel încât îmbunătățește caracteristicile mecanice ale aliajelor fără a crește drastic greutatea. Nu este utilizat ca atare sau în cantități mari în compuși, deoarece are tendința de a se coroda și de a arde. Aliajele de magneziu sunt utilizate în avioane, automobile și în multe bunuri electronice, cum ar fi telefoanele mobile și computerele.
Magneziul pur ars foarte strălucitor și ușor, așa că este folosit în focuri de artificii și rachete de semnalizare (figura 2). În schimb, oxizii și hidroxizii de magneziu sunt folosiți pentru a crește rezistența la căldură și la foc a materialelor plastice și a materialelor de construcție.
Izotopii
Magneziul are trei izotopi care se găsesc în natură:
| Simbol | Abundență naturală |
|---|---|
| 24Mg | 78,99% |
| 25Mg | 10% |
| 26Mg | 11.01% |
Video
Video-ul de mai jos face parte din proiectul de videoclipuri periodice al Universității din Nottingham. Aceștia au creat o suită completă de videoclipuri scurte despre fiecare element din tabelul periodic al elementelor.
Pentru lecturi suplimentare
- Tabloul periodic al elementelor
- Metal
- Alegătură
- Combustie
- Sau explorați o pagină aleatorie
- Realizat intern de către un membru al echipei Energy Education, cu informații de pe periodictable.com, Disponibil: http://periodictable.com/Elements/001/index.html
- 2.0 2.1 2.2 2.2 2.3 Royal Society of Chemistry Periodic Table, Magnesium , Disponibil: http://www.rsc.org/periodic-table/element/12/magnesium
- 3.0 3.1 3.2 John Emsley, „Nature’s Building Blocks: An A-Z Guide to the Elements”, Oxford University Press, New York, ediția a 2-a, 2011.
- Chemistry World, „Podcasts: Magnesium Oxides”, accesat la 8 octombrie 2018, disponibil: https://www.chemistryworld.com/podcasts/magnesium-oxide/7645.article
- Vedeți mai multe videoclipuri de la Universitatea din Nottingham despre diferite elemente aici: http://www.periodicvideos.com/