Manuscript accepted on :29 Aug 19
Published online on:
Published online on: 18-09-2019 Plagiarism Check: Da
Revizuit de:
Revizuită de:
Copiată de: Farooq Sher
Second Review by: Farooq Sher
Second Review by: Grigorios Kyriakopoulos
Aprobare finală de: Grigorios Kyriakopoulos
Aprobare finală de: Grigorios Kyriakopoulos
Aprobare finală de: Grigorios Kyriakopoulos Ayush Dogra
Cum se citeșteînchideți | Istoricul publicăriiînchideți
Vijitra Luang-In1* , Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 și Kedsukon Maneewan1
, Manatchanok Yotchaisarn1, Worachot Saengha1, Piyachat Udomwong2, Sirirat Deeseenthum1 și Kedsukon Maneewan1
1Natural Antioxidant Innovation Research Unit, Departamentul de Biotehnologie, Facultatea de Tehnologie, Universitatea Mahasarakham, Khamriang, Kantarawichai, Maha Sarakham, 44150, Thailanda.
2International College of Digital Innovation, Chiang Mai University, Chiang Mai 50200, Thailanda.
Corresponding Author E-mail: [email protected]
DOI : https://dx.doi.org/10.13005/bpj/1735
Abstract
Acest studiu a avut ca scop izolarea și identificarea bacteriilor care pot produce enzima amilază din pădurea neexplorată Nasinuan Forest, districtul Kantarawichai, provincia Mahasarakham, Thailanda. Treisprezece izolate bacteriene cu capacitate de producere a amilazei pe agar de amidon 1% au fost identificate cu ajutorul secvențierii ARNr 16S. Douăsprezece bacterii au fost gram-pozitive, în formă de bastonaș și au fost identificate ca fiind Bacillus spp. și o bacterie cu caracter gram-negativ și în formă de bastonaș a fost Enterobacter cloacae. Cele mai apropiate rude ale acestora au fost găsite în India, China, Coreea, Indonezia, Argentina, Italia, Israel, SUA, Argentina și Africa de Sud. Aceste bacterii au fost testate pentru activitatea specifică a amilazei după 1-3 zile de inducție enzimatică cu 1% amidon la 37°C. Rezultatele au arătat cea mai mare activitate specifică în ziua 2 de incubație, în ordine: Bacillus cereus 3.5AL2 > 3.4AL1 > 1.4AL3 și, prin urmare, a fost aleasă o inducție enzimatică de 2 zile pentru continuarea analizei. S-a constatat că Bacillus sp. 3.5AL2 a prezentat cea mai mare activitate enzimatică specifică a amilazei, de 1,97 ± 0,41 U/mg de proteină, în condițiile optime de 60°C și pH 7,0, după 30 de minute de incubare cu 1% amidon în tampon PBS 0,05 M. Această tulpină bacteriană producătoare de amilază oferă un mare potențial pentru aplicații în industria alimentară și agricolă din Thailanda.
Cuvintele cheie
Amilază; Bacterii; pădurea Nasinuan; sol
Descărcați acest articol ca:![]()
Copiați următoarele pentru a cita acest articol:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Izolarea și identificarea bacteriilor producătoare de amilază din solul din pădurea comunitară Nasinuan, Maha Sarakham, Thailanda. Biomed Pharmacol J 2019;12 (3).
Copiați următoarele pentru a cita acest URL:
Luang-In V, Yotchaisarn M, Saengha W, Udomwong P, Deeseenthum S, Maneewan K. Izolarea și identificarea bacteriilor producătoare de amilază din solul din pădurea comunitară Nasinuan, Maha Sarakham, Thailanda. Biomed Pharmacol J 2019;12(3). Disponibil la: http://biomedpharmajournal.org/?p=28497
Introducere
Amilazele hidrolitice ale amidonului (α-amilază, β-amilază și glucoamilază) sunt unele dintre cele mai utilizate enzime în biotehnologia actuală. Glucoamilazele (1,4-α-D-glucan glucanohidrolază; EC 3.2.1.3) sau amiloglucozidele, sunt amilaze cu acțiune exoactivă care produc glucoză din capătul nereducător al amidonului și oligozaharidele corespunzătoare. Glucoamilazele sunt puse în aplicare la nivel comercial pentru transformarea malto-oligozaharidelor în glucoză1. Deși amilazele sunt produse din diferite surse (microorganisme, plante și animale), amilazele provenite de la microbi sunt cele mai potrivite pentru producția industrială datorită perioadei scurte de creștere microbiană, producției eficiente la costuri reduse, comportamentului ecologic, manipulării mai puțin problematice pentru lucrători, productivității2 și manipulării ușoare a genelor bacteriene3. Bacteriile și ciupercile au tendința de a secreta amilaze în afara celulelor pentru a realiza digestia extracelulară a amidonului în zaharuri. S-a observat o creștere a cererii industriale de amilaze microbiene datorită specificității reacției lor, a condițiilor blânde necesare pentru reacție și a consumului mai mic de energie decât metodele chimice non-enzimatice convenționale.
Aplicarea extensivă a amilazei în industria alimentară, în lichefierea amidonului, în sacarificare, în industria berii, în industria detergenților, a hârtiei, în industria textilă și în industria distilării, a determinat o atenție sporită pentru creșterea producției indigene de α-amilază4. Bacillus este o sursă bacteriană comună pentru producția industrială de amilază. Cu toate acestea, diferite tulpini au condiții optime de creștere și un profil de producție enzimatică diferite. Conform rapoartelor, tulpinile de Bacillus au fost utilizate pe scară largă la nivel industrial pentru a produce α-amilază, inclusiv B. amyloliquefaciens, B. subtilis5, B. licheniformis6, B. stearothermophilus7, B. megaterium8 și B. circulans9.
Până în prezent, a fost documentat un număr de bacterii producătoare de amilază, cu toate acestea, nu a fost raportat niciun studiu privind bacteriile producătoare de amilază din solul din pădurea comunitară Nasinuan, districtul Kantharawichai, provincia Mahasarakham, Thailanda. Această pădure pare să fie bogată în biodiversitate microbiană care poate fi utilă în producția de enzime industriale, inclusiv amilază. Acesta este primul raport care identifică bacteriile producătoare de amilază izolate din pădurea Nasinuan. În viitor, aceste amilaze bacteriene pot fi aplicate la nivel local în diverse industrii, inclusiv cea a celulozei și hârtiei, a textilelor, a bioetanolului, a fabricării berii, a prelucrării alimentelor, a hranei pentru animale și a agriculturii din Thailanda.
Materiale și metode
Eșantioane de sol
Eșantioanele de sol au fost colectate la întâmplare sub suprafața solului la 15 cm și păstrate în saci de polistiren din pădurea comunitară Nasinuan, districtul Kantarawichai, provincia Mahasarakham, Thailanda (suprafață de 9.6 hectare; coordonate 16.340941, 103.210799).
Isolarea bacteriilor producătoare de amilază
Eșantionul de sol (10 g) a fost suspendat în 90 ml de soluție sterilă de NaCl 0,85%. Suspensiile (100 µL) de diluții seriale au fost întinse pe agar amidon (g/L); 3,0 extract de carne de vită, 10,0 amidon solubil, 15,0 agar pH 7,0 și incubate la 37 ºC timp de 7 zile. Apoi, plăcile au fost inundate cu iod Gram. Toate coloniile cu formarea unei zone clare în jurul coloniilor au fost subcultivate în bulion lichid și strecurate de cel puțin cinci ori pentru a obține izolate pure, așa cum s-a confirmat prin colorare Gram și observare la microscopul optic 1000X. Izolații puri au fost inoculați punctual pe agar amidon și incubați la 37°C timp de 7 zile. Diametrele zonelor clare față de diametrele coloniilor au fost măsurate cu ajutorul unei rigle ca raport Halo : colonie.
Secvențierea genei ARNr16S și analiza filogenetică
Soldații bacterieni puri au fost identificați folosind ADN genomic obținut prin metoda de mai sus și primerii universali: primer înainte 27F 5′-GAGAGAGTTTGATYCTGGCTCTCAG-3′ și primer invers 1492R 5’AAGGAGGTGATCCARCCGCA -3′. În amestecul PCR de 25 µL, acesta a fost compus din ADN genomic 0,5 ng, 2X Master Mix (One PCR) din 100 mM Tris-HCl (pH 9,1), 0,1% TritonTMX-100, 200 mM dNTP, 1,5 mM MgCl2, 0,005 U Taq ADN Polimerază și 0,2 µM de amorsă înainte și inversă, cu ajustarea volumului cu apă fără nucleaze. Termociclatorul PCR (Thermo Scientific Hybaid Px2) a fost programat după cum urmează: (1) denaturare inițială timp de 2 minute la 94 ºC pentru 1 ciclu; (2) denaturare la 94 ºC timp de 45 s; recoacere la 54 ºC timp de 45 s și prelungire la 72 ºC timp de 1 minut pentru 32 de cicluri; (3) prelungire finală la 72 ºC timp de 7 minute. Probele au fost păstrate la 4 ºC până la analiza ulterioară. Produsele PCR ale ARNr 16S (~ 1 500 pb) au fost detectate pe gel de agaroză 0,8%, purificate cu ajutorul kitului de purificare a produselor PCR (Vivantis, Malaezia), trimise la First Base Co. Ltd. (Malaezia) pentru secvențierea ADN. Secvențele genei 16S ARNr au fost apoi comparate cu alte secvențe disponibile în GenBank cu ajutorul programului BLASTN (Basic Local Alignment Search Tools)10. Arborele filogenetic a fost construit folosind metoda Muscle pentru alinierea secvențelor și metoda de maximă verosimilitate folosind MEGA X cu 1 000 de replici ale valorilor bootstrap11. Toate secvențele parțiale de ARNr 16S ale izolatelor noastre producătoare de amilază au fost depuse în baza de date NCBI.
Determinarea activității enzimei amilază
Metoda a urmat metoda Bhaskara et al. (2011)12. Cele trei bacterii cu cel mai mare raport Halo: Colonie au fost alese pentru determinarea activității enzimei amilază. Fiecare izolat a fost subcultivat în bulion lichid de amidon (g/L): 10,0 amidon solubil, 10,0 peptonă, 20,0 extract de drojdie, 0,05 KH2PO4, 0,015 MnCl2.4H2O, 0,25 MgSO4.7H2O, 0,05 CaCl2.2H2O, 0,01 FeSO4.7H2O și incubat la 37 ºC, 150 rpm timp de 1, 2 și 3 zile. Supernatantul limpede (enzima amilază extracelulară brută) a fost obținut după centrifugare la 10 000 g timp de 15 minute la 4 ºC. Extractul brut a fost concentrat cu ajutorul concentratorului de proteine din ultracentrifugă MWCO 10 kDa (Vivaspin, Sartorius, Marea Britanie).
Metoda DNS13 a fost utilizată pentru a determina activitatea amilazică a fiecărui izolat bacterian la fiecare zi de inducție a enzimei. Un ml de enzimă brută a fost amestecat cu 1 ml de soluție de amidon 1% în 1 ml de tampon fosfat de sodiu 0,05 M pH 7,0. Probele au fost incubate la 37°C timp de 30 de minute. După incubare, s-a adăugat 0,5 ml de soluție DNS la fiecare probă pentru a opri reacția și apoi s-a fiert la 100°C timp de 5 minute în baie de apă. Intensitatea de culoare a soluției a fost observată prin măsurarea densității optice (OD) cu ajutorul unui spectrofotometru la 575 nm. Citirea a fost comparată cu o soluție martor preparată (fără enzimă brută). Valorile DO ale probelor la T30min au fost scăzute din cele ale probelor la T0min, deoarece glucoza a rămas încă în probele de la T0min după procesul de inducție enzimatică la 1, 2, 3 zile. Procesul a fost efectuat în triplicat. Concentrația de glucoză produsă pentru fiecare soluție a fost obținută din curba standard de glucoză. S-a calculat activitatea amilazei. O unitate de activitate a amilazei este definită ca fiind cantitatea de amilază necesară pentru a cataliza formarea zahărului reducător, care este egală cu 1 µmol de glucoză pe minut în condițiile de testare14.
Enzima brută a izolatului bacterian care a avut cea mai mare activitate a fost aleasă pentru lucrări ulterioare.
Pentru a determina activitatea enzimatică specifică a izolatelor selectate, s-a folosit metoda Folin-Lowry pentru estimarea proteinelor totale15. Activitatea enzimatică specifică a fost măsurată folosind următoarea formulă.
Activitatea specifică (U/mg) = Activitatea enzimatică (U/ml)/Concentrația de proteină extracelulară (mg/ml)
Ph-ul și temperatura optime pentru activitatea enzimatică a amilazei
S-au testat soluții de amidon solubil (1%) în diferite pH-uri de la 3 la 10. Un ml din diferite soluții de substrat de 1% a fost adăugat împreună cu 1 ml din tampoanele respective; 0,05 M tampon citrat (pH 3 până la 5), 0,05 M tampon fosfat de sodiu (pH 6 și 7), 0,05 M Tris-HCl (pH 8 și 9) și 0,05 M glicină NaOH (pH 10). În aceste tampoane s-a adăugat, de asemenea, un ml de enzimă brută. Probele au fost incubate la 37°C timp de 30 de minute. S-a calculat activitatea specifică a amilazei. S-a notat pH-ul la care s-a observat cea mai mare activitate. De asemenea, s-au preparat diferite soluții de substrat prin dizolvarea amidonului solubil 1% în soluții cu pH 7,0. Un ml de amidon solubil 1% a fost adăugat împreună cu 1 ml de tampon fosfat de sodiu 0,05 M (pH 7). În tampoane s-a adăugat, de asemenea, un ml de enzimă brută. Probele au fost incubate la 20, 30, 40, 50, 60, 70 și 80°C timp de 30 de minute. S-a calculat activitatea specifică a amilazei. S-a notat temperatura la care s-a observat cea mai mare activitate. Atât pH-ul cât și temperatura optimă au fost folosite pentru a determina activitatea enzimatică specifică finală a amilazei.
Analiză statistică
Analysis of Variance (One-way ANOVA) a fost folosită cu testul Duncan Multiple Range’s Test pe SPSS Statistics Ver. 17.0. Rezultatele au fost exprimate ca medii ± SD cu diferență statistică atunci când p < 0,05.
Rezultate
Isolarea bacteriilor producătoare de amilază
În acest studiu, 13 izolate pozitive la amilază au prezentat zone clare pe agar amidon 1% cu diferite rapoarte Halo : Colonie. Coloniile care au prezentat zone clare la soluția de iod au fost considerate colonii bacteriene pozitive la degradarea amidonului. Toate izolatele bacteriene au prezentat morfologii de colonii similare și au apărut ca bacterii Gram-pozitive și în formă de tijă (tabelul 1). Rezultatul a arătat un raport Halo : colonie variind de la 1,18 la 1,71 (tabelul 1). Izolatele bacteriene au fost apoi folosite pentru a determina durata optimă de inducție a enzimei amilază și doar cele 3 izolate cu cele mai mari activități specifice au fost prezentate în 3.4.
Identificarea tulpinilor de bacterii producătoare de amilază
Toate cele 13 tulpini bacteriene pozitive la amilază au fost supuse secvențierii genei 16S ARNr pentru identificarea tulpinii. Rezultatele BLAST au arătat că toate izolatele pozitive la amilază aparțin genului Bacillus, cu excepția unui izolat aparținând genului Enterobacter (tabelul 2). Cele mai apropiate rude ale acestora au fost găsite în India, China, Coreea, Indonezia, Argentina, Italia, Israel, SUA, Argentina și Africa de Sud, cu un interval de identitate de 96-100%.
Analiză filogenetică
Arborele filogenetic al celor 13 tulpini bacteriene pozitive la amilază și al celor 2 tulpini de referință cu enzime amilazice putative folosind MEGA 7.0 a arătat că E. cloacae 2.1AL2 a fost diferit din punct de vedere evolutiv de celelalte tulpini Bacillus (Fig. 1). Tulpina de referință B. thuringiensis serovar konkukian (nr. de acces NCBI AB617494.1) a evoluat diferit față de bacteriile noastre Bacillus. Cu toate acestea, o altă tulpină de referință B. cereus ATCC 14579 (nr. de acces NCBI MG708176.1) izolată din frunze de șofrănel, Eqypt a prezentat o evoluție similară cu cea a bacteriilor noastre (Fig. 1).
 |
Tabel 1: Caracteristici și raporturi Halo : Colony ratios of 13 amylase-producing bacterial strains
Click here to View table |
Durata optimă de inducere a enzimei amilază
A fost demonstrat că durata de incubare care a indus producția de amilază cu cea mai mare activitate specifică a fost de 2-3 zile la toate cele 3 izolate, fără diferențe statistice. Bacillus sp. 3.5AL2 a părut să producă cea mai mare activitate specifică de 0,91 ± 0,12 U/mg în ziua 2 la 37°C (tabelul 3). Astfel, această tulpină și această condiție au fost folosite pentru inducerea producției de amilază pentru analize ulterioare.
Ph și temperatură optime pentru activitatea enzimatică a amilazei
Bacillus sp. 3.5AL2 a prezentat cea mai mare activitate specifică la pH 7,0 când a fost fixată la 37°C și la 60°C când a fost fixată la pH 7,0 (Fig. 2). Astfel, ambele condiții optime au fost folosite pentru a determina activitatea specifică a amilazei și s-a obținut 1,97 ± 0,41 U/mg (tabelul 4).
Tabel 2: Treisprezece tulpini bacteriene pozitive la amilază identificate prin analiza ARNr 16S
| Isolat | Nr. de accesiune
. a |
Cea mai apropiată rudăb | Nr. de accesiunec | % Identitated | Origine | |
| 1.1AL1 | MK578206 | Bacillus pseudomycoides FJAT-hcl-17 | KY653098.1 | 99% | Host Paris polyphylla var. chinensis, China | |
| 1.1AL2 | MK578207 | Bacillus sp. 188Cu-As | KM349197.1 | 99% | Biofilme, Argentina | |
| 1.2AL3 | MK578208 | Bacillus anthracis SAK4 | MG706137.1 | 100% | Sol, Republica Coreea | |
| 1.4AL1 | MK578209 | Bacillus sp. CNJ732 PL04 | DQ448749.1 | 99% | Sediment marin, SUA | |
| 1.4AL3 | MK578210 | Bacillus cereus B19 | MK229038.1 | 99% | Grâu de grâu, Isarael | |
| 2.1AL2 | MK578211 | Enterobacter cloacae HNXY160623 | KX431213.1 | 98% | Embrion de pasăre, China | |
| 2.3AL1 | MK578212 | Bacillus thuringiensis BD17-E12 | HF584771.1 | 99% | Sistemul radicular al rapiței, Italia | |
| 2.3AL8 | MK578213 | Bacillus cereus DFT-1 | KY750685.1 | 98% | Apă de mare din zona industrială, Indonezia | |
| 2.3AL9 | MK578214 | Bacillus sp. PTP1 | KY910137.1 | 96% | Intestin de melc de papaya, India | |
| 2.4AL2 | MK578215 | Bacillus pseudomycoides 74 | MH910178.1 | 99% | India | |
| 3.2AL1 | MK578216 | Bacillus thuringiensis
IARI-IIWP-38 |
KF054891.1 | 99% | Rizospere de grâu, India | |
| 3.4AL1 | MK578217 | Bacillus cereus F4a | MK088302.1 | 99% | Sol din rizosfera ceaiului, India | |
| 3.5AL2 | MK578218 | Bacillus cereus SP1-AB4 | MH013307.1 | 99% | Burete marin, Africa de Sud |
aNr. de acces la GenBank. al tulpinilor noastre depuse pe site-ul NCBI (http://www.ncbi.nlm.nih.gov/pubmed)
bSpecia cea mai apropiată cu cel mai mare % de identitate și cel mai mare scor Max la căutarea BLAST
cGenBank accession no. al tulpinilor celor mai apropiate rude de pe site-ul NCBI
Bazat pe rezultatele căutării BLAST, identitatea (%) tulpinilor în comparație cu cele mai apropiate rude
.
eBazat pe rezultatele căutării BLAST, originea celor mai apropiate rude.
| Figura 1: Arbore filogenetic al celor 13 tulpini bacteriene pozitive la amilază și 2 tulpini de referință Bacillus | Figura 1: Arbore filogenetic al celor 13 tulpini bacteriene pozitive la amilază și al celor 2 tulpini de referință Bacillus | Figura 1: Arbore filogenetic al celor 13 tulpini bacteriene pozitive la amilază și 2 tulpini de referință Bacillus
Click here to View figure |
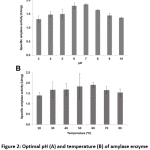 |
Figura 2: pH-ul (A) și temperatura (B) optime ale activității enzimei amilază de la Bacillus sp. 3.5AL2
Click aici pentru a vedea figura |
Tabelul 3: Durata optimă de inducție a enzimei amilazei
|
Isolat |
Amilaza specifică activitate
(U/mg proteină) |
||
| 24 h | 48 h | 72 h | |
| Bacillus sp. 1.1AL2 | 0,21 ± 0,04Ab | 0,40 ± 0,04Ca | 0,41 ± 0,04Ba |
| B. cereus 2.3AL8 | 0,45 ± 0,06Ab | 0,62 ± 0,04Ba | 0,65 ± 0,06Aa |
| Bacillus sp. 3.5AL2 | 0,32 ± 0,11Ab | 0,91 ± 0,12Aa | 0,86 ± 0,11Aa |
Valorile sunt medii ± SD în triplicat.
Literele majuscule și minuscule indică diferențe statistice (p < 0,05) în coloană și, respectiv, rând.
Tabelul 4: Activitatea enzimatică specifică a amilazei la pH și temperatură optime
| Strain | Activitate (U/mg) | Temperatura optimă. (°C) | Ph-ul optim |
| Bacillus sp. 3.5AL2 | 1,97 ± 0,41 | 60 | 7.0 |
Discuție
Datele vamale thailandeze (2017) au arătat că Thailanda a importat enzime industriale din alte țări cu o valoare de 2,625 milioane de bahți în 2016, iar rata de import a crescut cu 9,40% pe an. Una dintre enzimele cele mai utilizate pe scară largă în Thailanda, amilaza, a fost aplicată în industria confecțiilor, industria textilă și industria alimentară. Cu toate acestea, există o lipsă de producție locală de amilază comercială și, prin urmare, această lucrare a avut ca scop izolarea bacteriilor din sol din pădurile locale cu capacitatea de a produce amilază pentru utilizări industriale.
Reziduurile bogate în amidon pot fi o sursă potențială mai bună în care pot fi izolate bacteriile pozitive la amilază16. În plus, acestea ar putea fi izolate din locuri precum fermele de manioc, solul și fabricile de prelucrare a făinii17. În această lucrare, 13 bacterii producătoare de amilază au fost izolate și identificate ca fiind Bacillus spp. și Enterobacter sp. ceea ce este similar cu rapoartele anterioare18, 19, 20 în care Bacillus spp. au fost găsite în cea mai mare parte ca producători de amilază.
Rezultatele noastre au arătat că Bacillus sp. 3.5AL2, izolatul cu cea mai mare activitate specifică dintre cele 13 izolate, a produs cea mai mare activitate specifică de 0,91 ± 0,12 U/mg la o incubare de 2 zile la 37°C. pH-ul și temperatura optime pentru activitatea amilazei au fost de 7,0 și, respectiv, 60°C. Ambele condiții optime au dat o activitate specifică a amilazei din Bacillus sp. 3.5AL2 de 1,97 ± 0,41 U/mg. Este cunoscut faptul că enzimele care pot funcționa la temperaturi ridicate sunt considerate ca având un avantaj în procesele industriale, cum ar fi lichefierea amidonului21. Astfel, amilaza din Bacillus sp. 3.5AL2 are o potențială utilizare în astfel de industrii.
În mod similar, Bacillus sp. GM890 a prezentat temperatura optimă pentru amilază la 60°C20, Bacillus licheniformis AI20 prezintă cea mai mare activitate între 60-80°C22 și Bacillus sp. WA21 a avut o temperatură optimă mai mică de 55°C pentru amilază19.
Majoritatea tulpinilor bacteriene care degradează amidonul au arătat un interval de pH între 6,0 și 7,0 pentru o creștere normală și o activitate enzimatică4. De asemenea, în această lucrare, Bacillus sp. 3.5AL2 a avut un pH optim de 7,0, care nu necesită adaos de acid sau alcalin. Descoperirea noastră a fost în concordanță cu Bacillus sp. izolat din deșeuri din industria dhal care prezintă o temperatură optimă de 60°C23 și B. amyloliquefaciens cu un pH optim de 7,024. Cu toate acestea, Bacillus sp. WA21 a prezentat pH-ul optim al amilazei la 6,0, care este mai mic decât cel constatat în acest studiu19.
Acest tip de studiu este foarte important pentru punctul de plecare al producției comerciale de amilază în Thailanda. Cu toate acestea, investigații suplimentare de cercetare sunt esențiale pentru ca producția de amilază să fie rentabilă. Este nevoie de o caracterizare amănunțită a enzimei, de o determinare suplimentară a termostabilității, a stabilității pH-ului, a influenței diferiților ioni metalici și a diferitelor substraturi, în special a deșeurilor agricole din Thailanda, și a concentrațiilor acestora.
După obținerea tuturor datelor necesare, așa cum s-a menționat mai sus, se crede că producția de amilază comercială în industriile enzimatice din Thailanda va fi în creștere și răspândită în fiecare regiune și, la rândul său, va fi benefică pentru economia țării datorită autosuficienței propriilor resurse pentru a produce enzima amilază.
Concluzie
Acesta este primul raport de identificare a 13 izolate bacteriene producătoare de amilază din solul din pădurea comunitară Nasinuan, Maha Sarakham. Toate bacteriile au fost identificate ca fiind Bacillus spp. cu excepția uneia din genul Enterobacter. Aceste bacterii pot fi utilizate pentru producerea de amilază și pot fi aplicate la nivel local și național în agricultură, industria alimentară și industria textilă în viitor. Astfel, acest lucru va reduce costul de import al enzimelor industriale din alte țări, va oferi durabilitatea producției locale de enzime și va spori economia națiunii.
Recunoștințe
Autorii doresc să mulțumească Universității Mahasarakham (Grant Year 2018) pentru sprijinul financiar acordat lui SD, și Facultății de Tehnologie, Universitatea Mahasarakham (Grant Year 2017) acordat lui VL.
Conflict of Interest
Autorii declară că nu există conflicte de interese.
- Pandey A. Glucoamylase research: O privire de ansamblu. 47:439-445 (1995).
- Burhan A.I., Nisa U., Gokhan C., Omer C., Ashabil A. și Osman G. Proprietățile enzimatice ale unei noi amilaze termostabile, termofile, alcaline și rezistente la chelator de la un izolat de Bacillus alkalifilic ANT-6. Process Biochem. 38: 1397-1403 (2003).
- Gurung N., Ray S., Bose S., and Rai, V.A. Broader view: Enzimele microbiene și relevanța lor în industrie, medicină și nu numai. Biomed Res Internat. 1-18. doi:10.1155/2013/ 329121 (2013).
- Gupta R., Gigras P., Mohapatra H., Goswami V.K., și Chauhan B. Microbial α-amylases: a biotechnological perspective. Process Biochem. 38:1599-1616 (2003).
- Takasaki Y. O amilază producătoare de maltoetaroză și de maltopentoză din circulans. Agric Biol Chem. 47:2193-2199 (1983).
- Fogarty W.M., and Kelly C.T. Amylase, amyloglucosidase and related glucanases. Rose A.H. Economic Microbiology, Microbial Enzymes and Bioconversion, New York Academic Press Inc, vol. 5. Pp. 115-170 (1980).
- Wind R.D., Buitelaar R.M.G., Huizing H.J., and Dijkhuizen L. Characterization of a new Bacillus stearothermophilus isolate: a highly thermostable α-amylase producing strain. Appl. microbiol Biotechnol. 41:155-162 (1994).
- Brumm P.J., Hebeda R.E., and Teague W.M. Purification & characterization of commercialized, cloned megaterium megaterium α-amylase. Partea I: purificare & proprietăți hidrolitice. Amidon. 43:319-323 (1991).
- Takasaki Y. O amilază producătoare de maltotrioză din subtilis. Agric Bio. Chem. 49:1091-1097 (1985).
- Lowry O.H., Rosebrough N.J., and Randall R.J. Protein measurement with the folin phenol reagents. J Biol Chem. 193: 265-275 (1951).
- Altschul S.F., Gish W., Miller W., Myers E.W., and Lipman D.J. Basic local alignment search tool. J Mol 215:403-410 (1990).
- Bhaskara R.K.V., Ashwini K., Gaurav K., și Karthik L. Optimizarea, producerea și purificarea parțială a α-amilazei extracelulare din Bacillus marini. Arc Appl Sci Res. 3:33-42 (2011).
- GhoseK. Măsurarea activităților celulozei. Pure Appl Chem. 59: 257-268 (1987).
- Haq U.I., Ashraf H., Iqbal J. și Qadeer M.A. Producția de α-amilază de către Bacillus licheniformis folosind un mediu economic. Biores Technol. 87:57-61 (2003).
- Mishra S., și Behera N. Activitatea amilazei din bacteriile care degradează amidonul este izolată din solul care primește deșeuri de bucătărie. Afr J Biotechnol. 7: 3326-3331 (2008).
- Fossi B.T., Taveaand F., și Ndjonenkeu T. Production and Partial Characterization of a Themostable amylase from Ascomycetes yeast strain isolated from stropii de drojdie Ascomycetes din soluri cu amidon. Afr J Biotechnol. 4:14-18 (2005).
- Cordeiro C.A.M. Production and propertiesof α-amylase from thermophilic Bacillus sp. Brazil J Microbiol. 33:57-61 (2002).
- Asad W. Extracellular enzyme production by indigenous thermophilic bacteria: Purificarea și caracterizarea parțială a α-amilazei de către Bacillus sp. WA21. Pakistan J Botany. 43:1045-1052 (2011).
- Kim T.U. Purificarea și caracterizarea unei α-amilaze alcaline formatoare de maltotetrază de la o tulpină de Bacillus alcalofilă, GM8901. Appl Envin Microbiol. 61: 83105-3112 (1995).
- Sivaramakrishnan S., Gangadharan D., Madhavan K.N., and Pandey A. Solid culturing of Bacillus amyloliquefaciens for alpha amylase production. Food Technol 44:269-274 (2006).
- Abdel-Fattah Y.R., Soliman N.A., El-Toukhy N.M., El-Gendi H., and Ahmed R.S. Purification, and characterization of thermostable α-amylase produced by Bacillus licheniformis isolate AI20. J Chem. 2013:1-11 (2013).
- Thippeswamy S., Girigowda K., and Mulimani V.H. Izolarea și identificarea Bacillusului producător de α-amilază din deșeurile industriei Dhal
. Indian J Biochem Biophysics. 43: 295-298 (2006). - Abd-ElhalemT., El-Sawy M., Rawia F.G., and Khadiga A.A.T. Production of amylase from Bacillus amyloliquefaciens under submerged fermentation using some agro-industrialby-products. Ann Agri Sci. 60:193-202 (2015).
- Tamura K., and Nei M. Estimation of the number of nucleotide substitutions in the control region of mitochondrial DNA in humans and chimpanzees. Mol Biol Evol. 10:512-526 (1993).

(vizitat de 12.737 ori, 21 vizite astăzi)