Introducere
Proteinele beta-amiloid și tau fosforilate sunt semnele patologice ale bolii Alzheimer (AD) care se acumulează și se răspândesc în mod previzibil prin rețelele neuronale distribuite, provocând anomalii metabolice progresive, leziuni neuronale și moarte celulară. Neuroimagistica facilitează o evaluare detaliată a acestor modificări patologice la pacienții supuși unui bilanț pentru declin cognitiv. Anterior, diagnosticul definitiv al DA era posibil doar prin observarea postmortem și stadializarea neuroanatomică a acestor agregate proteice. Cu toate acestea, progresele recente în imagistica moleculară permit vizualizarea depozitelor de amiloid și tau în creierul uman viu și ne-au adus mai aproape de un diagnostic definitiv in vivo al bolii Alzheimer.
Imagistică structurală
Legitimările Academiei Americane de Neurologie (AAN) pentru diagnosticarea persoanelor cu afecțiuni cognitive1 recomandă imagistica cerebrală structurală cu CT sau RMN fără contrast la orice persoană cu antecedente clinice pozitive și modificări cognitive obiective. În acest context, rolul principal al imagisticii cerebrale este de a exclude leziunile structurale nedegenerative, 5% dintre acestea putând să nu fie evidente din istoricul clinic sau examenul fizic2 și care sunt potențial tratabile. AAN recomandă, de asemenea, excluderea clinică a demenței vasculare (VaD), a demenței cu corpi Lewy (DLB) și a demenței frontotemporale (FTD). Imagistica structurală poate îmbunătăți certitudinea diagnosticului și modifică diagnosticul clinic în 19% până la 28%, precum și managementul a 15% din cazurile clinice.2
Modalitățile imagistice de elecție atunci când se evaluează atrofia structurală sunt CT și RMN. Modelele de atrofie specifice bolii au fost descrise în detaliu și validate cu ajutorul acestor modalități. Deși atrofia este observabilă la CT, rezoluția spațială inerentă mai mică și contrastul inferior substanță cenușie/substanță albă duc la pierderea unor observații subtile potențial utile în ceea ce privește modificările neurodegenerative. Prin urmare, clinicienii se bazează adesea pe IRM pentru a evalua modelul și severitatea modificărilor structurale, pentru a exclude cauzele non-neurodegenerative ale declinului cognitiv și pentru a evalua severitatea și amploarea modificărilor materiei albe, așa cum se discută mai detaliat mai jos.
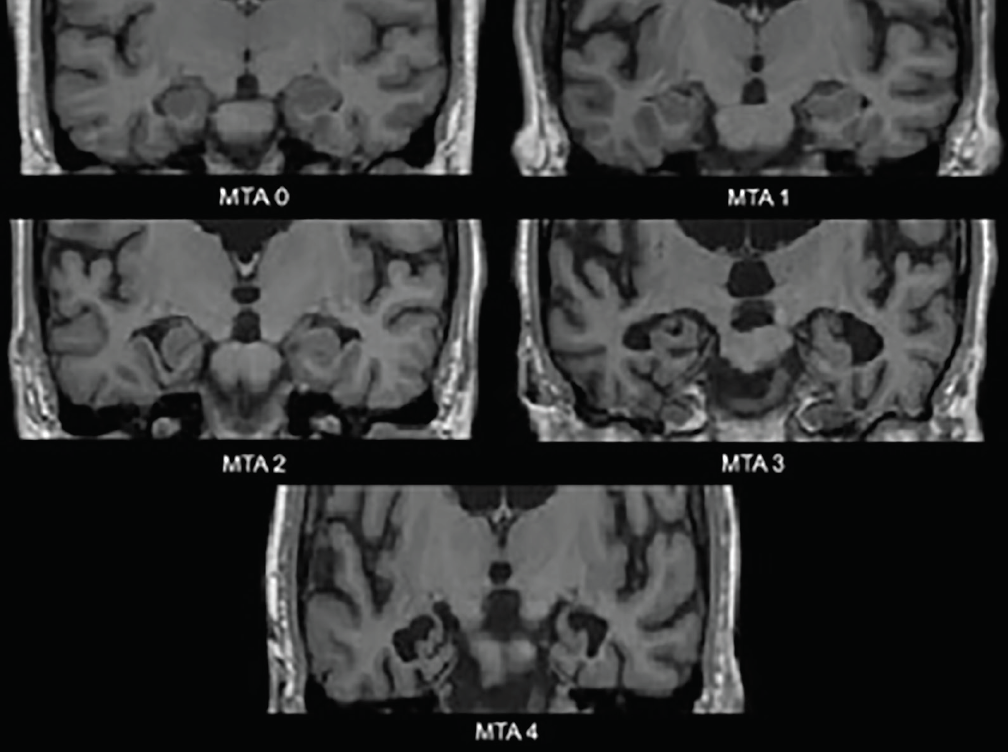
Cele mai timpurii modificări neurodegenerative în DA apar în lobii temporali mediali – hipocampul, cortexul entorinal și girusul parahipocampal. Pe măsură ce se instalează atrofia, fisura coroidă și cornul temporal al ventriculului lateral se dilată; aceste modificări sunt cel mai bine evaluate în plan coronal. O scală de evaluare vizuală utilizată în mod obișnuit, bazată pe aceste structuri – scala de atrofie temporală medială (MTA) (figura 1) – a fost validată clinic3 și neuropatologic4. Diferite studii care utilizează această scală sau structurile pe care le evaluează au demonstrat o capacitate semnificativă de a discrimina persoanele cu AD de controalele de vârstă corespunzătoare4 sau de cele cu DLB4 sau cu tulburări cognitive vasculare (VCI).5 Atrofia temporală medială este, de asemenea, predictivă pentru conversia de la tulburări cognitive ușoare amnezice (MCI) la demența Alzheimer.3
Click to view larger
Figură 1. Ratingurile scalei atrofiei temporale mediale (MTA). MTA 0-nu există niciun decalaj sau un decalaj minim al fisurii coroidei; MTA 1- lărgire subtilă a fisurii coroidei; MTA 2- lărgire mai mare a fisurii coroidei care se unește cu cornul temporal al ventriculului lateral, scădere ușoară a înălțimii formațiunii hipocampale; MTA 3-scădere moderată a înălțimii formațiunii hipocampale, mărire proeminentă a cornului temporal al ventriculului lateral; MTA 4-scădere severă a înălțimii formațiunii hipocampale, mărire proeminentă a cornului temporal al ventriculului lateral.
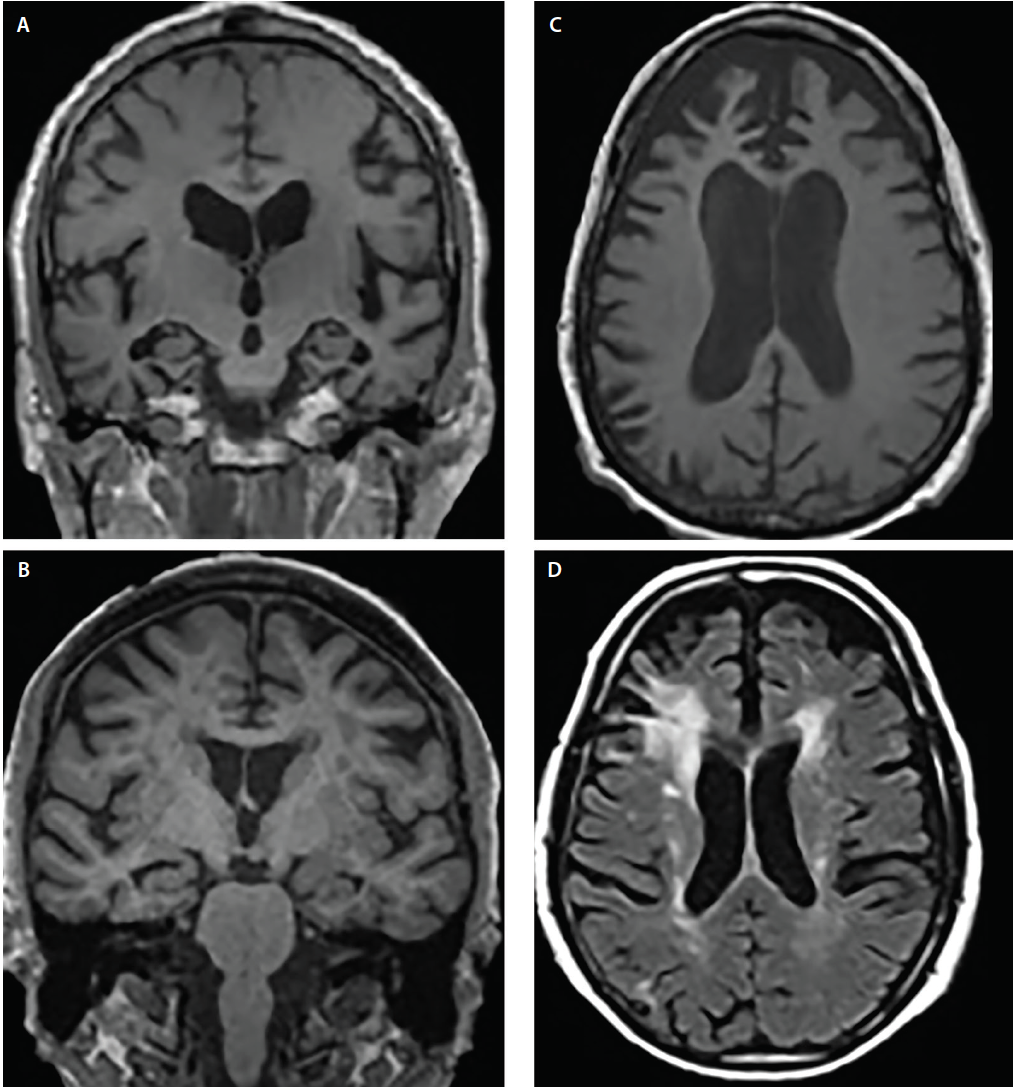
Sindroamele de demență prezintă de obicei modele canonice de atrofie6 care corespund cu simptomele cognitive și comportamentale; cu toate acestea, structurile implicate se pot suprapune. De exemplu, atât AD cât și DLB prezintă o implicare a lobului temporal medial, dar mai multe studii imagistice și neuropatologice au arătat că, în raport cu AD, DLB are o predilecție semnificativ mai mică pentru structurile temporale mediale4,5 (figura 2).
Click to view larger
Figură 2. Modele de atrofie structurală în boala Alzheimer (AD) (A), demența cu corpi Lewy (DLB) (B), demența frontotemporală (FTD) (C) și demența vasculară (VaD) (D). RMN-ul coronal ponderat T1 demonstrează o atrofie corticală generalizată, dar grade diferite de atrofie hipocampală în AD (A) și DLB (B). Rezonanța magnetică axială ponderată în T1 demonstrează atrofie în cazul DvFTD cu o predilecție focală pentru cortexul prefrontal medial și lateral (C). IRM axială ponderată în T2 demonstrează hipointensități confluente ale materiei albe cu capac periventricular și halo (WMH) care implică corona radiata și se extind în neocortexul prefrontal lateral, WMH ușoare dispersate și WMH ale mucoasei ventriculare subependimale și ale septum pellucidum în VaD (D).
Atât DA cât și degenerescența lobară frontotemporală (FTLD) au regiuni de atrofie suprapuse, incluzând zone ale cortexului prefrontal, orbitofrontal și insular anterior, precum și ale lobilor temporali anterior și medial.6 Totuși, în raport unul față de celălalt, DA prezintă semnificativ mai multă atrofie în cortexurile parietal lateral și occipital, în timp ce FTLD prezintă mai multă atrofie în lobii frontali (Figura 2).6
Este important să se evalueze sistematic toate zonele cerebrale, observând regiunile de atrofie structurală și de conservare anatomică pentru a utiliza la maximum imagistica de diagnostic. Un studiu amplu, multicentric, a evaluat recent capacitatea a 6 scale de evaluare vizuală de a clasifica corect 186 de cazuri confirmate patologic de AD, DLB și FTLD.6 Acest studiu a arătat că evaluarea simultană a mai multor regiuni specifice bolii a oferit o discriminare semnificativ mai bună decât concentrarea asupra unei singure zone.4
Deteriorarea vasculară este un aspect important atunci când se evaluează persoanele cu tulburări cognitive. Modificările ischemice sunt frecvente în îmbătrânirea normală și sunt accelerate de comorbiditățile comune (de exemplu, hipertensiune arterială, diabet și hipercolesterolemie). Contribuțiile vasculare la afectarea cognitivă sunt adesea deduse atunci când sunt detectate hiperintensități semnificative ale substanței albe (WMH), accidente vasculare cerebrale corticale sau lacune localizate strategic pe secvențe ponderate T2 sau secvențe de recuperare a inversiei atenuate de fluid (FLAIR). Accidentele vasculare cerebrale lacunare ale ganglionilor bazali și WMH în centrum semiovale și corona radiata sunt indicatori ai leziunilor ischemice cronice ale vaselor mici (figura 2). În schimb, capacele periventriculare sunt adesea de origine non-ischemică și reflectă glioza subependimală.7 Există mai multe scale de severitate a WMH (de exemplu, scala Fazekas)7 care pot fi utilizate în mediul clinic. Astfel de algoritmi de scorare sunt toți de acord că WMH confluente răspândite și infarctele lacunare subcorticale sunt, cel puțin în parte, susceptibile de a fi factori care contribuie la declinul cognitiv.7
Imagistica tensorială de difuzie (DTI) este o nouă secvență IRM sensibilă la difuzia apei prin țesuturi care evaluează integritatea substanței albe, deoarece arhitectura axonilor constrânge fluxul de apă. Măsurătorile difuzivității medii și anizotropiei fracționate sunt adesea utilizate pentru a caracteriza modificările neurodegenerative pe DTI. Prima măsoară magnitudinea difuziei, iar cea de-a doua măsoară dacă apa curge în mod preferențial într-o singură direcție, așa cum este de așteptat în axonii sănătoși. Scăderea difuzivității medii și reducerea anizotropiei fracționare au fost raportate în mod constant atât la populațiile cu MCI, cât și la cele cu demență AD.8 Mai multe studii au identificat, de asemenea, modificări DTI la persoanele asimptomatice cu risc de a dezvolta AD9 , indicând faptul că aceste modificări apar la începutul evoluției bolii. În plus față de evaluarea integrității materiei albe, DTI poate fi utilizată pentru a modela conectivitatea structurală brută între regiunile corticale utilizând algoritmi de tractografie. Acest lucru a câștigat tracțiune în domeniul DA, deoarece dovezile sugerează că patologia amiloidă și tau se poate propaga prin intermediul conexiunilor cerebrale.10 Deși DTI prezintă potențial ca măsură a integrității materiei albe, sensibilitatea sa la mișcare și alte constrângeri tehnice, limitează, cel puțin pentru moment, aplicarea sa clinică.
Imagistică funcțională
Hipometabolismul cerebral este ușor de observat în tulburările neurodegenerative și poate ajuta la diagnosticul diferențial. Funcția neuronală este dependentă de oxigenul și glucoza din sânge, a căror livrare este facilitată de vasodilatația regională. Tomografia cu emisie de pozitroni cu 18F-fluorodeoxiglucoză (FDG-PET) reflectă indirect gradul de activitate corticală și poate fi utilizată cu ușurință pentru a vizualiza modificările neurodegenerative prin exploatarea acestei dependențe metabolice de glucoză.
Semnătura corticală hipometabolică caracteristică a bolii Alzheimer constă în modificări timpurii în cortexul cingular posterior (PCC); precuneus; cortexul temporal, parietal și, în stadii ulterioare, cortexul frontal. Acest model se manifestă timpuriu, chiar presimptomatic,11 și este util din punct de vedere clinic pentru a distinge AD de FTD.12 Spre deosebire de AD, semnătura metabolică a FTD relevă hipometabolism frontal, temporal anterior, ganglionar bazal și talamic, cu o relativă menajare a corticelor de asociere posterioare.13 În situații incerte din punct de vedere clinic, clinicienii pot folosi aceste semnături metabolice pentru a dezambiguiza AD de FTD.12 În mod similar, deși semnătura metabolică neocorticală a DLB poate avea o suprapunere confuză cu cea a AD, cazurile de DLB pot prezenta, de asemenea, hipometabolism occipital.14
Center for Medicare & Medicaid Services consideră că FDG-PET este „rezonabil și necesar” doar pentru cei care îndeplinesc criteriile atât pentru AD, cât și pentru FTD, la care un bilanț complet de diagnostic conform ghidurilor AAN1 nu a stabilit definitiv o etiologie.15
MRI funcțional (fMRI) poate, de asemenea, să măsoare activitatea cerebrală prin utilizarea unor secvențe care sunt sensibile la modificările temporale ale hemoglobinei oxigenate/deoxigenate datorate activității cerebrale. În acest fel, fMRI este înrudit cu FDG-PET, deoarece modificările hemoglobinei sunt determinate de metabolismul glucozei necesar pentru activitatea cerebrală. Dependențele temporale dintre regiuni pot fi utilizate pentru a deduce conectivitatea funcțională (adică, ce regiuni comunică în mod activ). Comparativ cu FDG-PET, fMRI oferă o rezoluție spațială îmbunătățită, permițând o cartografiere mai precisă a conectivității. Un alt avantaj al fMRI este că poate fi achiziționat în timpul îndeplinirii unei sarcini sau în repaus. Prima identifică modelele de conectivitate determinate de stări active specifice, în timp ce cea de-a doua identifică modelele de conectivitate prezente în repaus, cunoscute sub numele de rețea de mod implicit (DMN). DMN este definită de noduri funcționale, PCC și precuneus, care se conectează la un subsistem medial dorsal și la un subsistem temporal medial.16 Se crede că depunerea amiloidului începe în nodurile funcționale ale DMN. Se știe că DMN este afectat în AD.16 În schimb, DMN este cruțat în FTD, în timp ce rețelele de saliență sau de atenție sunt afectate.17 În prezent, tehnologia fMRI este limitată la aplicațiile de cercetare, dar sunt explorate în mod activ căi de dezvoltare a unor algoritmi relevanți aplicabili clinic.
Imagistică moleculară
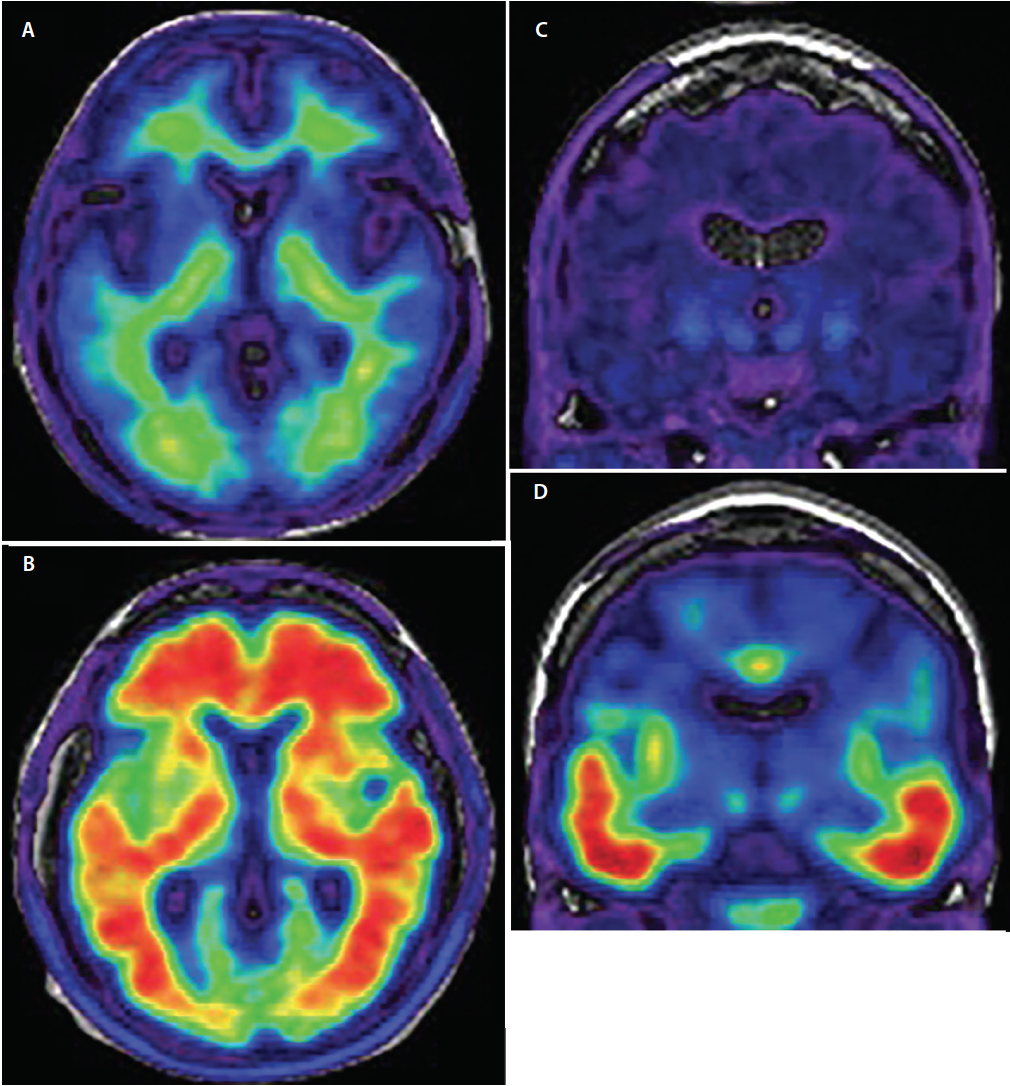
Standardul criteriu pentru un diagnostic definitiv de AD este examinarea neuropatologică postmortem a creierului. Chiar și în mâinile unor experți experimentați în demență, diagnosticul clinic al DA atinge doar o sensibilitate tulburătoare de 70,9% până la 87,3% și o specificitate de 44,3% până la 70,8%.18 Cel mai relevant pentru îmbunătățirea acurateței diagnosticului clinic al DA a fost dezvoltarea de trasori radiomarcați pentru imagistica PET cu afinitate specifică pentru agregatele ß-amiloid și tau fosforilate legate de DA (figura 3), care permit demonstrarea in vivo a neuropatologiei subiacente (tabel), odată posibilă doar postmortem.
Click to view larger
Figura 3. Amiloid-PET axială demonstrând scanări amiloide negative (A) și amiloide pozitive (B). În imaginile cu amiloid negativ (A), semnalul radiotrasorului prezintă o intensitate scăzută și este limitat la legarea nespecifică a substanței albe. Joncțiunea materie cenușie/materie albă este păstrată. În imaginile pozitive la amiloid (B), semnalul radiotrasorului are o intensitate ridicată și se extinde difuz în regiunile corticale ale materiei cenușii, ascunzând joncțiunea materie cenușie/materie albă. Tau-PET coronal demonstrând scanări Tau negative (C) și Tau pozitive (D). În scanările tau negative există un semnal radiotrasor minim, nespecific, de intensitate scăzută în regiunile temporale mediale, ale creierului anterior bazal și ale ganglionilor bazali. În scanările tau-pozitive (D) semnalul radiotrasorului este de intensitate mai mare și implică cortexul temporal inferior și lateral, urmând traiectoria cunoscută de progresie a încurcăturilor neurofibrilare.
Tomografia cu emisie de pozitroni a amiloidului
Tomografia cu emisie de pozitroni a amiloidului și, mai recent, imagistica tau au revoluționat capacitatea noastră de a vizualiza patologia AD chiar și în stadii presimptomatice.19 Tractorii de imagistică PET amiloidică sunt valabili și de încredere pentru detectarea in vivo a patologiei DA în diferite stadii ale bolii. Acești trasori imagistici se leagă de motive conformaționale specifice ale proteinei amiloide și au ca rezultat o absorbție a trasorului care este strâns corelată cu depunerea de amiloid postmortem.20
În comparație cu tau, patologia amiloidă începe într-un model regional distribuit mai difuz, răspândindu-se de la porțiunile bazale ale lobilor frontali, temporali și occipitali până la zonele de asociere neocorticală dorsală, cu implicarea doar în stadii tardive a corticelor senzoriale și motorii primare.21 Cele mai notabile zone de captare a trasorului sunt cortexurile frontal, parietal și temporal lateral (figura 3), cu o captare de 1,5 până la 2 ori mai mare la persoanele cu AD față de grupurile de control22 sau la cele cu alte demențe.23
Imaginile PET cu amiloid sunt evaluate pentru captarea trasorului cortical în zonele caracteristice de distribuție a amiloidului din AD. Scanările pozitive arată pierderea distincției materie cenușie/materie albă pe măsură ce absorbția de trasor se extinde în neocortex. Scanările negative păstrează distincția materie cenușie/materie albă, arătând doar legarea în afara țintei în materia albă.24 Tiparele imagistice Amyloid PET pot prezice în mod fiabil declinul cognitiv atât la persoanele sănătoase, cât și la cele cu MCI.20
18F-florbetapir, 18F-florbetaben și 18F-flutemetamol sunt aprobate de Food and Drug Administration (FDA) pentru utilizare clinică.20 Cu toate acestea, transportatorii de asigurări nu au îmbrățișat această tehnologie, din cauza cheltuielilor și a riscului de utilizare clinică excesivă în absența unor terapii de modificare a bolii și a unui cost-beneficiu stabilit. O meta-analiză a raportat o sensibilitate de 95% și o specificitate de 57% a unei scanări PET amiloidice pozitive pentru a prezice conversia de la MCI la AD.25
Relația incertă dintre cost, risc și beneficiu a dus la dezvoltarea unor criterii de utilizare adecvată a imagisticii amiloidice, atribuind necesitatea evaluării PET amiloidice persoanelor cu MCI inexplicabilă, prezentări atipice ale AD și demență cu debut precoce.26 Experții au identificat, de asemenea, indicații nepotrivite pentru imagistica amiloidiană care includ evaluarea de sine stătătoare pentru preocupări cognitive înainte de un bilanț clinic, cognitiv, de laborator și de neuroimagistică structurală amănunțit; în absența unei afectări cognitive obiective; în cazul unei probabilități ridicate de DA (adică în absența unei echipolente clinice); și pentru stadializarea severității demenței.
Studiul Imaging dementia-evidence for amyloid scanning (IDEAS) – un studiu în curs de desfășurare al Center for Medicare and Medicaid Services – validează în prezent criteriile de utilizare adecvată și evaluează impactul statutului amiloid determinat prin PET asupra managementului bolii și a rezultatelor pe termen lung pentru beneficiarii Medicare cu MCI sau cu prezentări atipice. O analiză intermediară a arătat că integrarea PET amiloid în bilanțul clinic a dus la modificări ale managementului bolii la 60,2% dintre persoanele cu MCI și la 63,5% dintre cele cu demență.27 Rezultatele pe termen lung sunt încă în curs de determinare.
Tau Tomografia cu emisie de pozitroni
Tau este a doua proteină care se depune în creierul celor cu AD. În prezent, sunt în curs de dezvoltare trackere de imagistică prin PET Tau, care se arată deja promițătoare. La fel ca în cazul amiloidului PET, trasorii Tau PET vizează anumite motive conformaționale ale tau fosforilat. Specificitatea markerilor tau a fost validată post-mortem28 , iar semnalul tau PET observat se potrivește îndeaproape cu distribuția anatomică a încurcăturilor neurofibrilare utilizate în prezent pentru diagnosticul neuropatologic al bolii Alzheimer.29 Cele mai timpurii stadii ale patologiei tau care pot fi vizualizate cu ajutorul imagisticii tau PET sunt depozitele de încurcături neurofibrilare din cortexul entorinal și hipocampus. Apoi, depozitele de tau devin detectabile în cortexul temporal inferior și lateral (figura 3), urmate de cortexul parietal și occipital și, în cele din urmă, de cortexul frontal, conform etapizării patologice bine stabilite de Braak și Braak a depunerilor de tau prin creier.21 Tractorii tau nu sunt lipsiți de limitări de diagnostic și sunt în curs de dezvoltare pentru a le defini mai bine rolul clinic. Cu toate acestea, având în vedere că legarea trasorului tau se modifică dinamic pe parcursul întregii evoluții clinice a bolii Alzheimer, această modalitate de imagistică va juca probabil un rol semnificativ în stadializarea severității bolii in vivo.30
Direcții viitoare
Datorită faptului că patologia AD poate fi detectată cu ușurință cu până la 20 de ani înainte de diagnosticul de demență19 și urmează o distribuție în etape previzibilă, cercetarea se concentrează acum pe detectarea precoce presimptomatică și pe îmbunătățirea acurateței diagnosticului prin utilizarea biomarkerilor (Tabelul).31 Un cadru de cercetare propus pentru amiloid-tau-neurodegenerare (ATN), axat pe detectarea a 3 modificări ale biomarkerilor în creier, prognozează relevanța clinică a imagisticii multimodale.31 Sistemul de clasificare ATN este agnostic față de sindroamele clinice și surprinde întregul spectru de boli neurodegenerative prin prisma biomarkerilor DA. În urma dezvoltării și perfecționării ulterioare, se așteaptă ca ATN, prin clasificarea obiectivă in vivo a biomarkerilor, să îmbunătățească în mod dramatic acuratețea diagnosticului clinic și să sporească calitatea îngrijirii.
Concluzie
Neuroimagistica oferă informații unice despre etiologia care stă la baza tulburărilor cognitive și facilitează îndrumarea pacienților și a familiilor printr-o experiență temătoare și incertă. Toate bolile neurodegenerative prezintă o heterogenitate clinică semnificativă și, înainte de cele mai recente progrese ale imagisticii moleculare, niciuna nu putea fi diagnosticată definitiv înainte de deces. Tehnologia modernă de imagistică a creierului este capabilă să detecteze o multitudine de epifenomene care reflectă neuropatologia subiacentă, dintre care unele sunt destul de apropiate de sursa bolii. Cel mai sigur diagnostic clinic se bazează în prezent pe o integrare a istoricului clinic, a observațiilor medicului, a examinării fizice, a bilanțului medical, a testelor neuropsihologice și a interpretării în cunoștință de cauză a diagnosticului neuroimagistic. Pe măsură ce biomarkerii ATN sunt rafinați în continuare, diagnosticele clinice vor fi făcute mai devreme și mai definitiv la pacienții în viață, se vor baza mai puțin pe clasificarea simptomelor și vor oferi oportunități pentru intervenții terapeutice mai timpurii care pot modifica traiectoria bolii neurodegenerative.
1. Knopman DS, DeKosky ST, Cummings JL, et al. Practice parameter: diagnosis of dementia (an evidence-based review). Raport al Subcomitetului pentru standarde de calitate al Academiei Americane de Neurologie. Neurologie. 2001;56(9):1143-1153.
2. Chui H, Zhang Q. Evaluation of dementia: a systematic study of the usefulness of the American Academy of Neurology’s practice parameters (Evaluarea demenței: un studiu sistematic al utilității parametrilor de practică ai Academiei Americane de Neurologie). Neurologie. 1997;49(4):925-935.
3. Apostolova LG, Thompson PM, Green AE, et al. 3D comparison of low, intermediate, and advanced hippocampal atrophy in MCI. Hum Brain Mapp. 2010;31(5):786-797.
4. Harper L, Fumagalli GG, Barkhof F, et al. MRI visual rating scales in the diagnosis of dementia: evaluation in 184 post-mortem confirmed cases. Brain. 2016;139(Pt 4):1211-1225.
5. Burton EJ, Barber R, Mukaetova-Ladinska EB, et al. Atrofia lobului temporal medial pe IRM diferențiază boala Alzheimer de demența cu corpi Lewy și de afectarea cognitivă vasculară: un studiu prospectiv cu verificarea patologică a diagnosticului. Brain. 2009;132(Pt 1):195-203.
6. Harper L, Bouwman F, Burton EJ, et al. Patterns of atrophy in pathologically confirmed dementias: a voxelwise analysis (Modele de atrofie în demențele confirmate patologic: o analiză voxelwise). J Neurol Neurosurg Psychiatry. 2017;88(11):908-916.
7. Fazekas F, Kleinert R, Offenbacher H, et al. Pathologic correlates of incidental MRI white matter signal hyperintensities. Neurologie. 1993;43(9):1683-1689.
8. Huang J, Friedland RP, Auchus AP. Imagistica tensorului de difuzie a materiei albe cu aspect normal în cazul tulburărilor cognitive ușoare și al bolii Alzheimer precoce: dovezi preliminare de degenerare axonală în lobul temporal. AJNR Am J Neuroradiol. 2007;28(10):1943-1948.
9. Selnes P, Fjell AM, Gjerstad L, et al. Modificări imagistice ale materiei albe în afectarea cognitivă subiectivă și ușoară. Alzheimers Dement. 2012;8(5 Suppl):S112-S121.
10. Jacobs HIL, Hedden T, Schultz AP, et al. Modificările tractului structural prezic acumularea de tau în aval la persoanele în vârstă amiloid-pozitive. Nat Neurosci. 2018;21(3):424-431.
11. Apostolova LG, Thompson PM, Rogers SA, et al. Cartografierea ghidată de caracteristici de suprafață a modificărilor metabolice cerebrale la vârstnicii normali din punct de vedere cognitiv și ușor afectați. Mol Imaging Biol. 2010;12(2):218-224.
12. Foster NL, Heidebrink JL, Clark CM, et al. FDG-PET îmbunătățește precizia în distingerea demenței frontotemporale și a bolii Alzheimer. Brain. 2007;130(Pt 10):2616-2635.
13. Ishii K, Sakamoto S, Sasaki M, et al. Metabolismul glucozei cerebrale la pacienții cu demență frontotemporală. J Nucl Med. 1998;39(11):1875-1878.
14. Mosconi L, Tsui WH, Herholz K, et al. Diagnosticul standardizat multicentric 18F-FDG PET al tulburărilor cognitive ușoare, al bolii Alzheimer și al altor demențe. J Nucl Med. 2008;49(3):390-398.
15 . Centrele pentru Medicare & Medicaid Serivces. Decision Memo for Positron Emission Tomography (FDG) and Other Neuroimaging Devices for Suspected Dementia (CAG-00088R)https://www.cms.gov/medicare-coverage-database/details/nca-decision-memo.aspx?NCAId=104. Accesat la 4 mai 2019.
16. Buckner RL, Sepulcre J, Talukdar T, et al. Hub-uri corticale dezvăluite de conectivitatea funcțională intrinsecă: cartografiere, evaluare a stabilității și relația cu boala Alzheimer. J Neurosci. 2009;29(6):1860-1873.
17. Seeley WW, Crawford RK, Zhou J, Miller BL, Greicius MD. Bolile neurodegenerative vizează rețelele cerebrale umane la scară largă. Neuron. 2009;62(1):42-52.
18. Beach TG, Monsell SE, Phillips LE, Kukull W. Precizia diagnosticului clinic al bolii Alzheimer la Centrele de boli Alzheimer ale Institutului Național pentru Îmbătrânire, 2005-2010. J Neuropathol Exp Neurol. 2012;71(4):266-273.
19. Jagust W. Imaging the evolution and pathophysiology of Alzheimer disease. Nat Rev Neurosci. 2018;19(11):687-700.
20. Rice L, Bisdas S. Valoarea diagnostică a FDG și amiloid PET în boala Alzheimer – o revizuire sistematică. Eur J Radiol. 2017;94:16-24.
21. Braak H, Braak E. Etapizarea neuropatologică a modificărilor legate de Alzheimer. Acta Neuropathol. 1991;82(4):239-259.
22. Klunk WE, Engler H, Nordberg A, et al. Imaging brain amyloid in Alzheimer’s disease with Pittsburgh Compound-B. Ann Neurol. 2004;55(3):306-319.
23. Ossenkoppele R, Jansen WJ, Rabinovici GD, et al. Prevalența pozitivității amiloidului PET în sindroamele de demență: o meta-analiză. JAMA. 2015;313(19):1939-1949.
24. Minoshima S, Drzezga AE, Barthel H, et al. SNMMI procedure standard/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0. (Standard de procedură SNMMI/EANM Practice Guideline for Amyloid PET Imaging of the Brain 1.0.). J Nucl Med. 2016;57(8):1316-1322.
25. Ma Y, Zhang S, Zhang S, Li J, et al. Precizia predictivă a imagisticii amiloide pentru progresia de la tulburări cognitive ușoare la boala Alzheimer cu diferite durate de urmărire: o meta-analiză. . Medicine (Baltimore). 2014;93(27):e150.
26. Johnson KA, Minoshima S, Bohnen NI, et al. Criterii de utilizare adecvată pentru PET amiloid: un raport al Grupului de lucru pentru imagistică amiloidă, al Societății de medicină nucleară și imagistică moleculară și al Asociației Alzheimer. Alzheimers Dement. 2013;9(1):e1-e16.
27. Rabinovici GD, Gatsonis C, Apgar C, et al. Asocierea tomografiei cu emisie de pozitroni amiloidiană cu schimbarea ulterioară a managementului clinic în rândul beneficiarilor de asigurări medicale cu deficiență cognitivă ușoară sau demență. JAMA. 2019;321(13):1286-1294.
28. Aguero C, Dhaynaut M, Normandin MD, et al. Validarea autoradiografică a noului trasor Tau PET -MK-6240 pe țesutul cerebral uman postmortem. Acta Neuropathol Commun. 2019;7(1):37.
29. Chien DT, Bahri S, Szardenings AK, et al. Rezultatele inițiale ale imagisticii clinice PET cu noul radioligand PHF-tau -T807. J Alzheimers Dis. 2013;34(2):457-468.
30. Wang L, Benzinger TL, Su Y, et al. Evaluarea imagisticii tau în stadializarea bolii Alzheimer și dezvăluirea interacțiunilor dintre beta-amiloid și tauopatie. JAMA Neurol. 2016;73(9):1070-1077.
31. Jack CR, Jr., Bennett DA, Blennow K, et al. Cadrul de cercetare NIA-AA: Toward a biological definition of Alzheimer’s disease (Către o definiție biologică a bolii Alzheimer). Alzheimers Dement. 2018;14(4):535-562.
MRA și DS nu raportează nicio dezvăluire.
LGA a servit ca membru al consiliului consultativ pentru Eli Lilly.