- Introducere
- Materiale și metode
- Criterii de includere
- Stimulare ovariană și prelevare de ovocite
- Politică de transfer embrionar
- Măsurători ale rezultatelor primare și analiză statistică
- Rezultate
- Parametrii ovocitelor și embrionilor
- Rezultatele sarcinii și rata cumulativă a nașterilor vii (CLBR)
- Discuție
- Concluzie
- Disponibilitatea datelor
- Declarație etică
- Contribuții ale autorilor
- Finanțare
- Declarație privind conflictul de interese
- Recunoștințe
Introducere
Recent, un nou sistem, criteriile POSEIDON, a fost dezvoltat pentru a clasifica pacienții cu infertilitate cu prognostic scăzut care urmează un tratament cu tehnologie de reproducere asistată (ART) (1). Acesta este un sistem util pentru identificarea și clasificarea pacientelor cu rezervă ovariană deficitară sau răspuns ovarian slab (POR), oferind îndrumare pentru diagnosticul și managementul acestor paciente (2). Au fost sugerate patru subseturi pe baza unor parametri cantitativi și calitativi, inclusiv vârsta, biomarkerii rezervei ovariene și răspunsul ovarian. Noile criterii, prin introducerea unei stratificări mai detaliate a POR, au redus în mod semnificativ eterogenitatea pacientelor care îndeplinesc criteriile de la Bologna (3), ceea ce ar putea diferenția subgrupe de paciente din cadrul populației POR care ar putea fi identificate și ar putea beneficia de intervenții specifice (4). Deși au fost stabilite criteriile POSEIDON, împreună cu unele recomandări de tratament specifice propuse pentru subgrupurile specifice de paciente (5), rămân încă insuficiente dovezi care să susțină validitatea parametrilor utilizați în criteriile POSEIDON, precum și evaluarea rezultatelor diferitelor subgrupuri.
Printre cele patru grupuri bazate pe criteriile POSEIDON, grupul 1 este, fără îndoială, cel mai bun grup de prognostic, având în vedere vârsta lor mai tânără și rezerva ovariană normală, în timp ce grupul 4 are cel mai prost prognostic din cauza vârstei avansate și a rezervei ovariene diminuate. Cu toate acestea, o întrebare interesantă este cine ar obține un rezultat de sarcină mai bun, femeile în vârstă (grupul 2) cu rezervă ovariană normală sau femeile tinere (grupul 3) cu rezervă ovariană diminuată. Rata cumulativă a nașterilor vii (CLBR) este considerată o măsură preferabilă a succesului tratamentului FIV (6). Până în prezent, au existat foarte puține rapoarte privind CLBR ale celor patru grupuri de paciente definite de criteriile POSEIDON.
Caracteristicile și prognosticul pacientelor ar trebui să fie utilizate pentru a dezvolta strategii de management clinic. Obiectivul acestui studiu este de a caracteriza pacienții cu prognostic scăzut pentru a facilita luarea deciziilor de tratament. În acest studiu, au fost analizate caracteristicile de bază și rezultatele grupurilor de pacienți definite prin criteriile POSEIDON, iar CLBR rezultată în urma unui ciclu aspirat de fertilizare in vitro (FIV)/injecție intracitoplasmatică de spermatozoizi (ICSI) a fost propusă ca măsură primară a rezultatelor pentru pacienții cu prognostic scăzut care urmează un tratament FIV (7).
Materiale și metode
Acest studiu retrospectiv a inclus 18.455 de cicluri FIV proaspăt aspirate cu transferuri ulterioare de embrioni congelați din ianuarie 2014 până în ianuarie 2017 în centrul nostru. Rezultatul nașterii vii a fost urmărit timp de cel puțin 2 ani, până în ianuarie 2019. Studiul a fost aprobat de Comitetul de etică pentru aplicarea clinică a tehnologiei de reproducere umană asistată a Spitalului de femei și copii din nord-vest (nr. 2018002). Comitetul de etică a aprobat acest studiu a renunțat la necesitatea de a obține consimțământul informat. Toate cercetările au fost efectuate în conformitate cu liniile directoare și reglementările relevante.
Criterii de includere
Pacienții au fost clasificați în conformitate cu criteriile POSEIDON:
Pacienți cu prognostic scăzut
Grupa 1 (n = 879 cicluri): Vârsta < 35 ani, număr de foliculi antrali (AFC) ≥ 5, număr de ovocite prelevate ≤ 9 în ciclul anterior;
Grupa 2 (n = 482 cicluri): Vârsta ≥ 35 ani, AFC≥5, numărul anterior de ovocite recuperate ≤ 9 în ciclul anterior;
Grupa 3 (n = 858 cicluri): Vârsta < 35 ani, AFC < 5;
Grupa 4 (n = 1.306 cicluri): Vârsta ≥ 35 ani, AFC < 5;
Pacienți fără prognostic scăzut
Grupa 5 (n = 664 cicluri): AFC ≥ 5, stimulare ovariană anterioară > 9 ovocite;
Grupa 6 (n = 13708 cicluri): AFC ≥ 5, fără stimulare ovariană anterioară.
Graficul de flux și procedura de procesare a datelor sunt prezentate în figura 1. Datele demografice și caracteristicile bazale ale pacientelor sunt prezentate în tabelul 1.
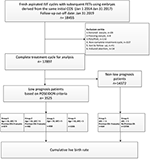
Figura 1. Diagrama de flux și procesare a datelor.
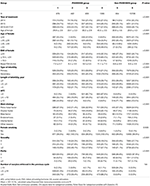
Tabelul 1. Date demografice și caracteristici de bază.
Stimulare ovariană și prelevare de ovocite
Protocolul de stimulare ovariană (OS) a fost stabilit individual în funcție de vârsta femeii, indicele de masă corporală (IMC), hormonul de stimulare foliculară (FSH) bazal și numărul de foliculi antrali (AFC). 94,33% dintre pacientele FIV au primit gonadotrofine recombinante și/sau urinare (rFSH/hMG) în protocolul cu agonist GnRH sau în protocolul cu antagonist GnRH urmat de FIV sau ICSI. Pentru femeile cu rezervă ovariană diminuată, s-a utilizat protocolul de stimulare ușoară sau stimularea ovariană în faza luteală sau ciclul natural. Gonadotrofina umană menopauzală (hMG, Li Zhu, China) a fost adăugată în protocolul de ovulație ușoară sau în protocolul Shanghai în funcție de răspunsul pacientelor la stimulare. Gonadotrofina corionică umană (hCG) 4.000-10.000 UI sau hCG recombinantă (r-hCG, MerckSerono S.p.A.) 250μg a fost administrată atunci când 2-3 foliculi au atins dimensiunea de 17 mm sau mai mare. Treizeci și șase de ore mai târziu, s-a efectuat prelevarea de ovocite cu ajutorul aspirației ghidate prin ultrasonografie transvaginală. Parametrii de stimulare ovariană ai fiecărui grup sunt enumerați în tabelul 2.

Tabel 2. Parametrii de stimulare ovariană.
Politică de transfer embrionar
Procedurile de procesare a ovocitelor și de dezvoltare embrionară, precum și sistemul de notare a embrionilor au fost descrise în articolele noastre anterioare (8, 9). Embrionii de gradul 1-3 în ziua 3 au fost considerați embrioni utilizabili, iar embrionii de gradul 1-2 au fost considerați embrioni de bună calitate. Toate transferurile de embrioni proaspeți (ET) au fost efectuate în ziua 3 sau în ziua 5. În cazurile cu un număr suficient (≥ 3-4) de embrioni de bună calitate în ziua 3, s-ar fi practicat transferul de blastocist în ziua 5. În afară de embrionii transferați, embrionii suplimentari ai pacientelor au fost vitrificați în ziua 3 sau în stadiul de blastocist (ziua 5-6). Embrionii în stadiul de clivaj de gradul 1-3 în ziua 3 și blastocistele cu scor Gardner peste 4CC au fost crioprezervate (Cryo-top, sistem deschis, Kuwayama). Metodele și procedura Frozen ET sunt detaliate în studiul anterior de verificare realizat de echipa noastră (8, 9). În cazul în care implantarea a eșuat în ciclul proaspăt, transferul de embrioni congelați-dezghețați (FET) ar fi fost efectuat utilizând embrionii sau blastocistele vitrificate rămase. Pacientele cu vârsta sub 35 de ani cu embrioni de bună calitate au fost încurajate să beneficieze de un transfer de un singur embrion. O politică de transfer de un singur embrion a fost aplicată, de asemenea, pentru pacientele care au uterul anormal (de exemplu, uter cicatrizat, malformație uterină) și/sau alte cazuri care intră în conflict cu sarcina gemelară. Injecția intramusculară de progesteron (60 mg/zi) a fost administrată pentru susținerea fazei luteale din ziua prelevării ovocitelor până la o beta-hCG serică negativă sau până la 8 săptămâni de sarcină.
Măsurători ale rezultatelor primare și analiză statistică
Rezultatul primar a fost nașterea vie cumulativă (CLB) definită ca fiind cel puțin o naștere vie rezultată în urma unui ciclu ART aspirat în ET proaspătă sau în FET ulterioară în raport cu numărul de ovocite prelevate. Numitorul calculului CLBR a fost suma nașterilor vii obținute în FET și a nașterilor vii în ciclurile proaspete. Doar prima naștere a fost luată în considerare în analiză în cazul în care o pacientă a obținut mai multe nașteri. CLBR a fost definită ca fiind nașterea vie cumulată per aspirație transvaginală de ovocite în conformitate cu definiția terminologică (7, 10) Un ciclu de tratament a fost definit ca o prelevare de ovocite. Un ciclu de tratament complet s-a referit la un ciclu de tratament care a atins nașterea vie sau la un ciclu de tratament care nu a reușit să atingă nașterea vie cu toți embrionii transferați. Rata cumulativă a nașterilor vii din acest studiu a fost calculată pe baza ciclului de tratament complet, astfel încât au fost excluse pacientele (n = 337) cu tratament incomplet.
Procesarea datelor și analiza statistică au fost efectuate cu ajutorul software-ului EmpowerStats (www.empowerstats.com) și a pachetelor software statistice R. Pentru a evalua raportul de probabilitate (OR) al CLBR în diferite grupuri de pacienți, a fost stabilit un model de regresie cu variabile multiple, având ca variabile factorii potențiali de confuzie și ajustat pentru anul de tratament, IMC feminin, tipul de infertilitate, durata infertilității, gravitatea, paritatea, etiologia principală, protocolul OS, tipul de gonadotrofină și doza inițială de FSH. Pacienții au fost înrolați timp de 3 ani, timp în care procedura FIV a fost revizuită. Pentru a elimina părtinirea cauzată de acest factor, rata cumulativă a nașterilor vii a fost ajustată pentru anul de tratament. IMC-ul feminin, tipul de infertilitate, durata infertilității, gravitatea, paritatea și etiologia principală au fost factori importanți care au afectat sarcina și nașterea vie prin experiență sau literatură. Protocolul OS, tipul de gonadotrofină și doza inițială de FSH sunt indicatorii cheie pentru a afecta numărul de ovocite prelevate și, în cele din urmă, șansa cumulativă de nașteri vii.
Rezultate
Parametrii ovocitelor și embrionilor

Tabelul 3. Parametrii ovocitelor și embrionilor și CLBR.
Rezultatele sarcinii și rata cumulativă a nașterilor vii (CLBR)
În concordanță cu modelul de distribuție a numărului de ovocite și embrioni pe grupe, CLBR în ordinea de la cea mai mare la cea mai mică a fost de 44.6% în grupul 1(n = 879), 35,5% în grupul 3(n = 858), 24,5% în grupul 2 (n = 482) și 12,7% în grupul 4 (n = 1306). S-a efectuat o analiză de regresie cu variabile multiple cu variabile care pot acționa ca factori de confuzie descrise în tabelele 1, 2. Raporturile de probabilitate (OR) ajustate ale CLBR cu intervalele de încredere (IC) de 95% ale acestora au fost prezentate în tabelul 4. În concordanță cu tendința rezultatelor neajustate, CLBR în grupul 3 (OR 0,9, IC 95% 0,7-1,2, p = 0,615) a fost ușor mai mică, iar grupul 5 (OR 1,3, IC 95% 0,9-1,7, p = 0,111) a fost ușor mai mare decât CLBR în grupul 1, fără diferențe statistice semnificative. CLBR în grupul 2 a fost semnificativ mai mică decât în grupul 1 (OR 0,6, IC 95% 0,4-0,8, p = 0,004), iar CLBR în grupul 4 a fost cea mai mică (OR 0,4, IC 95% 0,3-0,6, p < 0,001) în comparație cu grupul 1. Tabelul 5 a prezentat rezultatele de sarcină per transfer proaspăt sau FET la pacientele cu prognostic scăzut. Ratele de implantare în grupurile vârstnice (grupul 2 și grupul 4) au fost semnificativ mai mici decât în grupurile tinere (grupul 1 și grupul 3).

Tabel 4. Analiza de regresie logistică pentru CLBR.

Tabel 5. Rezultatele sarcinii per transfer atât pentru transferul de embrioni proaspeți cât și pentru transferul de embrioni congelați la pacientele cu prognostic scăzut.
Figura 2 a prezentat graficul de tendințe al evenimentelor cheie la pacientele cu prognostic scăzut. A existat o încrucișare a liniilor de tendință între grupul 2 și grupul 3 după transferul de embrioni. Pacientele din grupul 2 (vârstă ≥35; AFC ≥ 5) au avut o AFC mai mare, mai multe ovocite prelevate, mai mulți embrioni și mai mulți embrioni de bună calitate, dar o rată de implantare și o CLBR scăzute. Dimpotrivă, deși pacientele din grupul 3 (vârsta < 35; AFC < 5) au avut mai puține ovocite și embrioni, CLBR s-a dovedit a fi mai mare decât cea din grupul 2. Analiza SWOT a celor 4 grupuri de paciente cu prognostic scăzut, definite după criteriile POSEIDON, este prezentată în figura 3.
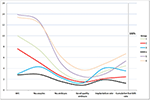
Figura 2. Diagrama de evoluție a evenimentelor cheie la pacienții cu prognostic scăzut. A existat o încrucișare a liniilor de tendință între grupul 2 (roșu) și grupul 3 (albastru) după transferul de embrioni. Axa X reprezintă numărul mediu de AFC, numărul de ovocite, numărul de embrioni, numărul de embrioni de bună calitate, rata de implantare și rata de nașteri vii cumulate. Axa Y din stânga reprezintă numărul primelor patru variabile (n), iar axa Y din dreapta reprezintă rata ultimelor două variabile (%).

Figura 3. Analiza SWOT a celor 4 grupe de pacienți cu prognostic scăzut definite prin criteriile POSEIDON.
Discuție
Principala constatare a acestui studiu retrospectiv în populația definită prin criteriile POSEIDON a fost că CLBR a fost cea mai mare în grupa 1, urmată de grupa 3 și grupa 2, și cea mai mică în grupa 4. Conform rezultatelor noastre, CLBR de la femeile tinere cu rezervă ovariană slabă (grupul 3) a fost ușor mai mică decât cea de la femeile tinere cu rezervă ovariană bună și răspuns scăzut anterior (grupul 1). Deși pacientele din grupul 2 (vârstă ≥ 35 de ani; AFC ≥ 5) au avut o rezervă ovariană mai bună, mai multe ovocite și mai mulți embrioni, CLBR și rata de implantare, pe de altă parte, au fost mai mici decât la pacientele din grupul 3 cu rezervă ovariană mai slabă, mai puține ovocite și mai puțini embrioni. Această constatare poate facilita dezvoltarea strategiilor de management pentru pacientele cu prognostic scăzut.
Criteriile inovatoare POSEIDON au ca scop identificarea și stratificarea pacientelor cu prognostic scăzut în patru grupe distincte, pe baza vârstei feminine, a AFC și a răspunsului ovarian în ciclul anterior (4). Pacientele din grupul 2 s-au caracterizat prin rezervă ovariană bună și vârstă avansată, exact opusul pacientelor din grupul 3, cu rezervă ovariană slabă, dar care sunt la o vârstă mai tânără. Studiile (11-13) au arătat că CLBR crește odată cu numărul de ovocite prelevate chiar și la femeile de vârstă avansată (14). S-a sugerat că numărul de ovocite prelevate este o variabilă foarte importantă asociată independent cu CLBR. Era de așteptat ca pacientele din grupul 2 cu un număr mai mare de ovocite să aibă un prognostic mai bun decât pacientele din grupul 3, deoarece pacientele din grupul 2 au avut mai mulți embrioni de transferat. Cu toate acestea, CLBR și rata de implantare au fost invers mai mari în grupul 2 decât în grupul 3.
Rezultatele noastre sunt în concordanță cu studiile anterioare (15, 16) privind asocierea dintre rezerva ovariană și rezultatul sarcinii. Chang și colab. (15) au constatat că au existat rate mai scăzute de fertilizare normală, clivaj, embrioni de înaltă calitate, implantare și sarcină la femeile mai în vârstă decât la femeile mai tinere cu rezervă ovariană diminuată. Motivul principal a fost impactul negativ al ovocitelor îmbătrânite asupra rezultatului sarcinii (rată scăzută de implantare și rată ridicată de pierdere a sarcinii) din cauza anomaliilor cromozomiale (17) și a disfuncției citoplasmatice (18). Scăderea fertilității odată cu îmbătrânirea implică atât cantitatea, cât și calitatea ovocitelor. Implantarea și avortul spontan sunt legate de calitatea ovocitelor, dar nu neapărat de rezerva ovariană (16). Rezerva ovariană echitabilă în grupul 2 ar crește posibilitatea de a obține mai multe ovocite și embrioni pentru transfer, dar, în același timp, rata mai mare de aneuploidie ar duce la o rată scăzută de implantare și la o rată ridicată de avort spontan.
În ceea ce privește managementul pacientelor din grupa 2, ar trebui să se acorde mai multă atenție dezvoltării strategiilor de îmbunătățire a calității ovocitelor, mai degrabă decât a cantității de ovocite sau a cantității de embrioni. Deoarece se obțin mai mulți embrioni în ziua 3 în grupul 2, cultivarea embrionilor până la stadiul de blastocist pentru transfer este o opțiune bună. Embrionii din ziua 5-6 au o rată mai mică de aneuploidie segmentară (19) și o viabilitate mai mare pentru implantare (20) decât embrionii din ziua 2-3. Testele genetice preimplantaționale pentru aneuploidii (PGT-A) sunt, de asemenea, benefice pentru femeile în stadiu avansat pentru a selecta un embrion euploid pentru transfer (21). Un regim optim de stimulare ovariană pentru a îmbunătăți calitatea ovocitelor (22, 23) ar putea fi o opțiune alternativă. Suplimente, cum ar fi dehidroepiandrosteronul, au fost încercate pentru a îmbunătăți dezvoltarea foliculilor (24), deși nu există dovezi suficiente pentru a susține utilizarea lor la aceste paciente.
Pacientele din grupul 3 (vârsta < 35; AFC < 5) au avut o rezervă ovariană slabă, care se așteptau la un răspuns slab, cu un rezultat slab al sarcinii. În mod interesant, rata de producere a ovocitelor (145,3 % ovocite prelevate per AFC) în grupul 3 a fost semnificativ mai mare decât în celelalte grupuri, deși doza inițială de FSH nu a fost semnificativ crescută (tabelul 2). Acest lucru a sugerat că răspunsul foliculilor antrali la gonadotropină ar fi putut ajunge la limita capacității sale, prin urmare, nu va exista niciun beneficiu suplimentar în ceea ce privește numărul de ovocite pentru a crește în continuare dozele zilnice de gonadotropină (25). Evaluarea sensibilității ovarelor la FSH este un element cheie pentru a îmbunătăți ratele de succes FIV la aceste paciente cu prognostic scăzut și pentru a deschide noi perspective de tratament (26). Rata ridicată de producere a ovocitelor per AFC în grupul 3 a susținut, de asemenea, recomandarea raportată de doză zilnică maximă de 300 UI de rFSH (5). Pentru pacientele din grupul 3, mai multe eforturi ar trebui să se concentreze pe creșterea numărului de ovocite, deoarece rezultatul clinic al sarcinii este reasigurat odată ce sunt dobândite ovocite.
Pacientele din grupul 5 au fost pacientele fără prognostic scăzut care au avut un răspuns ovarian bun (mai mult de 9 ovocite la prelevarea anterioară), cu toate acestea, majoritatea acestor paciente nu au reușit să nască vii în ciclul FIV anterior. Comparând cu o altă pacientă cu prognostic non-job cu primul tratament FIV (grupul 6), deși pacientele din grupul 5 au mai multe AFC și număr de ovocite prelevate, dezvoltarea embrionară și rezultatul sarcinii au fost inferioare celor din grupul 6. Prin urmare, eșecul la primele paciente FIV cu răspuns ovarian bun poate fi prognosticul slab pentru tratamentul FIV ulterior.
Factorul pelvi-tubal este cea mai frecventă cauză de infertilitate, reprezentând aproximativ 10,8-78,3% din femeile infertile din China (27, 28). Factorul tubar implică în principal ocluzia tubară și patologia peritoneală care provoacă aderențe, care a fost diagnosticată prin histerosalpingografie și laparoscopie. Cauza prevalentă a infertilității cu factor tubar a fost atribuită bolii inflamatorii pelvine (PID), salpingitei și endometriozei (29). În grupurile de pacienți din acest studiu, factorul tubar este principala etiologie a infertilității, variind între 62,9 și 71,4%, ceea ce a fost mai mare decât la femeile infertile din alte țări și regiuni. Prin urmare, ar trebui să se acorde atenție la interpretarea implicațiilor mai largi ale constatărilor.
Limitările sunt legate de natura retrospectivă a studiului și faptul că datele provin dintr-un singur centru slăbește, de asemenea, universalitatea observațiilor noastre. Alte limitări potențiale ar putea fi faptul că protocolul cu analogi non-GnRH a fost utilizat la unele femei cu rezervă ovariană diminuată mai degrabă decât la cele cu rezervă ovariană normală. Ciclurile proaspete care nu au reușit să producă niciun ovocit nu au fost incluse în acest studiu, de exemplu, ciclurile cu anularea stimulării ovariene.
Rezultatele acestui studiu pot oferi noi perspective pentru dezvoltarea strategiilor de management pentru pacientele cu prognostic scăzut. A fost efectuată o analiză SWOT pentru a ajuta managementul pentru pacientele cu prognostic scăzut în clinică, care a fost extrasă din rapoartele POSEIDON (1, 2, 4, 5) și din datele din acest studiu. Capacitatea de răspuns a foliculilor antrali la gonadotrofină a fost extrem de mare în grupul 3 decât în celelalte grupuri. Având în vedere rezultatul mulțumitor al CLBR în grupul 3, pentru a crește randamentul ovocitelor, sugerăm să se încerce mai multe stimulări ovariene, dar nu o stimulare ovariană mai dură prin doze zilnice excesive de gonadotrofină. Deși pacientele din grupul 2 au o rezervă ovariană mai mare, precum și mai multe ovocite și embrioni, CLBR a fost mai mică decât se aștepta. Strategia de management pentru grupul 2 ar trebui să fie îmbunătățirea ratei nașterilor vii mai degrabă decât creșterea numărului de ovocite prelevate.
Concluzie
În concluzie, în neconcordanță cu modelul de distribuție a cantității de ovocite și a cantității de embrioni pe grupe de pacienți, CLBR în ordinea de la cea mai mare la cea mai mică au fost în grupa 1 (femei tinere cu rezervă ovariană bună), grupa 3 (femei tinere cu rezervă ovariană slabă), grupa 2 (femei la vârste înaintate cu rezervă ovariană bună) și, în cele din urmă, grupa 4 (femei la vârste înaintate cu rezervă ovariană slabă.
Disponibilitatea datelor
Datele brute care susțin concluziile acestui manuscris vor fi puse la dispoziție de către autori, fără rezerve nejustificate, oricărui cercetător calificat.
Declarație etică
Studiul a fost aprobat de către Comitetul de etică pentru aplicarea clinică a tehnologiei de reproducere umană asistată de la Northwest Women’s and Children’s Hospital (nr. 2018002). Comitetul de etică care a aprobat acest studiu a renunțat la necesitatea de a obține consimțământul informat. Toate cercetările au fost efectuate în conformitate cu orientările și reglementările relevante.
Contribuții ale autorilor
WS și JS au conceput și proiectat studiul. WS și WZ au redactat și revizuit manuscrisul. WS, ZZ și WZ au analizat și interpretat datele. LT, ZZ și HZ au colectat și curățat datele. Toți autorii au citit și aprobat versiunea finală a manuscrisului.
Finanțare
Studiul a fost finanțat de Proiectele generale de dezvoltare socială din provincia Shaanxi (nr. 2018SF-247) și de Programul de formare a personalului de la Spitalul de femei și copii din nord-vest (2018ZD02).
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Le mulțumim tuturor clinicienilor, oamenilor de știință și embriologilor din cadrul Spitalului de femei și copii din nord-vest pentru asistența lor în colectarea datelor și tuturor pacienților pentru contribuția lor la acest studiu. Îi mulțumim cu recunoștință doamnei Dr. Xinglin Chen de la Departamentul de Epidemiologie și Biostatistică, X&Y solutions Inc. din Boston pentru contribuția sa la suportul statistic.
1. Alviggi C, Andersen CY, Buehler K, Conforti A, De Placido G, Esteves SC, et al. O nouă stratificare mai detaliată a respondenților slabi la stimularea ovariană: de la un răspuns ovarian slab la un concept de prognostic scăzut. Fertil Steril. (2016) 105:1452-3. doi: 10.1016/j.fertnstert.2016.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Humaidan P, Alviggi C, Fischer R, Esteves SC. Noua stratificare POSEIDON a „pacienților cu prognostic scăzut în tehnologia de reproducere asistată” și markerul său propus pentru un rezultat de succes. F1000Res. (2016) 5:2911. doi: 10.12688/f1000research.10382.1
CrossRef Full Text | Google Scholar
3. Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund G, Gianaroli L, et al. ESHRE consensus on the definition of ‘poor response’ to ovarian stimulation for in vitro fertilization: the Bologna criteria. Hum Reprod. (2011) 26:1616-24. doi: 10.1093/humrep/der092
PubMed Abstract | Reflect Full Text | Google Scholar
4. Esteves SC, Roque M, Bedoschi GM, Conforti A, Humaidan P, Alviggi C. Definirea pacienților cu prognostic scăzut supuși tehnologiei de reproducere asistată: Criteriile POSEIDON – de ce. Front Endocrinol. (2018) 9:461. doi: 10.3389/fendo.2018.00461
PubMed Abstract | Refef Full Text | Google Scholar
8. Shi W, Zhang S, Zhang S, Zhao W, Xia X, Wang M, Wang H, et al. Factorii legați de sarcina clinică după transferul de embrioni vitrificați-încălziți: o analiză retrospectivă și multivariată de regresie logistică a 2313 cicluri de transfer. Hum Reprod. (2013) 28:1768-75. doi: 10.1093/humrep/det094
PubMed Abstract | Full CrossRef Text | Google Scholar
11. Polyzos NP, Drakopoulos P, Drakopoulos P, Parra J, Pellicer A, Santos-Ribeiro S, Tournaye H, et al. Ratele cumulative de nașteri vii în funcție de numărul de ovocite prelevate după prima stimulare ovariană pentru fertilizare in vitro/injecție intracitoplasmatică de spermatozoizi: o analiză multinațională multicentrică incluzând aproximativ 15.000 de femei. Fertil Steril. (2018) 110:661-70 e1. doi: 10.1016/j.fertnstert.2018.04.039
PubMed Abstract | Refef Full Text | Google Scholar
12. Zhou J, Wang B, Wang B, Hu Y, Sun H. Asocierea dintre numărul de ovocite recuperate și rata cumulativă a nașterilor vii la femeile cu vârste cuprinse între 35-40 de ani supuse unor cicluri lungi de FIV / ICSI cu agonist GnRH. Arch Gynecol Obstet. (2017) 296:1005-12. doi: 10.1007/s00404-017-4503-9
PubMed Abstract | Refef Full Text | Google Scholar
13. Malchau SS, Henningsen AA, Forman J, Loft A, Nyboe Andersen A, Pinborg A. Prognosticul ratei cumulative a nașterilor vii pe baza numărului de ovocite aspirate în ciclurile ART anterioare. Hum Reprod. (2019) 34:171-80. doi: 10.1093/humrep/dey341
PubMed Abstract | Full CrossRef Text | Google Scholar
14. Devesa M, Tur R, Rodriguez I, Coroleu B, Martinez F, Polyzos NP. Rata cumulativă a nașterilor vii și numărul de ovocite prelevate la femeile de vârstă avansată. O analiză într-un singur centru, incluzând 4500 de femei cu vârsta >/ = 38 de ani. Hum Reprod. (2018) 33:2010-17. doi: 10.1093/humrep/dey295
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Chang Y, Li J, Li J, Li X, Liu H, Liang X. Calitatea ovulelor și rezultatul sarcinii la femeile infertile tinere cu rezervă ovariană diminuată. Med Sci Monit. (2018) 24:7279-84. doi: 10.12659/MSM.910410
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Bishop LA, Richter KS, Patounakis G, Andriani L, Moon K, Devine K. Diminuarea rezervei ovariene, măsurată prin intermediul hormonului de stimulare a foliculilor și a numărului de foliculi antrali de bază, nu este asociată cu pierderea sarcinii la pacientele mai tinere cu fertilizare in vitro. Fertil Steril. (2017) 108:980-7. doi: 10.1016/j.fertnstert.2017.09.011
CrossRef Full Text | Google Scholar
17. Igarashi H, Takahashi T, Nagase S. Îmbătrânirea ovocitelor stă la baza îmbătrânirii reproductive feminine: mecanisme biologice și strategii terapeutice. Reprod Med Biol. (2015) 14:159-69. doi: 10.1007/s12522-015-0209-5
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Babariya D, Fragouli E, Alfarawati S, Spath K, Wells D. The incidence and origin of segmental aneuploidy in human oocytes and preimplantation embryos. Hum Reprod. (2017) 32:2549-60. doi: 10.1093/humrep/dex324
PubMed Abstract | Full CrossRef Text | Google Scholar
20. Zeng M, Su S, Li L. Compararea rezultatelor sarcinii după vitrificarea în stadiul de clivaj și blastocist: o meta-analiză. J Assist Reprod Genet. (2018) 35:127-34. doi: 10.1007/s10815-017-1040-1
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Lin LT, Vitale SG, Vitale SG, Chen SN, Wen ZH, Tsai HW, Chern CU, et al. Stimularea ovariană în fază luteală poate îmbunătăți recuperarea ovocitelor și calitatea ovocitelor la respondenții ovarieni slabi supuși fertilizării in vitro: rezultate preliminare ale unui studiu pilot prospectiv monocentric. Adv Ther. (2018) 35:847-56. doi: 10.1007/s12325-018-0713-1
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Narkwichean A, Maalouf W, Baumgarten M, Polanski L, Raine-Fenning N, Campbell B, et al. Eficacitatea dehidroepiandrosteronului (DHEA) pentru a depăși efectul îmbătrânirii ovarelor (DITTO): un studiu randomizat controlat cu placebo dublu-orb, randomizat, cu dovadă de principiu. Eur J Obstet Gynecol Reprod Biol. (2017) 218:39-48. doi: 10.1016/j.ejogrb.2017.09.006
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Grynberg M, Labrosse J. Understanding follicular output rate (FORT) and its implications for POSEIDON criteria. Front Endocrinol. (2019) 10:246. doi: 10.3389/fendo.2019.00246
PubMed Abstract | Full CrossRef Text | Google Scholar
27. Hou LY. Studiu epidemiologic privind infertilitatea în trei provincii din China. Teză de doctorat, Graduate School of Peking Union Medical College, Beijing, China (2011).
Google Scholar
28. Zhu Hui-li HW. Epidemiologia și etiologia infertilității oviductului. J Int Reprod Health/Family Plann. (2016) 35:212-216.
Google Scholar
.