- Context și introducere
- Prezentarea cazului
- Discuție
- Patofiziologia ADI
- Cercetarea literaturii
- Cauzele IAD
- Prezentarea clinică a ADI
- Complicații asociate ale DI
- Abordări de management al ADI
- Concluzie
- Disponibilitatea datelor
- Declarație etică
- Consimțământ de participare
- Contribuții ale autorilor
- Finanțare
- Declarație privind conflictul de interese
- Recunoștințe
Context și introducere
Diabet Insipid Adipsic Hipohalamic (ADI), un sindrom rar cu prezentare clinică eterogenă, este caracterizat de o serie de defecte în mecanismele homeostatice pentru echilibrul apei. Acestea includ mecanismul de osmoreglare a setei, secreția de vasopresină arginină și capacitatea renală de a concentra urina. Mai puțin de o sută de cazuri severe au fost raportate la nivel mondial în ultimele patru decenii (1).
Managementul acestor pacienți este extrem de dificil, deoarece acești pacienți tind să sufere de oscilații largi ale sodiului plasmatic chiar și atunci când DI este bine controlată (2).
Referim un caz de ADI severă care a apărut postoperator după o intervenție chirurgicală de malformație arteriovenoasă cerebrală (MAV). Descriem posibila patogenie în acest caz și trecem în revistă literatura de specialitate pentru toate cazurile raportate în mod similar și descriem mecanismele potențiale implicate, prezentarea clinică, managementul acut, precum și cel cronic, și prognosticul.
Prezentarea cazului
O doamnă în vârstă de 27 de ani s-a prezentat cu hemoragie intracerebrală frontală stângă cu extensie intraventriculară secundară unui complex mare al ganglionilor bazali (AVM) cu alimentatori arteriali complecși din arterele cerebrale medii stângi (MCA), și arterele cerebrale anterioare (ACA) cu o scală de gradare Spetzler Martin de 3 (3).
După recuperarea inițială în urma craniotomiei decompresive și a intervenției chirurgicale de evacuare a cheagului, a fost supusă unei intervenții chirurgicale elective de excizie a AVM ~2 săptămâni mai târziu. În timpul operației de AVM, chirurgii au raportat o sângerare rapidă din vasele de alimentare (MCA, ACA și vasele coroidale) cu hemoragie intracerebrală severă și hemoragie intraventriculară care a necesitat o transfuzie masivă de sânge de până la 32 de unități intraoperator. A fost plasată în comă indusă de barbiturice și hipotensiune indusă pentru a minimiza edemul cerebral (4).
A început să aibă poliurie cu volume mari de urină intraoperator la scurt timp după episodul de sângerare intraoperatorie abundentă. Deși preoperator concentrațiile sale de sodiu au fost normale, concentrațiile de sodiu au fost mai mari imediat (în prima oră) postoperator în intervalul 151-160 mmol/L în tandem cu o osmolalitate urinară scăzută <130 mosm/L. A fost luată în considerare DI tranzitorie și a fost începută cu desmopresină intravenoasă (desmopresină IV) 1 mcg care a fost administrată zilnic împreună cu 3,5-4 L de perfuzie salină de jumătate de concentrație timp de 3 zile consecutive.
Cu toate acestea, ea a dezvoltat din moment ce a dezvoltat edem pulmonar (probabil o consecință a transfuziei masive de sânge intraoperator, a fluidelor hipotone intravenoase și a desmopresinei IV concomitente) în ziua postoperatorie 4, desmopresina IV a fost întreruptă, iar plasma proaspătă congelată și diureticele (furosemid intravenos 40 mg) au fost administrate pentru a reduce edemul extra-vascular. În ora următoare, a început să dezvolte din nou poliurie, cu un debit urinar de 800 ml într-o singură oră, iar concentrațiile de sodiu au avut o tendință de creștere până la 172 mmol/L. Având în vedere edemul cerebral postoperator concomitent, s-a decis să se reducă concentrațiile de sodiu în mod țintit, astfel încât rata de scădere a sodiului să rămână între 5-10 mmol/L/zi, cu un nivel țintă de 155 mmol/L. S-a administrat o doză mică de desmopresină IV 0,25 mcg și s-a sugerat un regim de titrare în vederea menținerii unui debit urinar orar mai mic de 100 ml/h. A necesitat desmopresină IV 0,75 mcg în ziua postoperatorie 5, iar apoi IV 0,25 mcg de două ori pe zi în ziua 6, când a atins un nivel țintă de 155 mmol/L. Această concentrație de sodiu a putut fi menținută cu doza de desmopresină timp de încă 2 zile.
În ziua 9, postoperator, desmopresina a fost întreruptă deoarece ea a fost capabilă să mențină un debit urinar scăzut fără desmopresină, iar concentrațiile de sodiu au fost stabile. În acest stadiu, s-a considerat că a dezvoltat sindromul de secreție inadecvată a hormonului antidiuretic (SIADH) și lichidele au fost restricționate la 1 L/zi. Concentrațiile sale de sodiu au rămas stabile la 134-138 mmol/L pe parcursul acestei săptămâni.
În ziua postoperatorie 14, a dezvoltat din nou poliurie cu creșterea concentrațiilor de sodiu și a osmolalității serice. În acest moment a fost reluată desmopresina IV la 0,25 mcg de două ori pe zi. Concentrațiile de sodiu au putut fi menținute la 138-150 mmol/L cu desmopresină IV (0,25 mcg de două ori pe zi) și lichide. Ea trecuse printr-o fază trifazică cu o perioadă de DI tranzitorie, urmată de SIADH și, ulterior, de DI permanentă (a se vedea figura 1). Nivelurile serice ale cortizolului, hormonului de creștere, factorului de creștere asemănător insulinei-1, funcției tiroidiene și prolactinei se aflau toate în limitele normale.

Figura 1. Graficul care prezintă toate măsurătorile seriale la pacienta noastră pe toată durata spitalizării.
După o inserție de șunt ventriculoperitoneal (făcută pentru a menține presiunea intracraniană) la 6 săptămâni după excizia MAV, a fost transferată în secțiile de reabilitare și regimul de desmopresină intravenoasă a fost convertit într-un regim subcutanat (SC) (a se vedea figura 1). Când alimentarea prin sonda nazogastrică a fost întreruptă, am încercat să reglăm lichidele prin sete. Investigațiile sanguine au arătat o creștere a nivelului de sodiu până la 165 mmol/L și nu a simțit sete în această perioadă de hipernatremie, în ciuda unei osmolalități serice de 350 mosm/kg. Ea a rămas adipsică în ciuda recuperării afaziei. Nu s-a folosit o scală de sete deoarece, la interogatoriu, aceasta a verbalizat că nu a simțit deloc sete, iar o scală de sete nu a putut fi aplicată. Prin urmare, fluidele au trebuit să fie reglate pentru a menține echilibrul de sodiu. Debitul de urină a fost fixat și echilibrul de sodiu a fost bine reglat cu un regim SC de desmopresină 0,5 mcg dimineața și 0,375 mcg seara, cu lichide regulate de 1,5-2 L pe zi. Ea nu a prezentat nicio dovadă de tulburări de termoreglare. Cranioplastia cu polietercetonă (PEEK) a fost efectuată la ~4 luni după intervenția chirurgicală inițială.
După 5 luni de reabilitare multidisciplinară intensivă, ea avea încă o mână dreaptă dominantă nefuncțională și deficite cognitive reziduale semnificative, iar dozarea sigură și autoadministrarea de desmopresină subcutanată nu a fost posibilă pe termen lung.
Un studiu al desmopresinei nazale și al desmopresinei orale a arătat o absorbție variabilă semnificativă care a dus la fluctuații mai mari ale concentrațiilor de sodiu. În continuare, am decis să folosim desmopresina sublinguală disponibilă ca desmopresină Melt. După mai multe încercări cu diferite regimuri de dozare, am reușit să fixăm producția de urină la aproximativ 2 L/zi folosind desmopresină Melt liofilizat oral 120 mcg (2 tablete) dimineața și 60 mcg (1 tabletă) seara. Cu toate acestea, la această doză, ea avea hiponatremie în anumite momente ale zilei. Am efectuat o titrare suplimentară a dozei prin tăierea comprimatelor de desmopresină cu ajutorul unei pensete/forceps pentru a ridica comprimatele din blister și am tăiat comprimatele în sferturi exacte (fiecare 15 mcg) cu ajutorul unui tăietor de pastile. Cu un regim de 90 mcg (1,5 comprimate) dimineața și 75 mcg (1,25 comprimate) seara am reușit să obținem rezultate similare cu cele obținute cu regimul subcutanat. Cu acest regim și cu un aport de lichide reglementat de 2 L/zi, concentrațiile de sodiu s-au menținut în intervalul de 135-150 mmol/L fără fluctuații majore sau simptome cognitive. Acest dozaj i-a permis, de asemenea, să aibă o activitate crescută în timpul zilei pentru reabilitare și a putut să doarmă bine, fără a fi deranjată de poliurie pe timp de noapte.
Vezi Figura 1 pentru măsurătorile seriale ale sodiului la această pacientă de-a lungul perioadei de spitalizare cu evenimentele descrise mai sus.
Având în vedere istoricul clinic și faptul că hipofiza și hipotalamusul ei sunt în mare parte intacte, este puțin probabil ca ea să fi avut defecte semnificative în baroregulație.
Discuție
Patofiziologia ADI
În condiții fiziologice, sodiul plasmatic, osmolalitatea și echilibrul apei sunt menținute în intervale înguste secundar unei interacțiuni atente între sete și aportul de apă, secreția de vasopresină neurohipofizară și antidiureza la nivelul tubulilor colectoare distali renali.
Semnale periferice (osmosenzori orofaringieni, intestinali, osmolalitatea sângelui) codifică în timp real informații despre starea actuală de hidratare, iar acestea sunt integrate la nivel central (5). O stare de deshidratare va conduce la semnale stimulatoare către organul subfornical (SFO), care trimite ierarhic semnale către organum-vasculosum of lamina terminalis (OVLT) și nucleul preoptic median (MnPO) (6). MnPO, care poate servi drept „detector central”, trimite semnale de stimulare către nucleii hipotalamici pentru a crește eliberarea de vasopresină și trimite, de asemenea, semnalul de sete crescută prin SFO și OVLT (7, 8). Căile neuronale legate de sete care conectează SFO și OVLT la cortexul cingular și insular au ca rezultat percepția conștientă a setei (7, 8). Dimpotrivă, în starea de hidratare adecvată, semnalele de la senzorii periferici, conduc la o inhibiție a acestor zone și la un feedback negativ din partea MnPO care duce la suprimarea setei și la o secreție și eliberare mai mică de vasopresină (circuitul roșu). De fapt, neuronii din MnPO, OVLT și SFO sunt interconectați în mod extensiv și reciproc, deoarece activarea optogenetică și chimiogenetică a neuronilor din oricare dintre aceste zone poate stimula setea (9). Prin urmare, întreruperea alimentării cu sânge care duce la deteriorarea celulelor va duce la adipsie. Au fost publicate, de asemenea, cazuri de ADI datorate autoimunității celulelor neuronale din SFO și OVLT, indicând importanța funcțională a acestor senzori neuronali în controlul setei (10).
Neuronii AVP prezintă o activitate „fazică” a potențialelor de acțiune cu intervale în care AVP este eliberat la terminalele axonale. Eliberarea de vasopresină este reglată de intrările osmosenzoriale de la MnPO, prin intermediul baroreceptorilor și există, de asemenea, o reglare anticipativă în care eliberarea de vasopresină este stimulată înainte de mese (prandial), la hipertermie și după un model circadian (11). Există un tipar circadian zilnic al secreției de vasopresină în circulație, cu o creștere a nivelurilor între orele 24:00 și 02:00, iar nivelurile scad progresiv pe parcursul zilei, cu un nadir între orele 16:00 și 20:00 (12). Această creștere circadiană de la miezul nopții cauzată de o creștere a eliberării de vasopresină rezultă în parte din excitarea sinaptică sporită a neuronilor neurosecretori magnocelulari de către nucleul suprachiasmatic, care este cunoscut că reglează ritmul circadian (11). În cazul IAD, reglarea osmosenzorială a secreției de vasopresină este cea mai afectată, iar alte efecte pot fi variabile în funcție de locul și amploarea leziunii, în timp ce răspunsul baroreceptorului este cunoscut ca fiind păstrat la mulți pacienți cu leziuni limitate, așa cum s-a demonstrat într-un studiu (13).
AVP acționează asupra canalelor colectoare renale prin intermediul receptorilor de vasopresină-2 (V2) pentru a crește permeabilitatea la apă, ceea ce duce la scăderea formării de urină. Reabsorbția de apă este controlată prin reglarea canalului de apă, aquaporina-2 (AQP2). AVP induce, pe termen scurt, translocarea intracelulară a veziculelor purtătoare de AQP2 către membrana plasmatică apicală, reglând astfel traficul AQP2. Pe termen lung, cu concentrații adecvate de AVP, aceasta reglează transcrierea genei AQP2 pentru a crește abundența proteinei AQP2 în canalul colector (14). În ADI, postulăm că este probabil ca răspunsul osmosenzorial acut să fie afectat mai mult decât cel cronic. Prin urmare, va exista o abundență relativă a aquaporinei, dar traficul acut către membrana apicală va fi afectat.
Vezi figura 2 pentru o ilustrare detaliată a mecanismelor.
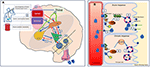
Figura 2. Reprezentarea schematică a reglării echilibrului de lichide la om. (A) Controlul și reglarea secreției de vasopresină în creier. (A) Semnalele periferice (osmosenzori orofaringieni, intestinali, osmolalitatea sângelui) codifică informații despre starea actuală de hidratare în timp real (1) și integrate la nivel central (2). O stare de deshidratare conduce la semnale stimulative către SFO, care trimite ierarhic semnale către OVLT și MnPO (3). MnPO, care poate servi drept „detector central”, trimite semnale de stimulare către nucleele hipotalamice pentru a crește eliberarea de vasopresină (4) și, de asemenea, trimite semnalul de sete crescută prin SFO, și OVLT (5, circuitul albastru din diagramă). Dimpotrivă, în starea de hidratare adecvată semnalele de la senzorii periferici, există o inhibiție a acestor zone și un feedback negativ din partea MnPO care duce la suprimarea setei și la scăderea secreției și eliberării de vasopresină (circuitul roșu 6). Căile neuronale legate de sete care leagă SFO și OVLT de cortexul cingular și insular au ca rezultat percepția conștientă a setei (7). În cazul DI adipice, în absența stimulilor osmosenzoriali, circuitele neuronale asociate din cauza leziunilor celulare, eliberarea stimulativă sau inhibarea vasopresinei și percepția conștientă a setei sunt ambele perturbate. (B) Mecanismul de acțiune al vasopresinei asupra tubulilor colectori renali. (B) Vasopresina din circulația sanguină se atașează la receptorul 2 al vasopresinei de pe suprafața luminală a celulelor principale ale tubului colector distal din rinichi (1). În faza acută, prin sinteza de AMPc din ATP prin intermediul AC (adenilatciclază) formează proteina kinaza A (2) care stimulează translocarea aquaporinei din vezicula de stocare către membrana apicală și suprafața luminală a sângelui (3). Acest lucru are ca rezultat transportul apei în celulă (4) și absorbția ulterioară în circulație (5). În faza cronică, prin intermediul controlului transcripțional mediat de cAMP al genei aquaporinei (6), în celulele principale pot fi găsite niveluri crescute ale canalului de apă aquaporină (7). În cazul DI adipice, răspunsul acut este probabil să fie mai afectat decât răspunsul cronic, deoarece este afectată secreția de vasopresină legată de osmoză.
Cercetarea literaturii
Am efectuat o căutare sistematică a literaturii, inclusiv Pubmed, Scopus și Embase, pentru cazurile raportate ca raport de caz sau serie de cazuri de ADI din anii 1980 până în 2018. Am folosit termenul de căutare: Adipsia, Adipsic disorder și Adipsic DI și am limitat căutarea la limba engleză și la Oameni. De asemenea, am căutat orice alte referințe identificate în timpul citirii fiecărui raport de caz/serie de cazuri. Am găsit 25 de referințe (10, 13, 15-39) cu un total de 45 de cazuri raportate în literatura de specialitate. Am rezumat toate rapoartele de caz în tabelul 1.
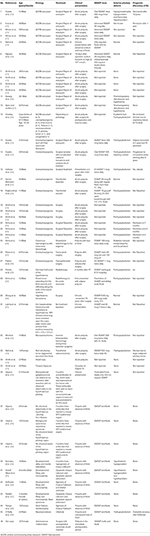
Tabel 1. Date demografice, etiologie, prezentare clinică, management și prognostic al pacienților cu diabet insipid adipos raportat în literatura de specialitate.
Cauzele IAD
Patruzeci la sută (17/46) din cazurile de IAD descrise în literatura de specialitate au survenit secundar rupturii anevrismului arterei comunicante anterioare (ACOM) și clipajului post-chirurgical folosind o abordare de craniectomie frontală. Într-un caz a fost descrisă patologia dublă de craniofaringiom și anevrism ACOM (15). S-a descris că alimentarea arterială a OVLT provine din patru surse (40): (1) o sursă mediană superioară care se ramifică din artera comunicantă anterioară, (2) și (3) două surse laterale care provin din artere care se ramifică din fiecare arteră cerebrală anterioară de sub artera comunicantă anterioară și (4) o sursă mediană inferioară care urcă de sub chiasma optică. În mod caracteristic, capilarele care căptușesc acest organ se află în afara barierei hematoencefalice și, prin urmare, o modificare a osmolalității poate fi ușor sesizată de aceste organe (41). Trebuie remarcat faptul că îmbunătățirile în tehnicile chirurgicale și utilizarea de coiling în loc de clipping pot reduce aceste complicații. În cazul pacienților în stare clinică bună cu anevrisme rupte ale circulației anterioare, care se pretează la coiling, datele dintr-o metaanaliză arată că coilingul este asociat cu un rezultat mai bun (42). În comparație cu clipping-ul în care ambele capete ale ACA sunt clivate cu întreruperea alimentării cu sânge a hipotalamusului, procedura de introducere a unei spirale în anevrism este capabilă să păstreze alimentările către hipotalamus în majoritatea cazurilor.
Cea de-a doua cauză de IAD a fost descrisă ca fiind craniofaringiom supraselar (17/46). Aceste cazuri implică adesea o excizie trans-frontală și în unele cazuri a fost descrisă recuperarea după operație. De asemenea, a fost descris un caz de hemangiom cavernos cu o manifestare similară după un episod de sângerare (26).
Tumorile hipotalamice, inclusiv hamartomul, tumora glandei pineale și tumora cu celule germinale, pot prezenta ADI (26, 29, 30). A fost raportat un caz de carcinom hepatocelular cu metastaze în hipotalamus și ADI rezultat (31).
În mod interesant, au fost descrise doar două cazuri de tumori hipofizare cu ADI (18, 32). Ambele aceste cazuri au avut o tumoră agresivă cu rezecție multiplă trans-frontală și hemoragie intracraniană intraoperatorie. Un caz fiecare a fost descris în legătură cu un traumatism cranian și, de asemenea, cu expunerea la toluen (13).
Au fost descrise patru cazuri cu prezentare bruscă acută de poliurie și hipernatremie. Acești pacienți nu prezentau anomalii structurale la nivelul hipotalamusului, iar investigațiile detaliate au evidențiat dovezi de anticorpi împotriva organelor OVLT. Aceste cazuri au fost postulate ca având o patologie autoimună subiacentă (10, 33).
Cazuri congenitale sau din copilăria timpurie la pacienți cu probleme de dezvoltare a corpului calos au fost, de asemenea, descrise cu manifestarea ADI (34-38). Un caz de neurosarcoidoză care afectează extensiv hipofiza anterioară, hipofiza posterioară și hipotalamusul cu ADI a fost, de asemenea, descris (39).
Prezentarea clinică a ADI
Prezentarea clinică în majoritatea cazurilor descrise este poliurie în săptămâna imediată după clivarea chirurgicală pentru MAV sau după craniotomie. Prezentarea biochimică este hipernatremia cu osmolalitate serică crescută în prezența unei urini inadecvat diluate în volume mari. Dacă senzația de sete este evaluată folosind o scală a setei, acești pacienți cu ADI raportează o sete scăzută sau minimă în ciuda hipernatremiei. Interesant este că acești pacienți au un răspuns normal la hipotensiune și mecanismul lor baroreceptor este intact (13).
Pacientul nostru a trecut printr-o fază trifazică de DI inițială, urmată de SIADH și apoi de DI permanentă. Acest tipar descris ca răspuns trifazic a fost descris după operații de hipofiză și craniofaringiom. Fiziopatologia răspunsului trifazic pare să fie explicată prin disfuncția hipotalamică timpurie (caracterizată prin poliurie și hipernatremie), eliberarea ulterioară de vasopresină preformată din veziculele de stocare din hipofiza posterioară (fără legătură cu vreun stimul) (caracterizată prin SIADH) și, în final, epuizarea depozitelor de vasopresină (DI permanentă) (43). La pacientul nostru, este probabil ca în cea de-a treia fază, deficiența răspunsului la osmolalitate în eliberarea de vasopresină să fie demascată după ce SIADH se rezolvă, mai degrabă decât o depleție absolută de vasopresină.
Complicații asociate ale DI
Puține rapoarte de caz au descris tulburări de termoreglare. Panhipopituitarismul a fost raportat doar în cazurile de craniofaringiom și în cazurile de tumori hipofizare și nu a fost prezent la pacientul nostru.
Deși nu a fost raportat în mod constant, alte complicații importante ale hipernatremiei includ tromboza venoasă profundă; prin urmare, heparina cu greutate moleculară mică poate fi indicată în timpul bolii acute și al imobilizării (18).
Obezitatea hipotalamică și apneea de somn au fost de asemenea raportate frecvent (18). Într-o serie de cazuri (13), în care au evaluat răspunsul AVP la hipotensiune, au constatat că pacienții cu craniofaringiom au avut, de asemenea, o pierdere a răspunsului AVP baro-reglementat. Acești pacienți aveau dovezi de panhipopituitarism, ceea ce indică faptul că intervenția chirurgicală la tumorile lor a lăsat leziuni mai extinse la nivelul hipofizei, inclusiv la nivelul hipofizei posterioare, care este ultima cale comună pentru secreția de AVP.
Abordări de management al ADI
Managementul acestor cazuri a fost descris (15, 18). Educația pacientului și a familiei cu privire la principiile echilibrului și gestionării apei este crucială. Aportul de apă poate fi fixat la 1,5-2 L zilnic și apoi se poate efectua titrarea desmopresinei. Urmărirea zilnică a greutății este utilă pentru a detecta deshidratarea sau supraîncărcarea cu lichide. Se recomandă efectuarea săptămânală a concentrațiilor plasmatice de sodiu pentru a monitoriza fluctuațiile. În ciuda unei monitorizări stricte, este dificil să se reproducă un control non-stop al concentrațiilor plasmatice de sodiu care să imite osmoreglarea fiziologică. Având în vedere riscul de oscilații rapide ale concentrațiilor de sodiu și simptomele de hiponatremie observate la intervalul de referință scăzut, este recomandabil să se mențină concentrațiile de sodiu în intervalul de referință superior.
Desmopresina, analogul sintetic al AVP, a fost introdus pentru prima dată pentru tratamentul DI în 1972 (44). Majoritatea pacienților se descurcă bine cu doze mici de desmopresină administrate de două ori pe zi. Există un echilibru fin și nivelurile de sodiu pot oscila până la niveluri foarte scăzute cu escaladări minuscule ale dozei.
Pacientul nostru s-a descurcat foarte bine cu doze foarte mici de administrări parenterale despre care se știe că au cea mai mică variabilitate a biodisponibilității (45). Absorbția formulărilor intranazale este foarte variabilă, în special la copiii sau adulții cu probleme cognitive, deoarece este posibil ca aceștia să nu inhaleze soluția într-un mod consecvent (46, 47). Formulările orale sunt o opțiune bună, deoarece creșterea dozei va duce la o durată de acțiune mai lungă, dar nu are un efect de vârf (48-50). Am încercat această formă în doze variate de 50-100 mcg, dar am constatat variații semnificative de la o zi la alta în ceea ce privește efectele cu această formulare. Desmopresina sublinguală (Minirin Melt) este disponibilă din 2005. Studiile farmacologice au demonstrat că calea sublinguală duce la o biodisponibilitate mai mare cu ~60% în comparație cu calea orală (49, 50). Dozele rafinate de desmopresină sublinguală ar putea fi obținute prin tăierea fiecărui comprimat de 60 mcg, permițând ajustarea dozelor de 65 până la 90 mcg pe cale sublinguală. A fost descris un profil farmacocinetic similar al unor astfel de comprimate divizate (51). Se știe că aportul concomitent de alimente scade rata și gradul de absorbție cu 40 %, prin urmare, este mai bine să se evite orice consum de alimente în decurs de o oră înainte și după administrarea comprimatelor sublinguale de desmopresină. Recent, a fost descris un protocol detaliat de administrare a fluidelor cu monitorizare zilnică a sodiului cu desmopresină subcutanată în doză fixă (28), care demonstrează dificultatea monitorizării zilnice. Un alt raport de caz recent (27) a raportat, de asemenea, utilizarea formei sublinguale de desmopresină pentru IAD la doza de 60 și 120 mcg zilnic. Utilizarea desmopresinei sublinguale poate fi o alternativă utilă în cazurile în care efectele optime nu pot fi atinse cu alte formulări. acești pacienți necesită o monitorizare strictă a greutății zilnice, a volumului de urină și a aportului de lichide 24 de ore pe zi. Având în vedere defectele cognitive și de memorie, pe care acești pacienți tind să le aibă, ei au nevoie, de obicei, de un îngrijitor care să monitorizeze aportul de lichide pentru a se asigura că beau volumul necesar.
În revizuirea noastră de cazuri, 6 pacienți au avut o remisiune a ADI, dintre care 2 au fost legate de anevrism ACOM (15, 16) și 4 au fost legate de craniofaringiom (15, 26). Un pacient cu neurosarcoidoză a avut o remisiune cu terapia cu Infliximab (39). Astfel de observații pot sugera că atât osmoreceptorii care reglează setea, cât și căile lor eferente demonstrează mai multă neuroplasticitate decât cei care reglează producția de AVP (26).
Concluzie
ADI este o complicație extrem de rară a tulburărilor hipotalamice care are ca rezultat o pierdere a funcției în centrul setei. Datorită controlului ierarhic de la centrul setei, absența setei este, de asemenea, asociată cu pierderea reglării vasopresinei și a poliuriei. Subiecții care suferă de ADI trebuie să fie gestionați cu delicatețe pe doze mici de desmopresină și echilibru de lichide. Cu actualele abordări de monitorizare și îngrijire personalizată, încă nu este posibil să se mimeze osmoreglarea cvasi-fiziologică non-stop.
Disponibilitatea datelor
Toate seturile de date generate pentru acest studiu sunt incluse în manuscris/fișiere suplimentare.
Declarație etică
S-a obținut consimțământul în cunoștință de cauză în scris de la persoana (persoanele) pentru publicarea oricăror imagini sau date potențial identificabile incluse în acest articol.
Consimțământ de participare
Am obținut permisiunea scrisă de la rudele apropiate ale pacientului pentru a scrie și publica acest manuscris.
Contribuții ale autorilor
RD a fost endocrinologul primar care a gestionat echilibrul lichidian al pacientului, a conceptualizat ideea, a scris manuscrisul, a făcut analiza literaturii, a achiziționat datele, a scris și a revizuit manuscrisul final. HC, AC și JH au fost rezidenți implicați în managementul acestui pacient și au revizuit manuscrisul final. HT a fost anestezistul care s-a ocupat de acest pacient în faza de terapie intensivă, a conceptualizat ideea și a evaluat critic manuscrisul final. KC a fost specialistul principal în reabilitare care s-a ocupat de acest pacient, a conceptualizat ideea și a evaluat critic manuscrisul final. BB a conceptualizat ideea și a evaluat critic manuscrisul final.
Finanțare
RD a fost sprijinit parțial de Center Grant de la Consiliul Național de Cercetare Medicală (NMRC/CG/017/2013) și de National Medical Research Council Clinician Scientist Award (MOH-CSAINV17nov-0006).
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Le mulțumim pacientei și părinților ei pentru că ne-au permis să scriem și să publicăm acest manuscris.
1. Eisenberg Y, Frohman LA. Diabetul insipid adipsic: o revizuire. Endocr Pract. (2016) 22:76-83. doi: 10.4158/EP15940.RA
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Robertson GL. Anomalii ale reglării setei. Kidney Int. (1984) 25:460-9. doi: 10.1038/ki.1984.39
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Spetzler RF, Martin NA. Un sistem de clasificare propus pentru malformațiile arteriovenoase. J Neurosurg. (1986) 65:476-83. doi: 10.3171/jns.1986.65.4.0476
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Ellens NR, Figueroa BE, Clark JC. Utilizarea comei induse de barbiturice în timpul procedurilor de neurochirurgie cerebrovasculară: o analiză a literaturii. Brain Circ. (2015) 1:140-6. doi: 10.4103/2394-8108.172887
CrossRef Full Text | Google Scholar
5. Zimmerman CA, Huey EL, Ahn JS, Beutler LR, Tan CL, Kosar S, et al. Un semnal de la intestin la creier al osmolarității fluidelor controlează sațietatea setei. Nature. (2019) 568:98-102. doi: 10.1038/s41586-019-1066-x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Augustine V, Gokce SK, Lee S, Wang B, Davidson TJ, Reimann F, et al. Arhitectura neuronală ierarhică care stă la baza reglării setei. Nature. (2018) 555:204-9. doi: 10.1038/nature25488
PubMed Abstract | Textul complet | Google Scholar
7. Bichet DG. Reglarea setei și eliberarea de vasopresină. Annu Rev Physiol. (2019) 81:359-73. doi: 10.1146/annurev-physiol-020518-114556
PubMed Abstract | Text integral | Google Scholar
8. McKinley MJ, Denton DA, Ryan PJ, Yao ST, Stefanidis A, Oldfield BJ. De la organele senzoriale circumventriculare la cortexul cerebral: căile neuronale care controlează setea și foamea. J Neuroendocrinol. (2019) 31:e12689. doi: 10.1111/jne.12689
PubMed Abstract | CrossRef Full Text | Google Scholar
9. McKinley MJ, Yao ST, Uschakov A, McAllen RM, Rundgren M, Martelli D. Nucleul preoptic median: în față și în centru pentru reglarea fluidelor corporale, a sodiului, a temperaturii, a somnului și a homeostaziei cardiovasculare. Acta Physiol. (2015) 214:8-32. doi: 10.1111/apha.12487
PubMed Abstract | Full Text | Google Scholar
10. Hiyama TY, Matsuda S, Fujikawa A, Matsumoto M, Watanabe E, Kajiwara H, et al. Autoimunitatea la senzorul nivelului de sodiu din creier cauzează hipernatremia esențială. Neuron. (2010) 66:508-22. doi: 10.1016/j.neuron.2010.04.017
PubMed Abstract | Refef Full Text | Google Scholar
11. Baylis PH, Thompson CJ. Osmoreglarea secreției de vasopresină și a setei în sănătate și boală. Clin Endocrinol. (1998) 29:549-76. doi: 10.1111/j.1365-2265.1988.tb03704.x
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Gizowski C, Bourque CW. Baza neuronală a setei homeostatice și anticipative. Nat Rev Nephrol. (2018) 14:11-25. doi: 10.1038/nrneph.2017.149
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Smith D, McKenna K, Moore K, Tormey W, Finucane J, Phillips J, et al. Baroreglarea eliberării vasopresinei în diabetul insipid adipos. J Clin Endocrinol Metab. (2002) 87:4564-8. doi: 10.1210/jc.2002-020090
PubMed Abstract | Full CrossRef Text | Google Scholar
14. Jung HJ, Kwon TH. Mecanisme moleculare care reglează aquaporina-2 în canalul colector renal. Am J Physiol Renal Physiol. (2016) 311:F1318-28. doi: 10.1152/ajprenal.00485.2016
PubMed Abstract | Refef Full Text | Google Scholar
15. Cuesta M, Gupta S, Salehmohamed R, Dineen R, Hannon MJ, Tormey W, et al. Modele eterogene de recuperare a setei la pacienții adulți cu diabet insipid adipos. QJM. (2016) 109:303-8. doi: 10.1093/qjmed/hcv175
PubMed Abstract | Full CrossRef Text | Google Scholar
16. Imai E, Kaneko S, Tsukamoto Y. Adaptarea compensatorie renală pentru manipularea apei la un pacient cu diabet insipid adipos după clipare a unui anevrism rupt al arterei comunicante anterioare. Clin Nephrol. (2017) 88:112-6. doi: 10.5414/CN108963
PubMed Abstract | Full CrossRef Text | Google Scholar
17. McIver B, Connacher A, Whittle I, Baylis P, Thompson C. Diabetul insipid hipotalamic adipsic după clipare a anevrismului arterei comunicante anterioare. BMJ. (1991) 303:1465-7. doi: 10.1136/bmj.303.6815.1465
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Ball SG, Vaidya B, Bayliss PH. Sindromul adipsic hipotalamic: diagnostic și management. Clin Endocrinol. (1997) 47:405-9. doi: 10.1046/j.1365-2265.1997.2591079.x
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Nguyen BN, Yablon SA, Chen CY. Hipernatremia hipodipsică și diabetul insipidus după clipare a anevrismului arterei comunicante anterioare: provocări diagnostice și terapeutice la pacientul amnezic în reabilitare. Brain Injury. (2001) 15:975-80. doi: 10.1080/02699050110063459
PubMed Abstract | Full CrossRef Text | Google Scholar
20. Nussey SS, Ang VT, Jenkins JS. Hipernatremia cronică și hipotermia după hemoragia subarahnoidă. Postgrad Med J. (1986) 62:467-741. doi: 10.1136/pgmj.62.728.467
CrossRef Full Text | Google Scholar
21. Spiro SG, Jenkins JS. Adipsia și hipotermia după hemoragia subarahnoidă. BMJ. (1971) 3:411-2. doi: 10.1136/bmj.3.5771.411
CrossRef Full Text | Google Scholar
22. Crowley RK, Sherlock M, Agha D, Smith D, Thompson CJ. Perspective clinice în diabetul insipid adipos: o serie mare de cazuri. Clin Endocrinol. (2007) 66:475-82. doi: 10.1111/j.1365-2265.2007.02754.x
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Colleran K, Sanchez-Goettler L, Sloan A. Obezitatea hipotalamică complicată de diabet insipid central adipos după rezecția chirurgicală a unui craniofaringiom. J Clin Hypertens. (2009) 11:608-10. doi: 10.1111/j.1751-7176.2009.00057.x
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Zantut-Wittmann D, Garmes HM, Panzan AD, Lima Mde O, Baptista MT. Rabdomioliză severă datorată hipernatremiei adipoase după operația de craniofaringiom. Arq Bras Endocrinol Metabol. (2007) 51:7. doi: 10.1590/S0004-273020070007000700023
PubMed Abstract | Full Cross | Google Scholar
25. Raghunathan V, Dhaliwal MS, Gupta A, Jevalikar G. From brain salt wasting to diabetes insipidus with adipsia: raport de caz al unui copil cu craniofaringiom. J Pediatr Endocrinol Metab. (2015) 28:323-6. doi: 10.1515/jpem-2014-0224
PubMed Abstract | Full Text | Google Scholar
26. Sinha A, Ball S, Jenkins A, Hale J, Cheetham T. Evaluarea obiectivă a recuperării setei la pacienții cu diabet insipid adipos. Pituitară. (2011) 14:307-11. doi: 10.1007/s11102-011-0294-3
PubMed Abstract | Full CrossRef Text | Google Scholar
27. Pérez MA, Millán HA, Naranjo JA, Flórez Romero A. Adipsic diabetes insipidus secondary to craniopharyngioma resection. BMJ Case Rep. (2019) 12:e225903. doi: 10.1136/bcr-2018-225903
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Pabich S, Flynn M, Pelley E. Protocolul zilnic de monitorizare a sodiului și a aportului de lichide: prevenirea spitalizării recurente în diabetul insipid adipos. J Endoc Soc. (2019) 3:882-6. doi: 10.1210/js.2018-00406
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Pereira MC, Vieira MM, Vieira MM, Pereira JS, Salgado D. Adipsia la un pacient cu diabet insipid. Case Rep Oncol. (2015) 8:385-8. doi: 10.1159/000440611
PubMed Abstract | Full Text | Google Scholar
30. Zhang Y, Wang D, Wang D, Feng Y, Zhang W, Zeng X. Gută cu debut juvenil și diabet insipid adipos: un raport de caz și o revizuire a literaturii. J Int Med Res. (2018) 46:4829-36. doi: 10.1177/0300060518800114
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Latcha S, Lubetzky M, Lubetzky M, Weinstein AM. Hiperosmolaritate severă și hipernatremie la o tânără adipoasă. Clin Nephrol. (2011) 76:407-11. doi: 10.5414/CN106617
PubMed Abstract | Full CrossRef Text | Google Scholar
32. Sherlock M, Agha A, Crowley R, Smith D, Thompson CJ. Diabetul insipid adipsic în urma unei intervenții chirurgicale hipofizare pentru un macroprolactinom. Pituitară. (2006) 9:59-64. doi: 10.1007/s11102-006-8280-x
PubMed Abstract | Reflect Full Text | Google Scholar
33. Hiyama TY, Utsunomiya AN, Matsumoto M, Fujikawa A, Lin CH, Hara K, et al. Hipernatremia adipică fără leziuni hipotalamice însoțită de autoanticorpi la organul subfornical. Brain Pathol. (2017) 27:323-31. doi: 10.1111/bpa.12409
PubMed Abstract | Full Text | Google Scholar
34. Komatsu H, Miyake H, Kakita S, Ikuta H. Hipoplazia corpului calos asociat cu hipernatremie adipică și hipogonadotropinism hipogonadamic: un raport de caz și o revizuire a literaturii. Pediatr Int. (2001) 43:683-7. doi: 10.1046/j.1442-200X.2001.01453.x
PubMed Abstract | CrossRef Full Text | Google Scholar
35. Schaff-Blass E, Robertson GL, Rosenfield RL. Hipernatremia cronică de la un defect congenital în osmoreglarea setei și a vasopresinei. J Pediatr. (1983) 102:703-8. doi: 10.1016/S0022-3476(83)80237-6
PubMed Abstract | CrossRef Full Text | Google Scholar
36. AvRuskin TW, Tang SC, Juan C. Hipernatremia esențială, hormonul antidiuretic și secreția de neurohipofizină: răspuns la clorpropamidă. Acta Endocrinol. (1981) 96:145-53. doi: 10.1530/acta.0.0960145
CrossRef Full Text | Google Scholar
37. Radetti G, Rizza F, Mengarda G, Pittschieler K. Hipernatremia adipică la două surori. Am J Dis Child. (1991) 145:321-5. doi: 10.1001/archpedi.1991.02160030091028
PubMed Abstract | CrossRef Full Text | Google Scholar
38.
. Takeya T, Hamano K, Iwasaki N, Kitazawa R, Tsuji C, Jougamoto M. Un caz de hipernatremie cronică cu agenezie de corp calos. Nippon Shounikagakakkai Zasshi. (1996) 100:1392-5.
Google Scholar
39. O’Reilly MW, Sexton DJ, Dennedy MC, Counihan TJ, Finucane FM, O’Brien T, et al. Remisiune radiologică și recuperarea aprecierii setei după terapia cu infliximab în diabetul insipid adipos secundar neurosarcoidozei. QJM. (2015) 108:657-9. doi: 10.1093/qjmed/hct023
PubMed Abstract | Full CrossRef Text | Google Scholar
40. Duvernoy H, Koritké JG, Monnier G. . Zeitschrift für Zellforschung und mikroskopische Anatomie. (1969) 102:49-77. doi: 10.1007/BF00336416
PubMed Abstract | Text integral | Google Scholar
41. Duvernoy HM, Risold PY. Organele circumventriculare: un atlas de anatomie comparată și vascularizație. Brain Res Rev. (2007) 56:119-47. doi: 10.1016/j.brainresrev.2007.06.002
PubMed Abstract | CrossRef Full Text | Google Scholar
42. Lindgren A, Vergouwen MD, van der Schaaf I, Algra A, Wermer M, Clarke MJ, et al. Endovascular coiling versus clipping neurochirurgical pentru persoanele cu hemoragie subarahnoidiană anevrismală. Cochrane Database Syst Rev. (2018) 8:CD003085. doi: 10.1002/14651858.CD003085.pub3
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Ewout JH, Robert Z. Tulburări ale echilibrului hidric după neurochirurgie: răspunsul trifazic revizuit. NDT Plus. (2010) 3:42-4. doi: 10.1093/ndtplus/sfp117
CrossRef Full Text | Google Scholar
44. Andersson KE, Arner B. Efectele DDAVP, un analog sintetic al vasopresinei, la pacienții cu diabet insipid cranian. Acta Med Scand. (1972) 192:21-7. doi: 10.1111/j.0954-6820.1972.tb04772.x
PubMed Abstract | CrossRef Full Text | Google Scholar
45.
45.
45.
46. Rembratt A, Graugaard-Jensen C, Senderovitz T, Norgaard JP, Djurhuus JC. Farmacocinetica și farmacodinamica desmopresinei administrate oral versus intravenos în timpul zilei versus noaptea la bărbați sănătoși cu vârsta cuprinsă între 55-70 de ani. Eur J Clin Pharmacol. (2004) 60:397-402. doi: 10.1007/s00228-004-0781-9
PubMed Abstract | Reflect Full Text | Google Scholar
46. Vande Walle J, Stockner M, Raes A, Nørgaard JP. Desmopresina 30 de ani de utilizare clinică: o revizuire a siguranței. Curr Drug Saf. (2007) 2:232-8. doi: 10.2174/157488607781668891
PubMed Abstract | Refef Full Text | Google Scholar
47. Yutaka O, Robertson GL, Nørgaard JP, Juul KV. Tratamentul diabetului insipid neurohipofizar. J Clin Endocrinol Metabol. (2013) 98:3958-67. doi: 10.1210/jc.2013-2326
CrossRef Full Text | Google Scholar
48. Fjellestad-Paulsen A, Höglund P, Lundin S, Paulsen O. Farmacocinetica vasopresinei 1-deamino-8-D-arginină după diferite căi de administrare la voluntari sănătoși. Clin Endocrinol. (1993) 38:177-82. doi: 10.1111/j.1365-2265.1993.tb00990.x
CrossRef Full Text | Google Scholar
49. Lam KS, Wat MS, Choi KL, Ip TP, Pang RW, Kumana CR. Farmacocinetica, farmacodinamica, eficacitatea și siguranța pe termen lung a 1-deamino-8-D-arginină vasopresină orală la pacienții adulți cu diabet insipid central. Br J Clin Pharmacol. (1996) 42:379-85. doi: 10.1046/j.1365-2125.1996.39914.x
PubMed Abstract | CrossRef Full Text | Google Scholar
50. Steiner IM, Kaehler ST, Sauermann R, Rinosl H, Muller M, Joukhadar C. Farmacocinetica plasmatică a desmopresinei în urma administrării sublinguale: un studiu exploratoriu de escaladare a dozei la voluntari sănătoși de sex masculin. Int J Clin Pharmacol Ther. (2006) 44:172-9. doi: 10.5414/CPP44172
PubMed Abstract | Full CrossRef Text | Google Scholar
51. De Waele K, Cools M, De Guchtenaere A, Van de Walle J, Raes A, Van Aken S, et al. Desmopressin lyophilisate for the treatment of central diabetes insipidus: first experience in very young infants. Int J Endocrinol Metab. (2014) 12:e16120. doi: 10.5812/ijem.16120
PubMed Abstract | Text integral | Google Scholar
.