Când hidrogenul este legat covalent de un atom foarte electronegativ, cum ar fi fluorul, clorul, oxigenul sau azotul, atomul de H are o sarcină pozitivă parțială, scrisă Hδ+.
Hδ+ este foarte mic din punct de vedere fizic, astfel încât densitatea de sarcină de pe el este neobișnuit de mare.
Imaginați-vă că un alt atom negativ sau electronegativ, să zicem pe o altă moleculă, se apropie de Hδ+;va exista o atracție reciprocă, rezultând o atracție dipol-dipol deosebit de puternică.Această atracție se numește legătură de hidrogen.
În general, legăturile de hidrogen sunt mai slabe decât legăturile ionice și covalente, dar sunt mai puternice decât forțele van der Waals.

Legătura de hidrogen în apă
Cel mai cunoscut exemplu de legătură de hidrogen este apa:
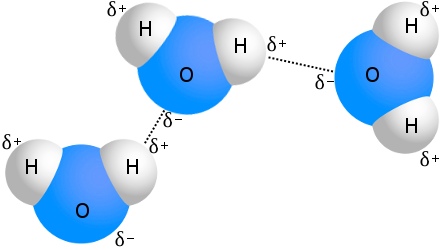
Care moleculă de apă poate fi legată de hidrogen cu până la patru alte molecule de apă.În apă, la temperatura camerei, numărul mediu de legături de hidrogen per moleculă de apă este de 3,6.
Mișcarea termică aleatorie a moleculelor asigură faptul că durata de viață a oricărei legături de hidrogen individuale în apă este scurtă, în medie de numai 10 picosecunde.Cu toate acestea, timpul de formare a unei noi legături este și mai scurt.
Pentru a rupe permanent o singură legătură de hidrogen în apă este nevoie de 21 kJ mol-1, un aport semnificativ de energie.Rezultatul este că punctele de topire și de fierbere ale apei sunt mult mai mari decât ar fi de așteptat pentru o moleculă cu o greutate moleculară atât de mică.
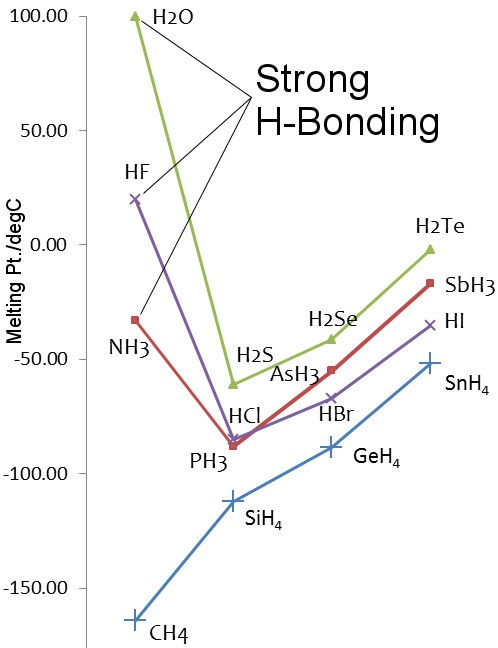
Considerați apa vs. metanul.Moleculele de apă sunt destul de puternic atrase unele de altele prin legături de hidrogen, în timp ce în metan prevalează forțele van der Waals.Astfel, deși masele lor moleculare sunt similare, de 18 pentru apă și 16 pentru metan, proprietățile lor fizice sunt foarte diferite.De exemplu, apa se topește la 0,00 °C și fierbe la 99,98 °C; metanul se topește la -182,5 °C și fierbe la -161,5 °C.
Legătura de hidrogen în apă vs hidrogen sulfurat
Sulfura se află în grupa 16 din tabelul periodic, la fel ca și oxigenul. Sulful este mai greu decât oxigenul, astfel încâtH2S ar trebui să aibă puncte de topire și de fierbere mai ridicate decât H2O.Cu toate acestea, nu este cazul, deoarece sulful este mai puțin electronegativ decât oxigenul și, prin urmare, legătura de hidrogen în H2S este slabă.

Mol. Mass: 16
Pt. de topire: 0,00 °C
Pt. de fierbere: 99,98 °C
Electronegativitatea O (Pauling): 3,44
Entalpia legăturii de hidrogen: 21 kJ mol-1

Mol. Mass: 34
Pt. de topire: -82 °C
Pt. de fierbere: -60 °C
Electronegativitatea lui S (Pauling): 2.58
Entalpia legăturii de hidrogen: ≅ 3 kJ mol-1
Legătura de hidrogen în amoniac și fluorură de hidrogen
Fluorul și azotul sunt elementele cele mai electronegative din grupele lor din tabelul periodic, iar legătura de hidrogen este observată în fluorura de hidrogen și amoniac.
Ca și în cazul apei, punctele de topire și de fierbere ale fluorurii de hidrogen și amoniacului sunt mai ridicate decât cele ale hidrurilor elementelor mai grele din grupele lor.
Punctele de topire ale hidrurilor elementelor din grupa 14-17
Legătura de hidrogen în ADN
Perechile de baze ale ADN-ului leagă cele două lanțuri elicoidale ale acestuia.perechile de baze transportă informația genetică a ADN-ului.
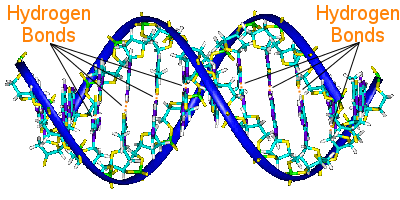
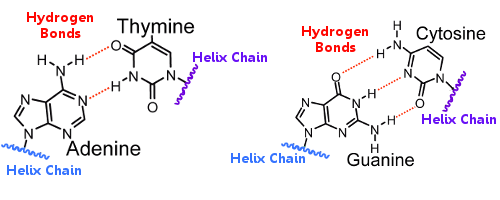
Perechile de baze de pe o helixă sunt legate de perechile de baze de pe cealaltă helixă prin legături de hidrogen.Astfel, legătura de hidrogen ține împreună cele două helixuri, creând faimoasa dublă helixă.
Când ADN-ul se replică, legăturile de hidrogen se rup, permițând celor două helixuri să se despartă.În acest fel, legătura de hidrogen joacă un rol esențial în mecanismul de blocare a perechilor de baze din cadrul replicării ADN-ului.
Legătura de hidrogen în lână
Ca și alte fibre proteice, lâna prezintă legături de hidrogen.Imaginea de mai jos arată cum legăturile de hidrogen (puncte portocalii) leagă spirele lanțului α-helix al lânii (verde).
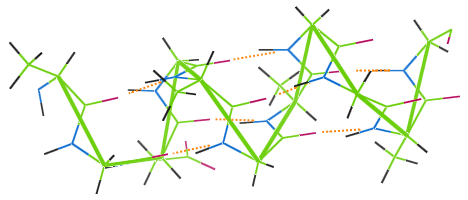
Dacă o haină din lână este spălată la o temperatură ridicată, legăturile de hidrogen sunt distruse, spirele își pierd elasticitatea, iar haina devine neîndestulătoare.

.