Obiective de învățare
- Relaționați configurațiile electronice ale elementelor cu forma tabelului periodic.
- Determinați configurația electronică așteptată a unui element în funcție de locul pe care îl ocupă în tabelul periodic.
În capitolul 3 „Atomi, molecule și ioni”, am prezentat tabelul periodic ca instrument de organizare a elementelor chimice cunoscute. Un tabel periodic este prezentat în figura 8.11 „Tabelul periodic”. Elementele sunt enumerate în funcție de numărul atomic (numărul de protoni din nucleu), iar elementele cu proprietăți chimice similare sunt grupate în coloane.
Figura 8.11 Tabloul periodic
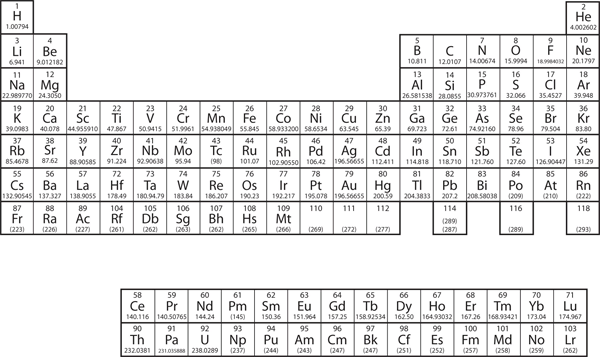
De ce are tabelul periodic structura pe care o are? Răspunsul este destul de simplu, dacă înțelegeți configurațiile electronice: forma tabelului periodic imită umplerea subînvelișurilor cu electroni.
Să începem cu H și He. Configurațiile lor electronice sunt 1s1 și, respectiv, 1s2; în cazul lui He, învelișul n = 1 este umplut. Aceste două elemente alcătuiesc primul rând al tabelului periodic (vezi figura 8.12 „The 1”).
Figura 8.12 Subshell-ul 1s
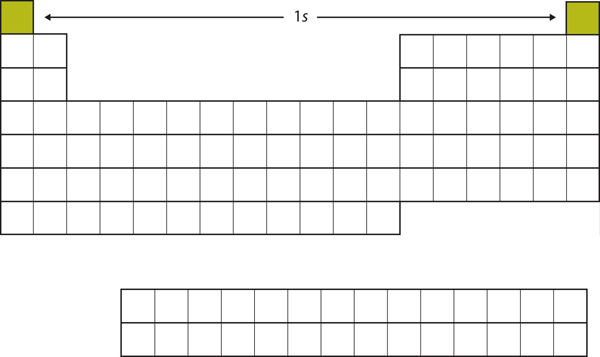
H și He reprezintă umplerea subshell-ului 1s.
Cei doi electroni următori, pentru Li și Be, ar merge în subshell-ul 2s. Figura 8.13 „Cele 2” arată că aceste două elemente sunt adiacente în tabelul periodic.
Figura 8.13 Subshell-ul 2s
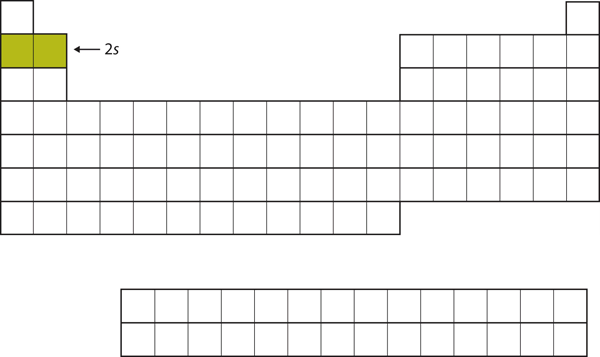
În Li și Be, subshell-ul 2s este umplut.
Pentru următoarele șase elemente, subshell-ul 2p este ocupat cu electroni. În partea dreaptă a tabelului periodic, aceste șase elemente (de la B până la Ne) sunt grupate împreună (figura 8.14 „The 2”).
Figura 8.14 Subshell-ul 2p
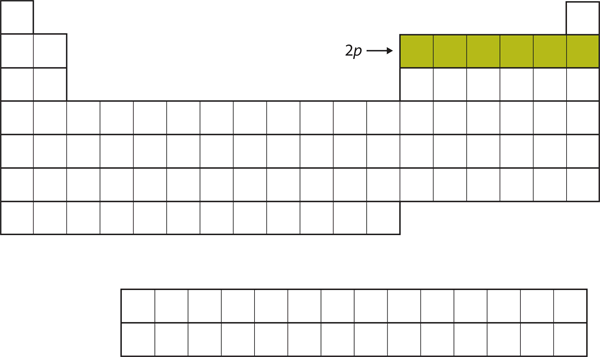
Pentru B până la Ne, subshell-ul 2p este ocupat.
Următorul subshell care se umple este subshell-ul 3s. Elementele când această subshell este ocupată, Na și Mg, se află din nou în partea stângă a tabelului periodic (figura 8.15 „Cei 3”).
Figura 8.15 Subshell-ul 3s
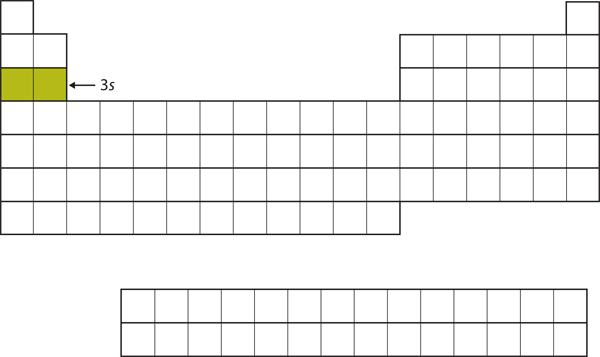
Acum subshell-ul 3s este ocupat.
În continuare, subshell-ul 3p este umplut cu următoarele șase elemente (figura 8.16 „The 3”).
Figura 8.16 Subshell-ul 3p
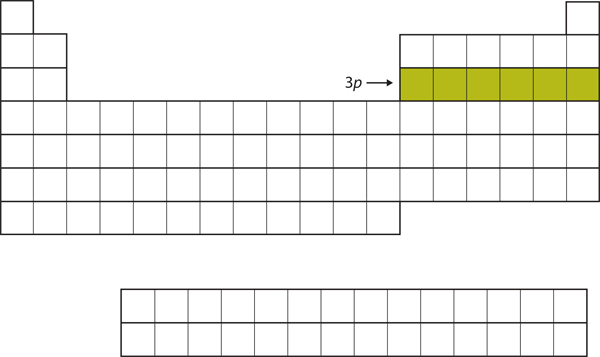
În continuare, subshell-ul 3p este umplut cu electroni.
În loc să umple subshell-ul 3d în continuare, electronii se duc în subshell-ul 4s (Figura 8. „Subshell-ul 3p”).17 „The 4”).
Figura 8.17 Subshell-ul 4s
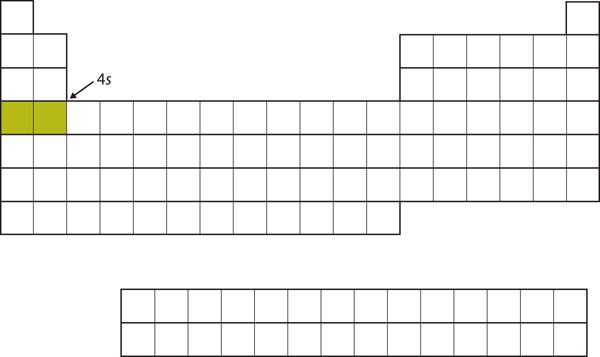
Subshell-ul 4s este umplut înainte de subshell-ul 3d. Acest lucru este reflectat în structura tabelului periodic.
După ce subshell-ul 4s este umplut, subshell-ul 3d este umplut cu până la 10 electroni. Acest lucru explică secțiunea de 10 elemente din mijlocul tabelului periodic (figura 8.18 „The 3”).
Figura 8.18 Subshell-ul 3d
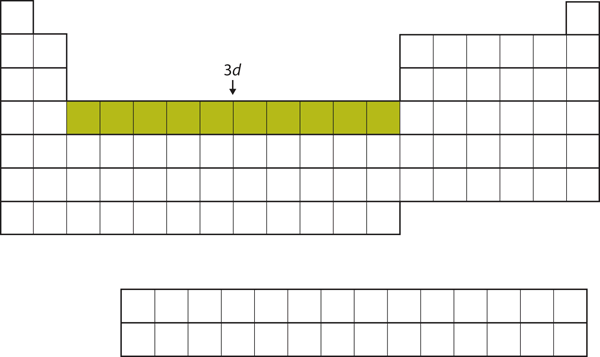
Subshell-ul 3d este umplut în secțiunea de mijloc a tabelului periodic.
Și așa mai departe. Pe măsură ce parcurgem rândurile tabelului periodic, forma generală a tabelului evidențiază modul în care electronii ocupă învelișurile și subînvelișurile.
Primile două coloane din partea stângă a tabelului periodic sunt cele în care sunt ocupate subînvelișurile s. Din acest motiv, primele două rânduri ale tabelului periodic sunt etichetate ca fiind blocul s. În mod similar, blocul p reprezintă cele mai din dreapta șase coloane ale tabelului periodic, blocul d reprezintă cele 10 coloane din mijlocul tabelului periodic, în timp ce blocul f este secțiunea de 14 coloane care este reprezentată în mod normal ca fiind detașată de corpul principal al tabelului periodic. Ar putea face parte din corpul principal, dar atunci tabelul periodic ar fi destul de lung și greoi. Figura 8.19 „Blocuri ale tabelului periodic” prezintă blocurile tabelului periodic.
Figura 8.19 Blocuri ale tabelului periodic
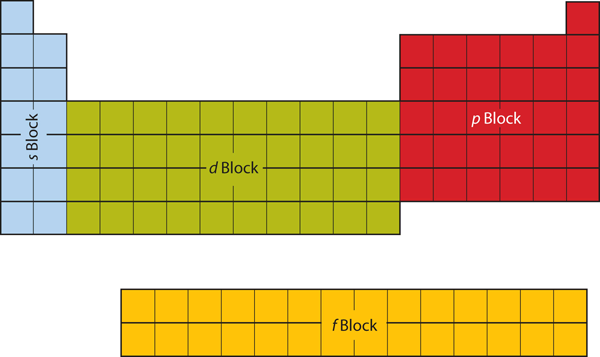
Tabloul periodic este separat în blocuri în funcție de subshell-ul care este umplut pentru atomii care aparțin acelei secțiuni.
Electronii din învelișul cu cel mai mare număr, plus orice electroni din ultimul subînveliș neîmplinit, se numesc electroni de valență; învelișul cu cel mai mare număr se numește înveliș de valență. (Electronii interiori se numesc electroni de nucleu.) Electronii de valență controlează în mare măsură chimia unui atom. Dacă ne uităm doar la configurația electronică a învelișului de valență, constatăm că în fiecare coloană, configurația electronică a învelișului de valență este aceeași. De exemplu, să luăm elementele din prima coloană a tabelului periodic: H, Li, Na, K, Rb și Cs. Configurațiile lor electronice (prescurtate pentru atomii mai mari) sunt următoarele, cu configurația electronică a învelișului de valență evidențiată:
| H: | 1s1 |
| Li: | 1s22s1 |
| Na: | 3s1 |
| K: | 4s1 |
| Rb: | 5s1 |
| Cs: | 6s1 |
Toate acestea au o configurație electronică similară în straturile de valență: un singur electron s. Deoarece o mare parte din chimia unui element este influențată de electronii de valență, ne-am aștepta ca aceste elemente să aibă o chimie similară – și așa este. Organizarea electronilor în atomi explică nu numai forma tabelului periodic, ci și faptul că elementele din aceeași coloană a tabelului periodic au o chimie similară.
Același concept se aplică și celorlalte coloane ale tabelului periodic. Elementele din fiecare coloană au aceleași configurații electronice ale învelișului de valență, iar elementele au unele proprietăți chimice similare. Acest lucru este strict valabil pentru toate elementele din blocurile s și p. În blocurile d și f, deoarece există excepții în ceea ce privește ordinea de umplere a subînvelișurilor cu electroni, învelișurile de valență similare nu sunt absolute în aceste blocuri. Cu toate acestea, există multe similitudini în aceste blocuri, astfel încât este de așteptat o similitudine în proprietățile chimice.
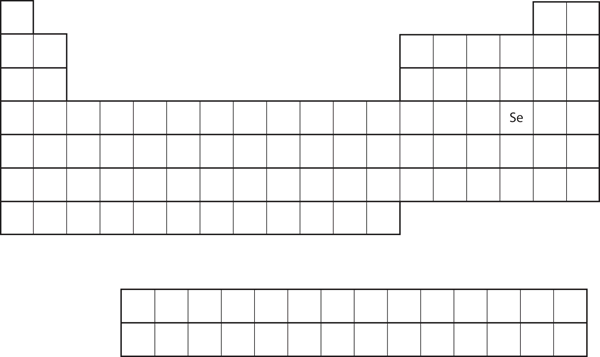
Similitudinea configurației electronice a învelișului de valență implică faptul că putem determina configurația electronică a unui atom numai prin poziția sa în tabelul periodic. Luați în considerare Se, așa cum este prezentat în figura 8.20 „Seleniul în tabelul periodic”. Acesta se află în a patra coloană a blocului p. Acest lucru înseamnă că configurația sa electronică ar trebui să se termine într-o configurație electronică p4. Într-adevăr, configurația electronică a Se este 4s23d104p4, așa cum era de așteptat.
Figura 8.20 Seleniul în tabelul periodic
Exemplul 8
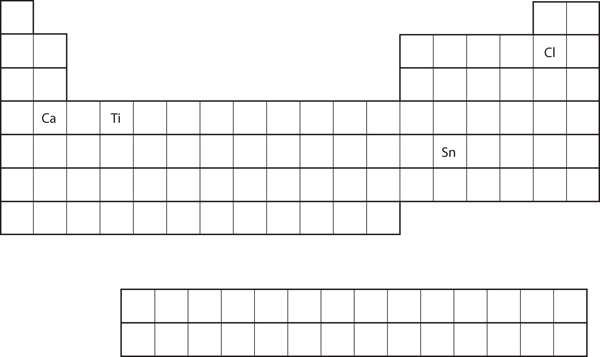
Din poziția elementului în tabelul periodic, preziceți configurația electronică a învelișului de valență pentru fiecare atom. Consultați figura 8.21 „Diverse elemente pe tabelul periodic”.
- Ca
- Sn
Soluție
- Ca se află în a doua coloană a blocului s. Ne-am aștepta ca configurația sa electronică să se termine cu s2. Configurația electronică a calciului este 4s2.
Sn este situat în a doua coloană a blocului p, deci ne așteptăm ca configurația sa electronică să se termine cu p2. Configurația electronică a staniului este 5s24d105p2.
Test Yourself
Din poziția elementului în tabelul periodic, preziceți configurația electronică a învelișului de valență pentru fiecare atom. Consultați figura 8.21 „Diverse elemente din tabelul periodic”.
- Ti
- Cl
Răspuns
- 4s23d2
- 3s23p5
Figura 8.21 Diferite elemente din tabelul periodic
Aplicație pentru alimente și băuturi: Culori artificiale
Culoarea obiectelor provine dintr-un mecanism diferit față de culorile neonului și ale altor lumini cu descărcare. Deși luminile colorate își produc culorile, obiectele sunt colorate pentru că reflectă în mod preferențial o anumită culoare din lumina albă care strălucește asupra lor. O roșie roșie, de exemplu, este roșu aprins pentru că reflectă lumina roșie în timp ce absoarbe toate celelalte culori ale curcubeului.
Multe alimente, cum ar fi roșiile, sunt foarte colorate; de fapt, afirmația comună „mănânci mai întâi cu ochii” este o recunoaștere implicită a faptului că atracția vizuală a alimentelor este la fel de importantă ca și gustul lor. Dar cum rămâne cu alimentele procesate?
Multe alimente procesate au coloranți alimentari adăugați în ele. Există două tipuri de coloranți alimentari: naturali și artificiali. Coloranții alimentari naturali includ zahărul caramelizat pentru maro; annatto, turmericul și șofranul pentru diferite nuanțe de portocaliu sau galben; betanina din sfeclă pentru violet; și chiar carminul, un colorant roșu intens care este extras din coșenilă, o mică insectă care este un parazit pe cactuși în America Centrală și de Sud. (Așa este: s-ar putea să mâncați suc de insecte!)
Câțiva coloranți sunt artificiali. În Statele Unite, Food and Drug Administration aprobă în prezent doar șapte compuși ca coloranți artificiali în alimente, băuturi și produse cosmetice:
- FD&C Albastru #1: Brilliant Blue FCF FD&C Albastru #2: Indigotină FD&C Verde #3: Fast Green FCF RD&C Red #3: Erythrosine FD&C Red #40: Allura Red AC FD&C Yellow #5: Tartrazină FD&C Galben #6: Sunset Yellow FCF
Culoarea cu număr mai mic nu se mai găsește pe piață sau a fost eliminată din diverse motive. În mod obișnuit, acești coloranți artificiali sunt molecule mari care absorb foarte puternic anumite culori de lumină, ceea ce le face utile chiar și la concentrații foarte mici în alimente și produse cosmetice. Chiar și în cantități atât de mici, unii critici susțin că o mică parte a populației (în special copiii) este sensibilă la coloranții artificiali și îndeamnă ca utilizarea lor să fie redusă sau oprită. Cu toate acestea, studiile oficiale privind coloranții artificiali și efectele acestora asupra comportamentului au fost neconcludente sau contradictorii. În ciuda acestui fapt, majoritatea oamenilor continuă să se bucure de alimentele procesate cu coloranți artificiali (precum cele prezentate în figura alăturată).

Coloranții alimentari artificiali se găsesc într-o varietate de produse alimentare, cum ar fi alimentele procesate, bomboanele și coloranții pentru ouă. Chiar și alimentele pentru animale de companie conțin coloranți alimentari artificiali, deși este probabil ca animalului să nu-i pese!
Sursa: Photo courtesy of Matthew Bland, http://www.flickr.com/photos/matthewbland/3111904731.
Key Takeaways
- Dispoziția electronilor în atomi este responsabilă pentru forma tabelului periodic.
- Configurațiile electronice pot fi prezise prin poziția unui atom în tabelul periodic.
Exerciții
-
În ce loc din tabelul periodic sunt ocupate de electroni subcapacele s?
-
În ce loc din tabelul periodic sunt ocupate de electroni subshell-urile d?
-
În ce bloc se găsește Ra?
-
În ce bloc se găsește Br?
-
Care sunt configurațiile electronice ale învelișului de valență ale elementelor din a doua coloană a tabelului periodic?
-
Care sunt configurațiile electronice ale învelișului de valență ale elementelor din penultima coloană a tabelului periodic?
-
Care sunt configurațiile electronice ale învelișului de valență ale elementelor din prima coloană a blocului p?
-
Care sunt configurațiile electronice ale învelișului de valență ale elementelor din ultima coloană a blocului p?
-
Din poziția elementului în tabelul periodic, preziceți configurația electronică a fiecărui atom.
a) Sr
b) S
10. Pornind de la poziția elementului în tabelul periodic, preziceți configurația electronică a fiecărui atom.
a) Fe
b) Ba
11. Pornind de la poziția elementului în tabelul periodic, preziceți configurația electronică a fiecărui atom.
a) V
b) Ar
12. Pornind de la poziția elementului în tabelul periodic, preziceți configurația electronică a fiecărui atom.
a) Cl
b) K
13. Pornind de la poziția elementului în tabelul periodic, preziceți configurația electronică a fiecărui atom.
a) Ge
b) C
14. Pornind de la poziția elementului în tabelul periodic, preziceți configurația electronică a fiecărui atom.
a) Mg
b) I
Răspunsuri
primele două coloane
bloc s
ns27.
ns2np19.
a) 1s22s22p63s23p64s23d104p65s2
b) 1s22s22p63s23p411.
a) 1s22s22s22p63s23s23p64s23d3
b) 1s22s22s22p63s23p613.
a) 1s22s22s22p63s23p64s23d104p2
b) 1s22s22s22p2
.