Obiective de învățare
Până la sfârșitul acestei secțiuni, veți fi capabili să:
- Identificați relațiile matematice dintre diferitele proprietăți ale gazelor
- Utilizați legea combinată a gazelor și legile gazelor înrudite, pentru a calcula valorile diferitelor proprietăți ale gazelor în condiții specificate
În timpul secolelor al XVII-lea și mai ales al XVIII-lea, animați atât de dorința de a înțelege natura, cât și de încercarea de a fabrica baloane în care să poată zbura (figura 1), o serie de oameni de știință au stabilit relațiile dintre proprietățile fizice macroscopice ale gazelor, și anume presiunea, volumul, temperatura și cantitatea de gaz. Deși măsurătorile lor nu erau precise conform standardelor de astăzi, aceștia au reușit să determine relațiile matematice dintre perechile acestor variabile (de exemplu, presiune și temperatură, presiune și volum) care sunt valabile pentru un gaz ideal – o construcție ipotetică pe care gazele reale o aproximează în anumite condiții. În cele din urmă, aceste legi individuale au fost combinate într-o singură ecuație – legea gazului ideal – care relaționează cantitățile de gaze pentru gaze și care este destul de precisă pentru presiuni scăzute și temperaturi moderate. Vom lua în considerare principalele evoluții ale relațiilor individuale (din motive pedagogice, nu chiar în ordine istorică), apoi le vom pune împreună în legea gazului ideal.

Figura 1. În 1783, a avut loc primul (a) zbor cu balonul umplut cu hidrogen, (b) zbor cu balonul cu aer cald cu echipaj uman și (c) zbor cu balonul umplut cu hidrogen cu echipaj uman. Când a aterizat balonul umplut cu hidrogen reprezentat în (a), se pare că sătenii speriați din Gonesse l-au distrus cu furci și cuțite. Lansarea celui de-al doilea ar fi fost vizionată de 400.000 de persoane la Paris.
Presiune și temperatură: Legea lui Gay-Lussac
Imaginați-vă că umpleți cu gaz un recipient rigid atașat la un manometru și apoi sigilați recipientul astfel încât să nu poată scăpa niciun gaz. Dacă recipientul este răcit, gazul din interior se răcește la fel și se observă că presiunea sa scade. Deoarece recipientul este rigid și bine închis, atât volumul, cât și numărul de moli de gaz rămân constante. Dacă încălzim sfera, gazul din interior se încălzește (figura 2) și presiunea crește.

Figura 2. Efectul temperaturii asupra presiunii gazului: Când placa de încălzire este oprită, presiunea gazului din sferă este relativ scăzută. Pe măsură ce gazul este încălzit, presiunea gazului din sferă crește.
Această relație dintre temperatură și presiune se observă pentru orice eșantion de gaz confinat într-un volum constant. În figura 3 este prezentat un exemplu de date experimentale presiune-temperatură pentru un eșantion de aer în aceste condiții. Constatăm că temperatura și presiunea sunt legate liniar, iar dacă temperatura este pe scara kelvin, atunci P și T sunt direct proporționale (din nou, când volumul și molii de gaz sunt menținute constante); dacă temperatura pe scara kelvin crește cu un anumit factor, presiunea gazului crește cu același factor.
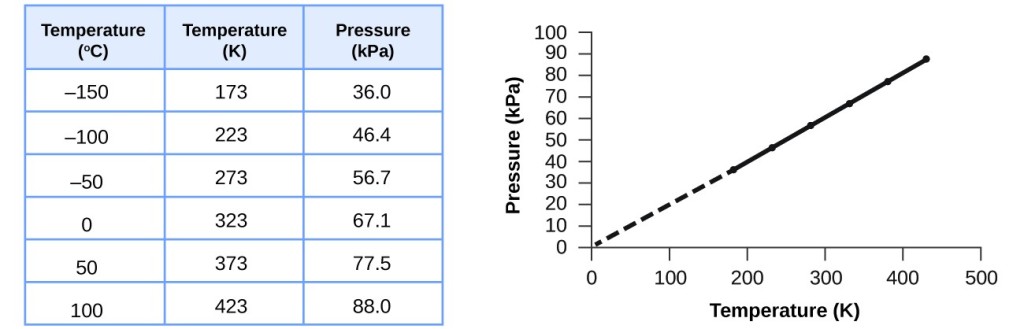
Figura 3. Pentru un volum și o cantitate de aer constante, presiunea și temperatura sunt direct proporționale, cu condiția ca temperatura să fie în kelvin. (Nu se pot face măsurători la temperaturi mai mici din cauza condensării gazului). Când această linie este extrapolată la presiuni mai mici, ea ajunge la presiunea 0 la -273 °C, care este 0 pe scara kelvinilor și cea mai joasă temperatură posibilă, numită zero absolut.
Guillaume Amontons a fost primul care a stabilit în mod empiric relația dintre presiunea și temperatura unui gaz (~1700), iar Joseph Louis Gay-Lussac a determinat această relație mai precis (~1800). Din acest motiv, relația P-T pentru gaze este cunoscută fie ca legea lui Gay-Lussac, fie ca legea lui Amontons. Sub oricare dintre denumiri, aceasta afirmă că presiunea unei anumite cantități de gaz este direct proporțională cu temperatura sa pe scara kelvin, atunci când volumul este menținut constant. Din punct de vedere matematic, aceasta se poate scrie:
\large P\propto T
\large P=\text{constantă}\times T
\large P=k\times T
unde ∝ înseamnă „este proporțională cu”, iar k este o constantă de proporționalitate care depinde de identitatea, cantitatea și volumul gazului.
\large\frac{{{P}_{1}}}{{{T}_{1}}=\frac{{P}}_{2}}{{{T}_{2}}
Această ecuație este utilă pentru calculele de presiune-temperatură pentru un gaz confinat la volum constant. Rețineți că temperaturile trebuie să fie pe scara kelvin pentru orice calcul al legii gazelor (0 pe scara kelvin și cea mai mică temperatură posibilă se numește zero absolut). (Rețineți, de asemenea, că există cel puțin trei moduri în care putem descrie modul în care presiunea unui gaz se modifică pe măsură ce temperatura sa variază: Putem folosi un tabel de valori, un grafic sau o ecuație matematică.)
Volumul și temperatura: Legea lui Charles
Dacă umplem un balon cu aer și îl închidem ermetic, balonul conține o anumită cantitate de aer la presiunea atmosferică, să spunem 1 atm. Dacă punem balonul într-un frigider, gazul din interior se răcește și balonul se micșorează (deși atât cantitatea de gaz, cât și presiunea acestuia rămân constante). Dacă facem balonul foarte rece, acesta se va micșora foarte mult și se va dilata din nou atunci când se încălzește.
Acest videoclip arată cum răcirea și încălzirea unui gaz determină scăderea, respectiv creșterea volumului său.
Aceste exemple ale efectului temperaturii asupra volumului unei cantități date dintr-un gaz confinat la presiune constantă sunt adevărate în general: Volumul crește odată cu creșterea temperaturii și scade odată cu scăderea temperaturii. Datele volum-temperatură pentru o probă de 1 mol de gaz metan la 1 atm sunt enumerate și reprezentate grafic în figura 4.

Figura 4. Volumul și temperatura sunt legate liniar pentru 1 mol de gaz metan la o presiune constantă de 1 atm. Dacă temperatura este în kelvin, volumul și temperatura sunt direct proporționale. Linia se oprește la 111 K deoarece metanul se lichefiază la această temperatură; atunci când este extrapolată, ea intersectează originea graficului, reprezentând o temperatură de zero absolut.
Relația dintre volumul și temperatura unei cantități date de gaz la presiune constantă este cunoscută sub numele de legea lui Charles, în semn de recunoaștere a omului de știință francez și pionier al zborului cu balonul Jacques Alexandre César Charles. Legea lui Charles afirmă că volumul unei cantități date de gaz este direct proporțional cu temperatura sa pe scara kelvin atunci când presiunea este menținută constantă.
Matematic, aceasta poate fi scrisă astfel:
\large V\propto T
\large V=\text{constantă}\cdot T
\large V=k\cdot T
cu k fiind o constantă de proporționalitate care depinde de cantitatea și presiunea gazului.
\frac\frac{{V}_{1}}}{{{T}_{1}}=\frac{{V}}_{2}}{{{T}_{2}}
Volumele și presiunea: Legea lui Boyle
Dacă umplem parțial o seringă etanșă cu aer, seringa conține o anumită cantitate de aer la temperatură constantă, să zicem 25 °C. Dacă împingem încet pistonul înăuntru, menținând temperatura constantă, gazul din seringă este comprimat într-un volum mai mic și presiunea sa crește; dacă tragem pistonul în afară, volumul crește și presiunea scade. Acest exemplu de efect al volumului asupra presiunii unei cantități date de gaz închis este valabil în general. Diminuarea volumului unui gaz izolat va crește presiunea acestuia, iar creșterea volumului său va duce la scăderea presiunii. De fapt, dacă volumul crește cu un anumit factor, presiunea scade cu același factor și viceversa. Datele volumului-presiune pentru o probă de aer la temperatura camerei sunt reprezentate grafic în figura 5.

Figura 5. Când un gaz ocupă un volum mai mic, exercită o presiune mai mare; când ocupă un volum mai mare, exercită o presiune mai mică (presupunând că nu se modifică cantitatea de gaz și temperatura). Deoarece P și V sunt invers proporționale, graficul 1/P vs. V este liniar.
În mod diferit de relațiile P-T și V-T, presiunea și volumul nu sunt direct proporționale între ele. În schimb, P și V prezintă o proporționalitate inversă: Creșterea presiunii duce la o scădere a volumului gazului. Din punct de vedere matematic, acest lucru se poate scrie:
\gros P\propto 1\text{/}V\text{ sau }P=k\cdot 1\text{/}V\text{ sau }P\cdot V=k\text{ sau }{P}_{1}{V}_{1}={P}_{2}{V}_{2}
cu k fiind o constantă. Din punct de vedere grafic, această relație este reprezentată de linia dreaptă care rezultă atunci când se trasează inversul presiunii \large\left(\frac{1}{P}\right) în funcție de volum (V), sau inversul volumului \large\left(\frac{1}{V}\right) în funcție de presiune (V). Graficele cu linii curbe sunt dificil de citit cu acuratețe la valori mari sau mici ale variabilelor și sunt mai dificil de utilizat pentru adaptarea ecuațiilor și parametrilor teoretici la datele experimentale. Din aceste motive, oamenii de știință încearcă adesea să găsească o modalitate de „liniarizare” a datelor lor. Dacă reprezentăm grafic P în funcție de V, obținem o hiperbolă (a se vedea figura 6).
Relația dintre volumul și presiunea unei cantități date de gaz la temperatură constantă a fost publicată pentru prima dată de filozoful naturalist englez Robert Boyle cu peste 300 de ani în urmă. Ea este rezumată în afirmația cunoscută acum sub numele de legea lui Boyle: Volumul unei cantități date de gaz menținut la temperatură constantă este invers proporțional cu presiunea sub care este măsurat.
Chemistry in Action: Respirația și legea lui Boyle
Ce faceți de aproximativ 20 de ori pe minut, toată viața, fără pauză, și adesea fără să fiți conștienți de acest lucru? Răspunsul, desigur, este respirația, sau respirația. Cum funcționează aceasta? Se pare că aici se aplică legile gazelor. Plămânii dumneavoastră absorb gazul de care corpul dumneavoastră are nevoie (oxigen) și scapă de gazele reziduale (dioxid de carbon). Plămânii sunt făcuți din țesuturi spongioase și elastice care se extind și se contractă în timp ce respirați. Atunci când inspirați, diafragma și mușchii intercostali (mușchii dintre coaste) se contractă, extinzând cavitatea toracică și făcând ca volumul plămânilor să fie mai mare. Creșterea volumului duce la o scădere a presiunii (legea lui Boyle). Acest lucru face ca aerul să curgă în plămâni (de la presiune ridicată la presiune scăzută). Când expirați, procesul se inversează: Diafragma și mușchii coastelor se relaxează, cavitatea toracică se contractă, iar volumul plămânilor scade, ceea ce face ca presiunea să crească (legea lui Boyle din nou), iar aerul iese din plămâni (de la presiune ridicată la presiune scăzută). Apoi inspirați și expirați din nou și din nou, repetând acest ciclu al legii lui Boyle pentru tot restul vieții (figura 7).
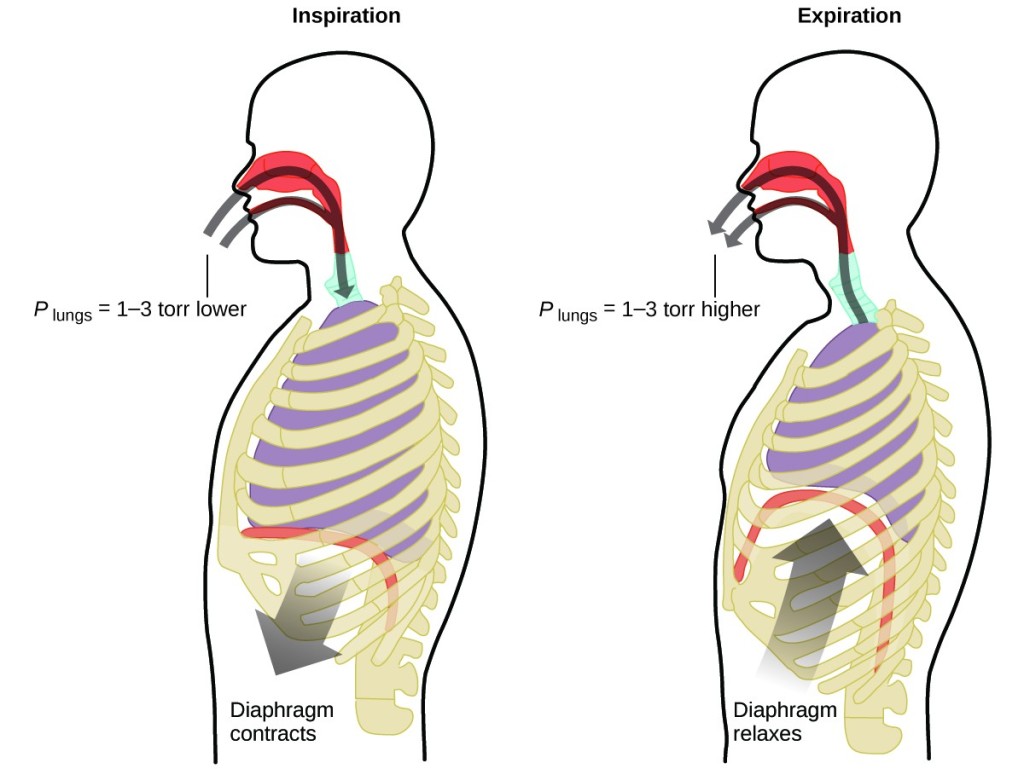
Figura 7. Respirația are loc deoarece expansiunea și contracția volumului plămânilor creează mici diferențe de presiune între plămâni și mediul înconjurător, ceea ce face ca aerul să fie aspirat și forțat să iasă din plămâni.
Moli de gaz și volum: Legea lui Avogadro
Savantul italian Amedeo Avogadro a avansat o ipoteză în 1811 pentru a explica comportamentul gazelor, afirmând că volume egale ale tuturor gazelor, măsurate în aceleași condiții de temperatură și presiune, conțin același număr de molecule. În timp, această relație a fost susținută de numeroase observații experimentale, fiind exprimată prin legea lui Avogadro: Pentru un gaz confinat, volumul (V) și numărul de moli (n) sunt direct proporționale dacă presiunea și temperatura rămân constante.
În formă de ecuație, aceasta se scrie sub forma::
\large\begin{array}{ccccc}V\propto n& \text{or}& V=k\ ori n& \text{or}& \text{or}&. \frac{{{V}_{1}}{{{n}_{1}}=\frac{{V}_{2}}{{{n}_{2}}\end{array}
Relațiile matematice pot fi, de asemenea, determinate pentru celelalte perechi de variabile, cum ar fi P față de n, și n față de T.
Glosar
Zero absolut: temperatura la care volumul unui gaz ar fi zero conform legii lui Charles.
Legea lui Avogadro: volumul unui gaz la temperatură și presiune constante este proporțional cu numărul de molecule de gaz
Legea lui Boyle: volumul unui anumit număr de moli de gaz menținut la temperatură constantă este invers proporțional cu presiunea la care este măsurat
Legea lui Charles: volumul unui număr dat de moli de gaz este direct proporțional cu temperatura kelvin a acestuia atunci când presiunea este menținută constantă
Legea lui Gay-Lussac: (de asemenea, legea lui Amontons) presiunea unui număr dat de moli de gaz este direct proporțională cu temperatura sa kelvin atunci când volumul este menținut constant
.