Chimia apei 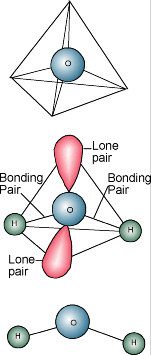 Să știți probabil că descrierea chimică a apei este H2O. O moleculă de apă este formată dintr-un atom de oxigen legat de doi atomi de hidrogen. Atomii de hidrogen sunt „atașați” de o parte a atomului de oxigen, rezultând o moleculă de apă care are o sarcină pozitivă pe partea în care se află atomii de hidrogen și o sarcină negativă pe cealaltă parte, unde se află atomul de oxigen. Deoarece sarcinile electrice opuse se atrag, moleculele de apă tind să se atragă între ele, ceea ce face ca apa să fie oarecum „lipicioasă”. Partea în care se află atomii de hidrogen (sarcină pozitivă) atrage partea cu oxigen (sarcină negativă) a unei alte molecule de apă.
Să știți probabil că descrierea chimică a apei este H2O. O moleculă de apă este formată dintr-un atom de oxigen legat de doi atomi de hidrogen. Atomii de hidrogen sunt „atașați” de o parte a atomului de oxigen, rezultând o moleculă de apă care are o sarcină pozitivă pe partea în care se află atomii de hidrogen și o sarcină negativă pe cealaltă parte, unde se află atomul de oxigen. Deoarece sarcinile electrice opuse se atrag, moleculele de apă tind să se atragă între ele, ceea ce face ca apa să fie oarecum „lipicioasă”. Partea în care se află atomii de hidrogen (sarcină pozitivă) atrage partea cu oxigen (sarcină negativă) a unei alte molecule de apă.
Toate aceste molecule de apă care se atrag între ele înseamnă că tind să se aglomereze. Acesta este motivul pentru care picăturile de apă sunt, de fapt, picături! Dacă nu ar fi fost pentru unele forțe ale Pământului, cum ar fi gravitația, o picătură de apă ar avea forma unei bile – o sferă perfectă. Chiar dacă nu formează o sferă perfectă pe Pământ, ar trebui să ne bucurăm că apa este lipicioasă.
Apa este numită „solventul universal”, deoarece dizolvă mai multe substanțe decât orice alt lichid. Acest lucru înseamnă că oriunde merge apa, fie prin sol, fie prin corpul nostru, ea ia cu ea substanțe chimice, minerale și nutrienți valoroși.
Apa pură are un pH neutru. Apa pură are un pH, de aproximativ 7, care nu este nici acid, nici bazic.
Proprietățile fizice ale apei:
Apa este unică prin faptul că este singura substanță naturală care se găsește în toate cele trei stări – lichid, solid (gheață) și gaz (abur) – la temperaturile întâlnite în mod normal pe Pământ. Apa de pe Pământ este în mod constant în interacțiune, în schimbare și în mișcare.
 Apa îngheață la 32° Fahrenheit (F) și fierbe la 212° F. De fapt, punctele de îngheț și de fierbere ale apei sunt linia de bază cu care se măsoară temperatura: 0° pe scara Celsius este punctul de îngheț al apei, iar 100° este punctul de fierbere al apei. Apa este neobișnuită prin faptul că forma solidă, gheața, este mai puțin densă decât forma lichidă, motiv pentru care gheața plutește.
Apa îngheață la 32° Fahrenheit (F) și fierbe la 212° F. De fapt, punctele de îngheț și de fierbere ale apei sunt linia de bază cu care se măsoară temperatura: 0° pe scara Celsius este punctul de îngheț al apei, iar 100° este punctul de fierbere al apei. Apa este neobișnuită prin faptul că forma solidă, gheața, este mai puțin densă decât forma lichidă, motiv pentru care gheața plutește.
Apa are un indice de căldură specifică ridicat. Acest lucru înseamnă că apa poate absorbi multă căldură înainte de a începe să se încălzească. Acesta este motivul pentru care apa este valoroasă pentru industrii și în radiatorul mașinii dumneavoastră ca agent de răcire. Indicele termic specific ridicat al apei ajută, de asemenea, la reglarea vitezei cu care aerul își schimbă temperatura, motiv pentru care schimbarea de temperatură între anotimpuri este mai degrabă treptată decât bruscă, în special în apropierea oceanelor.
Apa are o tensiune superficială foarte mare. Cu alte cuvinte, apa este lipicioasă și elastică și tinde să se adune în picături mai degrabă decât să se împrăștie într-o peliculă subțire. Tensiunea superficială este responsabilă de acțiunea capilară, care permite apei (și substanțelor sale dizolvate) să se deplaseze prin rădăcinile plantelor și prin micile vase de sânge din corpul nostru.
Temperatura apei:
Temperatura apei nu este importantă doar pentru înotători și pescari, ci și pentru industrii și chiar pentru pești și alge. O mare cantitate de apă este folosită pentru răcire în centralele electrice care generează energie electrică. Acestea au nevoie de apă rece pentru a începe și, în general, eliberează apă mai caldă înapoi în mediul înconjurător. Temperatura apei eliberate poate afecta habitatele din aval. De asemenea, temperatura poate afecta capacitatea apei de a reține oxigenul, precum și capacitatea organismelor de a rezista la anumiți poluanți.
pH:
pH este o măsură a gradului de aciditate/bază a apei. Intervalul merge de la 0 – 14, 7 fiind neutru. Un pH mai mic de 7 indică aciditate, în timp ce un pH mai mare de 7 indică o bază. pH-ul este de fapt o măsură a cantității relative de ioni de hidrogen și hidroxil liberi din apă. Apa care are mai mulți ioni de hidrogen liberi este acidă, în timp ce apa care are mai mulți ioni de hidroxil liberi este bazică. Deoarece pH-ul poate fi afectat de substanțele chimice din apă, pH-ul este un indicator important al apei care se schimbă din punct de vedere chimic. pH-ul este raportat în „unități logaritmice”, la fel ca scara Richter, care măsoară cutremurele. Fiecare număr reprezintă o schimbare de 10 ori a acidității/bazicității apei. Apa cu un pH de 5 este de zece ori mai acidă decât apa care are un pH de șase.
Poluarea poate schimba pH-ul unei ape, ceea ce, la rândul său, poate dăuna animalelor și plantelor care trăiesc în apă. De exemplu, apa care iese dintr-o mină de cărbune abandonată poate avea un pH de 2, care este foarte acidă și ar afecta cu siguranță orice pește suficient de nebun să încerce să trăiască în ea! Utilizând scara logaritmică, această apă de drenaj din mină ar fi de 100.000 de ori mai acidă decât apa neutră – așa că stați departe de minele abandonate.
Conductanța specifică:
Conductanța specifică este o măsură a capacității apei de a conduce un curent electric. Ea depinde în mare măsură de cantitatea de solide dizolvate (cum ar fi sarea) din apă. Apa pură, cum ar fi apa distilată, va avea o conductanță specifică foarte scăzută, iar apa de mare va avea o conductanță specifică ridicată. Apa de ploaie dizolvă adesea gazele și praful în suspensie în timp ce se află în aer și, prin urmare, are adesea o conductanță specifică mai mare decât apa distilată. Conductanța specifică este o măsurătoare importantă a calității apei, deoarece oferă o idee bună despre cantitatea de material dizolvat în apă.
Probabil că la școală ați făcut experimentul în care conectați o baterie la un bec și treceți două fire de la baterie într-un pahar cu apă. Când firele sunt puse într-un pahar cu apă distilată, becul nu se aprinde. Însă, becul se aprinde atunci când paharul conține apă sărată (salină). În apa salină, sarea s-a dizolvat, eliberând electroni liberi, iar apa va conduce un curent electric.
Turbiditatea:
Turbiditatea este o măsură a turbidității apei. Se măsoară prin trecerea unui fascicul de lumină prin apă și observarea cantității de lumină reflectată de particulele din apă. Nebulozitatea apei este cauzată de materiale, cum ar fi murdăria și reziduurile de la frunze, care sunt în suspensie (plutesc) în apă. Apa limpede ca cristalul, cum ar fi Lacul Tahoe (unde se lucrează din greu pentru a împiedica sedimentele să ajungă în lac) are o turbiditate foarte scăzută. Dar uitați-vă la un râu după o furtună – probabil că este maro. Vedeți tot solul suspendat în apă. Din fericire pentru noi, materialele care cauzează turbiditatea în apa noastră potabilă fie se depun, fie sunt filtrate înainte ca apa să ajungă în paharul nostru de băut de acasă. Turbiditatea se măsoară în unități nefelometrice de turbiditate (NTU).
Oxigen dizolvat:
Deși moleculele de apă conțin un atom de oxigen, acest oxigen nu este cel de care au nevoie organismele acvatice care trăiesc în apele noastre naturale. O cantitate mică de oxigen, până la aproximativ zece molecule de oxigen la un milion de apă, este de fapt dizolvată în apă. Acest oxigen dizolvat este respirat de pești și de zooplancton și este necesar pentru ca aceștia să supraviețuiască.
Apa care se mișcă rapid, cum ar fi într-un pârâu de munte sau un râu mare, tinde să conțină mult oxigen dizolvat, în timp ce apa stagnantă conține puțin. Procesul prin care bacteriile din apă ajută la descompunerea materiei organice, cum ar fi cea care provine de la o stație de epurare a apelor uzate, consumă oxigen. Astfel, excesul de materie organică din lacurile și râurile noastre poate determina apariția unei situații de deficit de oxigen. Viețuitoarele acvatice pot avea dificultăți în apele stagnante în care se află multă materie organică în putrefacție, în special vara, când nivelurile de oxigen dizolvat sunt la un nivel scăzut sezonier.
Duritate:
Cantitatea de calciu și magneziu dizolvate în apă determină „duritatea” acesteia. Duritatea apei variază pe întreg teritoriul Statelor Unite. Dacă locuiți într-o zonă în care apa este „moale”, atunci este posibil să nu fi auzit niciodată de duritatea apei. Dar, dacă locuiți în Florida, New Mexico, Arizona, Utah, Wyoming, Nebraska, Dakota de Sud, Iowa, Wisconsin sau Indiana, unde apa este relativ dură, este posibil să observați că este dificil să faceți spumă atunci când vă spălați pe mâini sau pe haine. În plus, este posibil ca industriile din zona dvs. să fie nevoite să cheltuiască bani pentru a-și deduriza apa, deoarece apa dură poate deteriora echipamentele. Apa dură poate chiar scurta durata de viață a țesăturilor și a hainelor! Înseamnă asta că studenții care locuiesc în zone cu apă dură țin pasul cu ultima modă, deoarece hainele lor se uzează mai repede?
Sedimentele în suspensie:
Sedimentele în suspensie reprezintă cantitatea de sol care se deplasează pe un curs de apă. Aceasta depinde foarte mult de viteza de curgere a apei, deoarece apa care curge rapid poate ridica și pune în suspensie mai mult sol decât apa calmă. În timpul furtunilor, solul este spălat de pe malurile cursului de apă în pârâu. Cantitatea care este spălată într-un curs de apă depinde de tipul de teren din bazinul hidrografic al râului și de vegetația care înconjoară râul.
Dacă terenul este perturbat de-a lungul unui curs de apă și nu se iau măsuri de protecție, atunci excesul de sedimente poate afecta calitatea apei unui curs de apă. Probabil că ați văzut acele garduri scurte, din plastic, pe care constructorii le montează la marginea proprietății pe care o dezvoltă. Aceste garduri de nămol ar trebui să rețină sedimentele în timpul unei ploi torențiale și să le împiedice să ajungă într-un curs de apă, deoarece excesul de sedimente poate dăuna pârâurilor, râurilor, lacurilor și rezervoarelor.
Sedimentele care ajung într-un rezervor sunt întotdeauna o preocupare; odată intrate, nu mai pot ieși – majoritatea se vor depune pe fundul acestuia. Rezervoarele se pot „înnămoli” dacă prea multe sedimente intră în ele. Volumul rezervorului este redus, ceea ce are ca rezultat o suprafață mai mică pentru plimbări cu barca, pescuit și recreere, precum și reducerea capacității de producere a energiei a centralei electrice din baraj.
Geochimia soluțiilor apoase:
Observați o diagramă a ciclului hidrogeochimic.
- Acid = substanță care conține hidrogen și care dă hidrogen liber (H + ) la dizolvarea în apă
- Bază = substanță care conține grupa OH și care dă (OH – ) liber la dizolvarea în apă
-
O soluție acidă este cea care conține un exces de H + liber, iar o bază este cea care conține un exces de OH – liber. O reacție între un acid și o bază se numește, de obicei, neutralizare.
De exemplu:
-
HCl (acid) + NaOH (bază) ==> H 2 O + NaCl
care se disociază în ioni:
H + + Cl – + Na + + + OH – ==> H 2 O + Na + + + Cl – - adică Na + și Cl – nu sunt afectați.
- pH = log invers al concentrației (activității) de H + liber, sau pH = -log
-
Apa se disociază în H + și OH – ;
-
constanta de disociere este:
-
: K apă = = =10 -14
- Deci, trebuie să existe 10 -7 moli de H+ și OH – într-un kilogram de soluție neutră la temperatura standard de 25°C. Un mol reprezintă 6,023 x 10 23 atomi (sau molecule), iar H 2 O are o greutate moleculară de 18 grame pe mol. Un kilogram de apă are aproximativ 1000/18 = 55,6 moli de apă sau aproximativ 3,35 x 10 25 atomi de oxigen și aproximativ de două ori acest număr (6,7 x 10 25 atomi) de H + (cantitatea de H + liber sau OH – liber este relativ mică în comparație cu cantitatea de H 2 O nedisociat).
- pH-ul variază, la 25°C, între 0 și 14; pH < 7 = soluție acidă; pH > 7 = soluție bazică. Dacă se adaugă HCl sau un alt acid, atunci pH-ul scade; dacă se adaugă NaOH sau o altă bază, atunci pH-ul crește.
- pH-ul crește pe măsură ce acidul carbonic (un acid slab) se disociază: Atunci când dioxidul de carbon se combină cu apa, așa cum se întâmplă în atmosferă la arderea combustibililor fosili, se formează acidul carbonic: H 2 O + CO 2 ==> H 2 CO 3 . H + liberi sunt puși la dispoziție în timpul disocierilor succesive:
-
H 2 CO 3 ==> H + + HCO 3- acid carbonic în bicarbonat, apare la pH ~6,4
-
HCO 3 ==> H + + CO 32- bicarbonat în carbonat, apare la pH ~10.3
Rețineți, H + liber este disponibil numai atunci când este acid, sau când pH < ~7. Disocierea bicarbonatului în carbonat are loc atunci când există prea mult OH – în sistem și H + este „eliberat” pentru a echilibra baza.
- Cationi și anioni dizolvați în apă
Cationi = donatori de electroni, încărcați pozitiv: Na + , K + , Mg ++ , Ca ++ , Fe ++ sau Fe +++ , Mn ++ , Al +++
Anioni = acceptori de electroni, încărcați negativ: Cl – , F – , F – , I – , Br – , SO 4– , CO 3– , HCO 3- , NO 3– , NO 2-
Metale = se comportă ca și cationii în principal: Cu, Zn, Pb, Co, Ni, Cr, As, Se, Mo, etc.
- Analize de apă – Necesitatea de a avea un bilanț cationi-anioni
millequivalent (MEQ) = sarcină echivalentă molară sau anion sau cation, măsură a sarcinii totale datorate ionului în cauză dizolvat în soluție. Se pornește de la concentrație, se împarte la greutatea molară, se înmulțește cu sarcina: XX mg/L / MW x CHG = MEQ
Exemplu: NaCl în soluție, Na = 50 mg/L (50 ppm): 50/23 x 1 = 2,17 MEQ
Cl = 77 mg/L (77 ppm): 77/35,5 x -1 = -2,17 MEQ
Așadar, dacă MEQ-urile totale ale cationilor și anionilor nu sunt echilibrate, există o anumită eroare în analiză.