INTRODUCERE
Hipercolesterolemia familială heterozigotă (HF) este o tulburare genetică frecventă asociată cu boala cardiovasculară aterosclerotică prematură (ASCVD). Copiii cu FH netratată prezintă un risc crescut de ASCVD prematură după vârsta de 20 de ani.1 Ridicarea severă a nivelului de colesterol al lipoproteinelor cu densitate scăzută (LDL-C) începe încă de la făt și duce la expunerea susținută a peretelui arterial la LDL-C, ceea ce accelerează depunerea de colesterol și inflamația vasculară și predispune la inițierea precoce a aterosclerozei, în special în arterele coronare și aortă.
Statinele și alte terapii de scădere a lipidelor (LLT) reduc eficient LDL-C, sunt sigure la copii și adolescenți și restabilesc funcția endotelială la o vârstă fragedă.2-4 Recent, a fost propus un screening universal al copiilor începând cu vârsta de 2 ani și înainte de vârsta de 8 ani5,6 pentru a detecta persoanele care necesită tratament. Cu toate acestea, această abordare se bazează pe considerente teoretice și nu a fost dovedită în viața reală.
Cu toate acestea, se cunosc puține lucruri despre caracteristicile pacienților cu HF mai tineri de 18 ani, despre LLT utilizate la acești pacienți și despre obiectivele lipidice atinse în viața reală. Deficitul de informații este și mai mare pentru datele de urmărire. Registrele naționale pot fi utilizate pentru a furniza aceste informații cruciale, care sunt necesare pentru a îmbunătăți modelele de îngrijire pentru FH, protocoalele terapeutice și politica de sănătate.7,8 SpAnish Familial HypErcHolEsterolaemiA CohoRt STudy (SAFEHEART) (NCT02693548) a fost conceput pentru a îmbunătăți cunoașterea factorilor de prognostic și a mecanismelor care influențează dezvoltarea ASCVD și mortalitatea la o populație cu FH.
Obiectivul nostru a fost de a analiza caracteristicile pacienților și de a evalua obiectivele LLT și lipidice la includere și în timpul urmăririi la pacienții cu FH mai tineri de 18 ani înrolați în SAFEHEART și de a determina factorii care prezic probabilitatea atingerii acestor obiective.
MetodologiaStudiul și populația
SAFEHEART este un studiu de cohortă deschis, multicentric, la nivel național, prospectiv pe termen lung, într-o populație de FH definită molecular în Spania. Recrutarea participanților din familiile cu FH a început în 2004 și este încă în curs de desfășurare. Criteriile de includere au fost cazurile indexate cu un diagnostic genetic de FH și rudele lor mai mari de 15 ani cu un diagnostic genetic de FH, precum și rudele lor fără un diagnostic genetic de FH (grup de control). Cu toate acestea, participanții mai tineri de 15 ani au fost, de asemenea, înrolați, dacă părinții lor au solicitat acest lucru. Acest studiu a fost aprobat de către comitetele locale de etică. Toți indivizii eligibili și/sau cel puțin 1 dintre părinții sau tutorii legali ai acestora și-au dat consimțământul informat în scris. Un centru de coordonare cu sediul în Madrid, Spania, a fost responsabil pentru gestionarea urmăririi participanților. Pacienții și/sau părinții acestora au fost contactați anual cu ajutorul unui apel telefonic standardizat pentru a înregistra modificările relevante ale obiceiurilor de viață și ale medicamentelor, precum și orice evenimente cardiovasculare sau alte probleme medicale. Medicii participanți care înrolau pacienți și familii în acest registru au beneficiat de formare, cu orientări privind cele mai bune practici consolidate în cadrul unor întâlniri anuale la care au participat medici experți în domeniu; în plus, au fost utilizate un program electronic și consiliere telefonică și a fost implementat un program de formare pe internet pentru a sprijini și mai mult managementul atunci când a fost necesar. Deciziile de tratament au fost luate exclusiv de către medicul fiecărui pacient.
Măsuri clinice și de laborator
Caracteristicile demografice și clinice au fost înregistrate așa cum sunt descrise în altă parte.9 Probele de sânge venos au fost prelevate după 12 ore de post. Probele de ser, plasmă și ADN au fost alicotate și conservate la -80°C. Nivelurile serice ale colesterolului total, trigliceridelor și ale colesterolului cu lipoproteine de înaltă densitate (HDL-C) au fost măsurate într-un laborator central prin metode enzimatice. Concentrația serică de LDL-C a fost calculată cu ajutorul formulei Friedewald. ADN-ul a fost izolat din sângele integral prin metode standard, iar FH a fost diagnosticată genetic cu ajutorul unui microarray de ADN.10 Obiectivele LDL-C au fost definite în conformitate cu recomandările și obiectivele recente. Colesterolul lipoproteic cu densitate scăzută
mg/dL a fost obiectivul principal.11 Un obiectiv alternativ pentru pacienții cu vârsta mai mică de 14 ani a constat în LDL-C mg/dL în absența oricăror alți factori de risc cardiovascular (fumat, HDL-C mg/dL, lipoproteină (a) > 50mg/dL sau LDL-C > 250mg/dL) sau a bolilor cardiovasculare premature la progenitori sau bunici.6 ASCVD prematură familială prematură a fost definită ca fiind apariția unui prim eveniment înainte de 55 de ani la bărbați și înainte de 65 de ani la femei.Clasificarea terapiei hipolipemiante
Doza maximă de statine a fost definită ca fiind atorvastatină 40-80mg/d sau rosuvastatină 20-40mg/d, care au fost considerate doze de statine de intensitate ridicată. Terapia combinată maximă a fost definită ca fiind doza maximă de statine plus ezetimibe 10mg/d. LLT maximă a fost definită ca orice LLT care se aștepta să producă o reducere de cel puțin 50% a nivelurilor inițiale ale LDL-C: simvastatin 20, 40 sau 80mg/d plus ezetimibe 10mg/d; pravastatin 40mg/d în combinație cu ezetimibe 10mg/d; fluvastatin 80mg/d plus ezetimibe 10mg/d; atorvastatin 40 sau 80mg/d cu sau fără ezetimibe 10mg/d; atorvastatin 10 sau 20mg/d plus ezetimibe 10mg/d; rosuvastatin 20 sau 40mg/d cu sau fără ezetimibe 10mg/d; rosuvastatin 10mg/d plus ezetimibe 10mg/d; și pitavastatin 4mg/d în combinație cu ezetimibe 10mg/d.12,13
Analiză genetică
Mutațiile receptorului de colesterol al lipoproteinelor cu densitate scăzută (LDLR) au fost clasificate în funcție de efectul lor cunoscut asupra funcției proteinei receptorului LDL ca mutații nule (receptor-negativ) și defectuoase (receptor-defectuos), așa cum a fost descris anterior.14 Variantele care conduc la absența completă sau trunchierea proteinei (pierderea funcției), demonstrată prin analiză funcțională in vitro sau analiză de simulare pe calculator, au fost clasificate ca receptor-negativ. Aceste variante au inclus următoarele: a) mutații punctiforme care cauzează un codon de oprire prematură; b) mutații missense care afectează a cincea repetiție bogată în cisteină în domeniul de legare a ligandului din gena receptorului LDL-C (mutație de clasă 2A); c) mici deleții sau inserții care cauzează o deplasare de cadru și un codon de oprire prematură; și d) rearanjamente mari. Mutațiile defectuoase pentru receptori au fost restul mutațiilor punctiforme inframe și micile deleții și inserții inframe. Toate mutațiile fără o analiză a funcționalității cunoscute prin intermediul studiilor in vitro sau al analizelor de simulare pe calculator au fost clasificate ca „funcționalitate necunoscută”, deoarece nu am putut fi siguri dacă efectul asupra receptorului era negativ sau defectuos; cu toate acestea, ele au fost considerate patogene deoarece toți indivizii purtători ai uneia dintre aceste mutații au avut hipercolesterolemie, în timp ce rudele fără mutație au avut niveluri normale de colesterol.14
Analiză statistică
Analizele statistice au fost efectuate cu ajutorul SPSS versiunea 18.0 (SPSS Inc, Chicago, Illinois, Statele Unite). Normalitatea distribuției variabilelor a fost analizată cu ajutorul testului Kolmogorov-Smirnov. Datele cantitative sunt exprimate ca mediană și interval intercuartil (IQR), iar cele calitative ca număr absolut și procent. Au fost definite două populații: populația la intrare (n = 241) și populația la urmărire (cunoscută și sub numele de cohortă), care a inclus acei pacienți care au avut un profil lipidic plasmatic complet la urmărire (n = 217). Toate comparațiile între intrare și urmărire au fost efectuate în studiul de cohortă. Comparațiile de frecvențe între variabilele calitative au fost efectuate cu ajutorul testului chi pătrat. Modificările variabilelor binare au fost analizate prin testul McNemar. Valorile mediane ale variabilelor cantitative au fost comparate cu testul nonparametric Mann-Whitney sau cu testul de rang cu semnătură Wilcoxon împerecheat, după caz. În cadrul studiului de cohortă a fost efectuată o analiză de regresie logistică binară directă pentru a determina variabilele asociate cu utilizarea de statine. Am inclus variabilele care au fost semnificative din punct de vedere statistic în analizele univariate, precum și predictorii și factorii de confuzie a priori: vârsta, sexul și urmărirea într-un cadru primar/specializat. O altă analiză de regresie logistică binară directă a fost efectuată în studiul de cohortă, excluzând acei pacienți care au atins obiectivul la intrare, pentru a determina variabilele asociate cu atingerea LDL-C
mg/dL. Am inclus variabilele care au fost semnificative din punct de vedere statistic în analizele univariate, precum și predictorii și factorii de confuzie a priori: vârsta, sexul, tipul de mutație (nulă sau defectuoasă), utilizarea de ezetimibe și urmărirea într-un cadru primar/specializat. Diferențele au fost considerate semnificative din punct de vedere statistic la P REZULTATE
Până în prezent, 4141 de participanți au fost înrolați în registrul SAFEHEART; 392 sunt mai tineri de 18 ani. Dintre aceștia, 241 au o confirmare moleculară a FH, iar 217 au fost urmăriți cu un profil lipidic complet (90,0%) (Figura 1). Douăzeci și patru de pacienți au fost omisi din analiză din cauza lipsei unui profil lipidic complet la urmărire. Urmărirea a avut loc într-un cadru de îngrijire primară pentru 40 de pacienți (18,4 %). Timpul median de urmărire a fost de 4,69 ani (IQR, 2,48-6,38 ani).
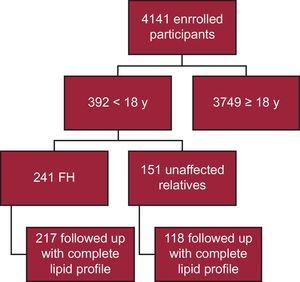
Flowchart schematică a studiului. FH, hipercolesterolemie familială.
La înrolare (populația de intrare), 129 de pacienți cu FH (53,5%) au fost de sex masculin. Vârsta mediană a fost de 15,0 ani (IQR, 14,0-16,0 ani). Cei mai tineri 2 pacienți aveau 8 ani. Istoricul de ASCVD nu a fost prezent la niciun pacient, iar ASCVD familial prematur a fost prezent la 40 (16,6%). Caracteristicile de bază sunt reprezentate în tabelul 1. O comparație a caracteristicilor de bază la includere între pacienții din cohortă și cei care nu au fost urmăriți este prezentată în Tabelul 1. Nu s-au constatat diferențe semnificative între cele 2 grupuri. Niciun pacient nu a avut antecedente de ASCVD, hipertensiune arterială sau diabet zaharat. O proporție mai mare din grupul fără urmărire a fost gestionată în cadrul asistenței medicale primare, deși diferența nu a fost semnificativă din punct de vedere statistic. În cadrul cohortei, au existat reduceri semnificative ale concentrațiilor plasmatice de colesterol total, LDL-C, trigliceride și non-HDL-C; de asemenea, s-a observat o creștere semnificativă a HDL-C la urmărire (tabelul 2).
Caracteristicile de bază ale populației la intrare
| Pacienți cu HF cu urmărire Mediana (IQR)/nr. (%) |
Pacienți cu FH fără urmărire Mediana (IQR)/nr. (%) |
P | ||
|---|---|---|---|---|
| Nr. | 217 | 24 | ||
| Sexul (masculin) | 117 (53,9%) | 12 (50%) | .72 | |
| Vârsta, y | 15.0 (14.0-16.0) | 15.0 (13.0-15.8) | .06 | |
| Prematuritate familiară ASCVD | 36 (16.6%) | 4 (16.7%) | 1.00 | |
| Fumător activ de tutun | 13 (6,0%) | 2 (8,3%) | .65 | |
| Xantome | 1 (0,5%) | 0 (0,0%) | .99 | |
| Arcul corneal | 6 (2,8%) | 1 (4,2%) | .53 | |
| BMI, kg/m2 | 21,09 (19,40-22,80) | 20,79 (17,80-22,70) | .64 | |
| Circumferința taliei, cm | 72.0 (66.0-78.0) | 72.0 (66.0-75.8) | .94 | |
| Colesterolul total, mg/dL | 223.5 (194.0-262.3) | 217,5 (194,5-277,5) | .76 | |
| LDL-C, mg/dL | 162,6 (133.0-195,8) | 153,9 (13,1-209,3) | .71 | |
| HDL-C, mg/dL | 49.0 (42,8-55,0) | 48,5 (41,5-56,0) | .96 | |
| TG, mg/dL | 62,0 (49.0-80,3) | 66,0 (42,1-82,3) | .90 | |
| Non-HDL-C, mg/dL | 174.0 (145,8-210,9) | 167,0 (146,5-225,3) | .74 | |
| Lp (a), mg/dL | 18,80 (7,00-48,50) | 13,45 (9,10-28,10) | .46 | |
| Gestionat în cadrul asistenței medicale primare | 40 (22,9%) | 7 (46,7%) | .06 |
ASCVD, boală cardiovasculară aterosclerotică; IMC, indice de masă corporală; FH, hipercolesterolemie familială; HDL-C, colesterol lipoproteic de înaltă densitate; LDL-C, colesterol lipoproteic de joasă densitate; Lp (a), lipoproteină (a); IQR, interval interquartil; TG, trigliceride.
Concentrațiile de lipide și lipoproteine plasmatice (cohortă)
| Cohorta la intrare | Cohorta la urmărire-.up | P | |
|---|---|---|---|
| Colesterolul total, mg/dL | 221.0 (194.0-260.2) | 203.0 (183.0-233.5) | .001 |
| LDL-C, mg/dL | 157,7 (132,8-194,5) | 138,0 (116,5-165.4) | .001 |
| HDL-C, mg/dL | 49,0 (43,0-55,0) | 50,0 (44,0-58.0) | .002 |
| TG, mg/dL | 62.0 (49.0-80.2) | 70.0 (54.5-91.0) | .004 |
| Non-HDL-C, mg/dL | 171,0 (145,8-209,2) | 154.0 (132,0-182,5) | .001 |
HDL-C, colesterol al lipoproteinelor cu densitate mare; LDL-C, colesterol al lipoproteinelor cu densitate mică; TG, trigliceride.
Valorile sunt mediane (interval interquartil).
Mutații funcționale
Am identificat 212 pacienți cu o mutație în genele receptorilor LDL-C (97,7%) și 5 pacienți cu o mutație în genele apolipoproteinei B (2,3%). Dintre mutațiile în genele receptorilor LDL-C, 95 (43,8%) au fost clasificate ca mutații nule, 92 (42,4%) ca mutații defectuoase și 25 (11,5%) ca mutații cu funcționalitate necunoscută.
Terapie de scădere a lipidelor și atingerea obiectivelor
Tabelul 3 prezintă utilizarea diferitelor regimuri de LLT la intrare și la urmărire. Rezultatele arată o creștere semnificativă a utilizării de statine (44,2% la intrare și 68,2% la urmărire), ezetimibe (8,7% la intrare și 15,2% la urmărire), doza maximă de statine (3,3% la intrare și 13,9% la urmărire) și LLT maximă (7,9% la intrare și 23,6% la urmărire). Cea mai des prescrisă statină la intrare (25,3%) și la urmărire (30.5%) a fost atorvastatina. Prescrierea de rosuvastatină a crescut (de la 6,0% la includere la 20,3% la urmărire). Durata mediană a tratamentului cu statine a fost de 7,0 ani (de la 5,0 la 9,0 ani). Vârsta la menarhă a fost de 12,0 ani (de la 12,0 la 13,0 ani) pentru fetele tratate cu statine și de 12,0 ani (de la 11,0 la 13,0 ani) pentru fetele care nu au fost tratate cu statine (P = 0,77). Nu a fost observată nicio creștere a transaminazelor hepatice sau a creatinfosfokinazei. Fibrații și sechestratorii de acizi biliari au fost utilizați doar la 15 pacienți la includere (7,0%) și la 3 pacienți la urmărire (1,5%). Monoterapia cu ezetimibe fără o statină a fost utilizată la 18 pacienți la includere (8,3%) și la 24 de pacienți la urmărire (11,1%). În ceea ce privește aderența la tratament, 10 pacienți (4,6%) au raportat că nu au luat medicamentele cel puțin 1 zi în fiecare lună în timpul urmăririi. La analiza multivariabilă, nicio variabilă nu a fost asociată independent cu utilizarea de statine.
Terapii de scădere a lipidelor și atingerea obiectivului de LDL-C (cohortă)
| La intrare/la urmărire-up- | La intrarea-/follow-up+ | La intrarea-+/follow-up- | La intrarea-+/follow-up+ | P | |
|---|---|---|---|---|---|
| Pacienți pe statine | 60 (27.6%) | 61 (28,1%) | 9 (4,1%) | 87 (40,1%) | .001 |
| Pacienți cu doza maximă de statine | 186 (85.7%) | 24 (11,1%) | 1 (0,5%) | 6 (2,8%) | .001 |
| Pacienți pe ezetimibe | 177 (81,6%) | 21 (9.7%) | 7 (3,2%) | 12 (5,5%) | .013 |
| Pacienți pe terapie combinată maximă | 211 (97,2%) | 6 (2,8%) | 0 (0.0%) | 0 (0,0%) | N/A |
| Pacienți sub LLT maxim | 163 (75,1%) | 37 (17,1%) | 3 (1,4%) | 14 (6,5%) | .001 |
| LDL-C | 111 (51,2%) | 62 (28,6%) | 16 (7.4%) | 28 (12,9%) | .001 |
| LDL-C | 44 (20,3%) | 64 (29.5%) | 19 (8,8%) | 90 (41,5%) | .001 |
LDLCD-C, colesterol lipoproteic cu densitate scăzută; LLT, terapie de scădere a lipidelor.
Valorile sunt n (%). – = nu este prezent; + = prezent.
Vezi textul pentru clasificarea LLT.
Concentrația plasmatică a LDL-C a scăzut în medie cu 12,5%, atingând o valoare mediană de 138,0mg/dL la urmărire. Obiectivele de colesterol al lipoproteinelor cu densitate scăzută, așa cum sunt definite de recomandările internaționale recente privind FH, au fost atinse la 20,3% la intrare și la 41,5% la urmărire (tabelul 3 și figura 2). Atunci când s-a luat în considerare un obiectiv alternativ de LDL-C
mg/dL pentru pacienții cu vârsta mai mică de 14 ani, 8 din 48 de pacienți (16,7%) și 1 din 6 pacienți (16,7%) au atins obiectivul la includere și, respectiv, la urmărire. Singura variabilă asociată independent cu atingerea obiectivului de LDL-C în analiza multivariabilă a fost utilizarea de statine (odds ratio, 13,83; interval de încredere de 95%, 2,98-64,15). Tipul furnizorului de asistență medicală (medic specialist sau medic primar), vârsta, sexul, nivelul lipoproteinei (a) și tipul de mutație nu au fost asociate cu atingerea obiectivului LDL-C.
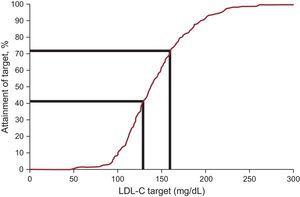
Obiectivele de tratament la pacienții cu hipercolesterolemie familială mai tineri de 18 ani: proporția de pacienți care au atins ținta de LDL-C. LDL-C, colesterol lipoproteic cu densitate scăzută.
DISCUȚII
În acest studiu, raportăm caracteristicile, utilizarea LLT și atingerea obiectivului de LDL-C într-o cohortă longitudinală de pacienți cu FH definită molecular mai tineri de 18 ani înrolați în registrul SAFEHEART. Acest registru unic de pacienți cu FH se bazează pe date obținute din viața reală din Spania, atât în contexte de asistență medicală specializată, cât și primară. Rezultatele noastre arată că o țintă de tratament LDL-C
mg/dL a fost atinsă de doar 20,3% dintre pacienți la includere și la 41,5% la urmărire, cu 68,2% dintre pacienți pe LLT. Utilizarea de statine a fost singurul factor asociat în mod independent cu atingerea obiectivului de LDL-C. Din cunoștințele noastre, nicio altă lucrare nu a arătat atingerea obiectivului la pacienții cu FH mai tineri de 18 ani, iar acest studiu este primul care raportează acest lucru la o populație mare.
Recent, un registru din Regatul Unit15 a analizat 207 copii cu FH, identificând mutații la 64% dintre copii și constatând că 48% dintre aceștia erau pe LLT; s-a obținut o reducere de 35% a LDL-C. Cu toate acestea, autorii nu au raportat rezultate privind atingerea obiectivelor. Un alt raport, care a analizat un eșantion mic de subiecți (n = 89), a arătat o reducere de 43% a LDL-C la urmărirea pe termen lung.16 Această reducere mai mare se datorează probabil unei utilizări mai frecvente a terapiei combinate (56%). Nu au fost prezentate rezultate privind atingerea obiectivelor. Într-un alt articol retrospectiv de 207 pacienți din Olanda, doar 26% dintre pacienți au urmat LLT și, din nou, nu au fost raportate rezultate privind atingerea obiectivului LDL-C.17
Acest studiu longitudinal a arătat că nivelurile LDL-C la pacienții cu FH mai tineri de 18 ani se pot schimba în timp datorită modificării LLT și educației medicului. Proporția de pacienți care au luat statine, doza maximă de statine și LLT maximă au crescut semnificativ în timpul urmăririi. În mod interesant, datele noastre indică faptul că cohorta noastră nu este părtinitoare, deoarece nu au existat diferențe semnificative din punct de vedere statistic între pacienții care nu au fost urmăriți și cohorta.
Diagnosticul și managementul precoce al FH este esențial, în special la copii și adolescenți, pentru a preveni dezvoltarea ASCVD la vârsta adultă. Screeningul pentru FH la copii merită și trebuie efectuat înainte de vârsta de 8 ani, deoarece copiii cu hipercolesterolemie prezintă un risc crescut de ASCVD prematur. Mai mult decât atât, screeningul îi poate identifica pe cei cu cel mai mare risc și poate determina inițierea promptă a LLT, care s-a dovedit a inversa în mod eficient procesul aterosclerotic și a reduce riscul ASCVD. Copiii cu FH nu prezintă, de obicei, ASCVD clinic. Cu toate acestea, existența unui risc viitor susține utilizarea LLT, statinele fiind piatra de temelie a managementului FH.18
Siguranța și tolerabilitatea LLT în FH pediatrică sunt întotdeauna controversate, deși se raportează că acestea sunt similare cu cele de la adulți.5,19,20 Recent, Ramaswami et al.15 nu au raportat probleme de siguranță, similare cu rezultatele noastre. Cu toate acestea, se recomandă o supraveghere strictă, în special la acei pacienți care primesc doze mai mari de statine. De asemenea, adolescentele trebuie sfătuite să suspende tratamentul cu statine atunci când se gândesc la sarcină. Cu toate acestea, deși sunt necesare mai multe date privind aspectele de siguranță pentru copiii aflați sub tratament pe termen lung cu LLT, lucrări recente de urmărire pe termen lung au arătat un profil de siguranță excelent.21 Această constatare este susținută indirect de datele noastre, deoarece o proporție mare de pacienți au inițiat LLT în timpul urmăririi și au existat puține abandonuri. Rezultatele noastre arată în mod clar un procent crescut de pacienți care utilizează statine, o doză mare de statine și LLT maxim, cu o proporție scăzută de pacienți care au abandonat medicația. Aceste date confirmă siguranța, aderența și tolerabilitatea statinelor, chiar și atunci când sunt utilizate la o doză mare, la pacienții cu FH mai tineri de 18 ani.22 În plus, rezultatele noastre sunt în concordanță cu rapoartele anterioare care nu arată efecte asupra maturizării sexuale.23 Toate aceste rezultate reafirmă conceptul „cu cât mai tânăr, cu atât mai bine” în ceea ce privește vârsta ideală pentru inițierea tratamentului cu statine la acești pacienți tineri cu FH.23
Rezultatele noastre arată un număr mare de pacienți cu FH mai tineri de 18 ani și, în concordanță cu studiile anterioare,15,16 sugerează disponibilitatea pacienților adulți cu FH de a include membrii apropiați ai familiei lor în activitățile de screening și registru. Acest fapt reflectă seriozitatea cu care acești pacienți își iau problema și impactul pe care sfaturile medicilor lor îl pot avea asupra schimbării stilului lor de viață. O astfel de atitudine la pacienții adulți constituie baza unui stil de viață sănătos la rudele lor.24
Deși obiectivul cel mai frecvent pentru pacienții cu FH mai tineri de 18 ani este un nivel al LDL-C sub 130mg/dL, o abordare alternativă constând în LDL-C mg/dL poate fi utilizată la acei pacienți mai tineri de 14 ani, nefumători, cu HDL-C ≥ 40mg/dL, lipoproteine (a) mg/dL, LDL-C mg/dL și fără boli cardiovasculare premature la progenitori sau bunici.6 Alte ghiduri recente recomandă o reducere cu 50% a LDL-C față de nivelurile de dinaintea tratamentului, dar, pentru acei copii cu vârsta ≥ 10 ani, mai ales dacă există factori de risc cardiovascular suplimentari, inclusiv lipoproteina (a) crescută, ținta LDL-C ar trebui să fie de mg/dL.11 Rezultatele noastre arată, de asemenea, dificultatea cu care se confruntă acești pacienți de a atinge țintele lipidice.25 Mai mult, atingerea țintelor de LDL-C a fost similară indiferent dacă pacienții au fost tratați de medici specialiști sau de medici primari. Astfel, este posibil să se atingă un nivel de îngrijire a pacienților pediatrici cu HF în cadrul asistenței medicale primare care este comparabil cu cel obținut prin asistență de specialitate. Pentru acest obiectiv, este important să se sublinieze sprijinul pe care îl primesc medicii prin intermediul registrelor și al programelor de formare dedicate. Registrele pot optimiza managementul pacienților cu FH mai tineri de 18 ani, permițând integrarea îngrijirii primare și a celei de specialitate și pot sprijini, de asemenea, autoritățile din domeniul sănătății în procesul de luare a deciziilor.8,26
Limitări și puncte forte
În acest studiu amplu de urmărire a pacienților cu FH mai tineri de 18 ani, intervenția a rămas neschimbată față de cea oferită de medicul pacientului. Lipsa unui profil lipidic de bază fiabil în acest registru se datorează faptului că unii pacienți primeau deja tratament în momentul înrolării. În plus, constatările ar fi putut fi alterate de mai multe condiții, cum ar fi diferite stiluri de viață și o asociere cu diferiți factori de risc cardiovascular care ar fi putut modifica rezultatele.
CONCLUZII
Datele din registrul SFEHEART arată că o proporție mare de pacienți cu FH mai tineri de 18 ani au niveluri ridicate de LDL-C și nu reușesc să atingă țintele recomandate de LDL-C. Am constatat o creștere a intensității LLT și o scădere semnificativă a nivelurilor LDL-C în timpul urmăririi. Utilizarea de statine a fost singurul predictor independent al atingerii obiectivului LDL-C. În plus, nu au fost detectate probleme de siguranță în timpul urmăririi. Aceste rezultate indică faptul că mulți pacienți cu FH nu sunt controlați în mod adecvat și că există încă loc pentru îmbunătățirea tratamentului. În plus, urmărirea acestei populații de FH poate contribui la cunoștințele privind siguranța LLT pe tot parcursul vieții și vârsta optimă de inițiere a tratamentului pentru a preveni dezvoltarea ASCVD la vârsta adultă.
FINANȚARE
Această lucrare a fost susținută de grantul G03/181 de la Fundación Hipercolesterolemia Familiar, FIS PI12/01289 de la Instituto de Salud Carlos III și grantul 08-2008 de la Centro Nacional de Investigación Cardiovascular.
CONFLICTE DE INTERES
Nici unul declarat.
- –
Copiii cu hipercolesterolemie familială heterozigotă netratată prezintă un risc crescut de apariție prematură a ASCVD după vârsta de 20 de ani.
- –
Statinele și alte terapii hipolipemiante scad eficient LDL-C și sunt sigure la copii și adolescenți.
- –
Se cunosc puține informații despre caracteristicile pacienților cu FH mai tineri de 18 ani, despre terapiile hipolipemiante utilizate la acești pacienți și despre obiectivele lipidice atinse în viața reală.
- –
Acest deficit de informații este și mai mare pentru datele de urmărire.
Ce adaugă acest studiu?
- –
O proporție mare de pacienți cu FH mai tineri de 18 ani nu reușesc să atingă țintele recomandate pentru LDL-C.
- –
Am constatat o creștere a intensității LLT și o scădere semnificativă a nivelului LDL-C în timpul urmăririi.
- –
Utilizarea de statină a fost singurul predictor independent al atingerii obiectivului LDL-C și nu au fost detectate probleme de siguranță în timpul urmăririi.
- –
Aceste rezultate întăresc conceptul „cu cât mai tânăr, cu atât mai bine”.
.