Ce este o ANOMALIE A ARTERIEI CORONARE CONGENITALE?
Există o dezbatere continuă cu privire la ceea ce ar trebui să fie considerat normal și ceea ce ar trebui să fie considerat o anomalie a arterei coronare (CAA). Conform lui Angelini1, CAA sunt diagnosticate prin excludere, ceea ce înseamnă că, în acele cazuri în care morfologia arterei coronare nu este normală, definirea normalității în funcție de un criteriu statistic (interval cuprins între plus sau minus 2 deviații standard ale valorii medii). Astfel, un CAA ar fi acea morfologie coronariană observată la mai puțin de unu la sută din populația generală.1,2 CAA pot fi produse în timpul cardiogenezei normale sau patologice: în primul caz, ar rezulta CAA izolate, asupra cărora ne concentrăm în acest articol, în timp ce, în cel de-al doilea caz, ele ar fi asociate cu alte malformații cardiace.
CLASIFICAREA
Există mai multe clasificări.1-3 Una nouă, care încearcă să standardizeze criteriile de diagnostic și grupează CAA în funcție de 7 categorii, a fost propusă recent4 (tabelul 1).


Grupuri internaționale solicită registre care să includă cel puțin acele anomalii care cauzează majoritatea evenimentelor clinice (moarte subită și ischemie miocardică) atribuite CAA,5-7 constituite de cele care își au originea în sinusul de Valsalva contralateral sau „greșit”. Din acest grup fac parte arterele coronare cu un singur vas („hiperdominanță” în clasificarea lui Rigatelli et al4), deoarece acestea trebuie să alimenteze cu sânge miocardul care provine dintr-un singur ostium coronarian și stabilesc trasee care, ocazional, sunt similare cu cele ale CAA cu originea în sinusul greșit de Valsalva (figura 1).

Figură 1. Arteriografie coronariană în proiecție oblică anterioară stângă care arată o arteră coronară dreaptă cu un singur vas.
INCIDENȚA
Diferitele definiții sau clasificări și analiza atât a seriilor angiografice8,9 cât și a seriilor de autopsii10 și, în ultimii ani, a seriilor ecocardiografice11 au ca rezultat o incidență raportată a CAA care variază între 0,1% și 8,4%,1,8,11 ceea ce face dificilă stabilirea magnitudinii exacte a problemei pe care o reprezintă. În general, incidența poate fi destul de asemănătoare cu cea a altor boli pe care am reușit să le definim mai precis, cum ar fi
cum ar fi cardiomiopatia hipertrofică (0,2%)12 sau sindromul Wolff-Parkinson-White (0,1% până la 0,3%).13
Incidența arterelor coronare anormale cu originea în sinusul greșit și a arterelor coronare cu un singur vas în studiile coronarografice variază între 0,1 și 0,5 %.28% și 1,74%.2,3,8,8,9,14-16 Având în vedere importanța lor clinică, ne vom concentra recenzia noastră asupra acestor anomalii.
PREZENTĂRI CLINICE
Început, aceste anomalii erau diagnosticate în timpul angiografiei coronariene efectuate la pacienții cu boală valvulară sau cardiopatie ischemică și erau considerate a nu avea semnificație clinică. Ulterior, au început să fie raportate cazuri de moarte subită la sportivi tineri la care singurul semn de boală era o anomalie cu originea în arterele coronare.8,17
Spectrul clinic la prezentare este variabil: în timp ce unii pacienți sunt asimptomatici, alții prezintă angină pectorală, dispnee, sincopă, infarct miocardic acut, insuficiență cardiacă și moarte subită.1,2,5,8,17-20 În mod curent, CAA sunt considerate a fi a doua cea mai frecventă cauză de moarte subită la sportivii din Statele Unite.21
Înseamnă acest lucru că toate CAA ar trebui considerate ca indicând un risc ridicat? Categoric nu, dar, din punct de vedere strategic, ar trebui să fie considerate „potențial maligne” până când se efectuează teste suplimentare pentru a exclude ischemia miocardică provocată de anomalie.
Preocuparea majoră constă în a determina ce CAA pot prezenta moarte subită. Astăzi, știm că cele care urmează un traseu interarterial (sau intramural), cele în care artera coronariană anormală este cea dominantă și cele care produc semne clinice la pacienți cu vârsta mai mică de 30 sau 35 de ani sunt cele în care incidența morții subite este cea mai mare.22-26
Din acest motiv, abordarea noastră față de un CAA ar trebui să difere în funcție de vârsta pacientului. La persoanele tinere, sub 35 de ani, ne vom „concentra” pe prevenirea morții subite, în timp ce la cele cu vârsta de peste 35 de ani, obiectivul major va fi tratarea ischemiei miocardice (figura 2).
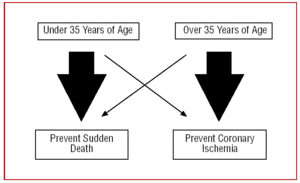
Figura 2. Abordare diferită în funcție de vârsta pacientului.
Ocazional, din cauza originii lor și a cursului anomal, CAA pot fi deteriorate în timpul intervenției chirurgicale pentru înlocuirea valvei, dar acest lucru poate apărea și în timpul închiderii percutanate a foramenului oval. Din acest motiv, prezența CAA trebuie exclusă înainte de intervenții de acest tip.27-30
PATHOPHYSIOLOGY OF ISCHEMIA IN CORONARY ANOMALIES
Există o serie de teorii31 pentru a explica mecanismele care produc ischemia în CAA, dar niciuna dintre ele nu a fost clar demonstrată. Într-una dintre ele, cauza este considerată a fi angulația marcată a arterei anomale în locul în care aceasta iese din aortă. Spre deosebire de o arteră coronară normală, care este perpendiculară pe aortă la originea sa, artera coronară anormală trebuie să se aplece asupra ei însăși pentru a ajunge, dinspre sinusul opus de Valsalva, la teritoriul său normal de alimentare. Din această cauză, ostium-ul arterei coronare anormale ar fi mai mic, cu crestături asemănătoare unei valve, în comparație cu ostium-ul circular normal, și ar putea deveni comprimat în cazul unei expansiuni accentuate a aortei, cum ar fi cea observată în timpul exercițiilor fizice intense.32
O altă teorie se referă la traseul inițial al CAA. Atunci când acesta este interarterial, între aortă și artera pulmonară, creșterea presiunii în cele 2 vase, apărută în timpul efortului, ar produce o compresie a arterei coronare anormale.33 Mai mult, dacă traseul inițial este intramural, obstrucția poate fi potențată, deoarece artera coronară se poate deforma în interiorul peretelui aortic în perioadele de hipertensiune arterială.34
Câțiva autori consideră că mecanismul care duce laischemie implică producerea unui spasm în artera coronară anormală ca urmare a leziunilor endoteliale produse de calea anormală,35 iar alții, că s-ar produce o invaginație a porțiunii proximale a CAA în peretele aortic.31
În cele din urmă, toate mecanismele discutate pot produce ischemie acută sau cronică (evenimente ischemice minore) care provoacă fibroză miocardică ce, la rândul ei, ar putea fi cauza generării de aritmii letale.36
CUM ESTE DIAGNOSTICATĂ O ANOMALIE CORONARĂ?
Diagnosticul necesită un indice de suspiciune ridicat și evaluarea prezenței acesteia în anumite circumstanțe. Așa cum am menționat mai sus, cele mai multe AAC sunt descoperite întâmplător în timpul coronarografiilor efectuate la pacienții cu cardiopatie ischemică sau boală valvulară supuși acestui studiu înainte de intervenția chirurgicală de înlocuire valvulară.
Tânărul care nu prezintă factori de risc coronarian sau boală valvulară asociată reprezintă cea mai mare provocare diagnostică. Ar trebui să suspectăm o AAC în prezența sincopei de efort, a dispneei sau a durerii toracice indicative de angină pectorală.24,26,35 Evident, primul test de diagnostic pe care îl efectuăm cu toții este ergometria standard. Cu toate acestea, aceasta nu s-a dovedit a fi foarte utilă la acest tip de pacienți, deoarece este de obicei negativă, fapt care indică faptul că ischemia datorată CAA nu se prezintă decât ocazional.35,36
Atunci, având în vedere că testele „funcționale” nu sunt de mare ajutor, trebuie să optăm pentru un studiu imagistic care ne permite să examinăm anatomia coronariană. Testul neinvaziv recomandat inițial este ecocardiografia transtoracică (ETT).7,26,37-40 La majoritatea acestor pacienți, efectuarea unui ETT simplu în proiecție parasternală pe axul scurt, în planul rădăcinii aortice, permite să se distingă cele două ostii coronariene și chiar să se determine traseul inițial al CAA. Pellicia et al. au studiat 1360 de sportivi de elită prin ecocardiografie, vizualizând ostiumul și porțiunea proximală a arterei coronare principale stângi în 97% din cazuri și artera coronară principală dreaptă în 80%.41
Recent, Frommelt et al34 au efectuat ecocardiografie la toți copiii și adolescenții (interval de vârstă, de la 3 luni la 20 de ani) trimiși la spitalul lor (1997-2002) cu simptome de ischemie miocardică, suspiciune de boală cardiacă congenitală sau dureri musculo-scheletice. Toți au fost supuși unui TTE convențional cu ajutorul cartografiei Doppler color a fluxului pentru a determina direcția fluxului sanguin. Aceștia au identificat 10 pacienți cu originea anormală a unei artere coronare în sinusul greșit (6 pacienți cu artera coronară stângă cu originea în sinusul drept de Valsalva și 4 cu artera coronară dreaptă cu originea în sinusul stâng de Valsalva). Folosind TET cu tehnici Doppler color, au observat un traseu intramural în interiorul peretelui aortic la nouă dintre pacienți și un traseu intramiocardic la celălalt pacient. Atunci când cursul unui CAA cu originea în sinusul greșit este intramural, acesta poate părea că iese din ostiumul său normal. Astfel, autorii recomandă utilizarea Doppler color pentru a determina direcția fluxului atunci când este necesar să se excludă prezența unei anomalii.
Îmbunătățirile tehnicilor de imagistică ecocardiografică ne permit să determinăm originea și să urmărim cursul inițial al unui CAA la anumite grupuri de pacienți. S-au efectuat studii la copii, adolescenți și sportivi de elită, dar încă nu au fost studiate serii mari care să implice populația adultă normală. Astfel, identificarea ostatiilor coronariene la pacienții tineri cu această simptomatologie trebuie efectuată sistematic în cadrul examenului TTE.7,26
La pacienții cu o fereastră ecocardiografică slabă sau atunci când persistă îndoiala diagnostică în ciuda indicațiilor clinice, pentru a permite vizualizarea originii și a traseului inițial al CAA, se poate efectua ecocardiografia transesofagiană (ETE),7,26,42,43 tomografia computerizată (CT)26,44-46–cu fascicul de electroni sau multislice–(figura 3) sau imagistica prin rezonanță magnetică cardiacă (IRMCC)26,47,48 (figura 4).

Figura 3. Imagine de tomografie computerizată multidetectoare care arată artera coronară circumflexă (Cx) care provine din artera coronară dreaptă (CD), urmând un traseu retroaortic pentru a ajunge în teritoriul său de distribuție normală. Ao indică aorta; AP, artera pulmonară. Prin amabilitatea Dr. Gabriel C. Fernández, Servicio de Radiología, Hospital Povisa, Vigo, Spania.
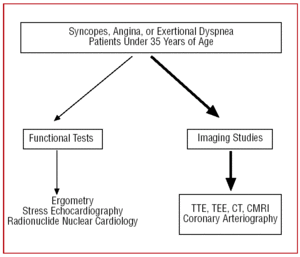
Figura 4. Protocol de diagnostic propus la pacienții cu vârsta sub 35 de ani cu suspiciune de anomalie coronariană. CMRI indică imagistica prin rezonanță magnetică cardiacă; CT, tomografie computerizată; ETE, ecocardiografie transesofagiană; ETT, ecocardiografie transtoracică.
Ce tehnică trebuie să folosim și în ce ordine? Fiecare echipă medicală trebuie să răspundă la această întrebare în funcție de tehnicile disponibile și de experiența sa. Ceea ce ar trebui să facem este să identificăm CAA și evoluția sa inițială prin intermediul tehnicii cel mai puțin invazive pe care o avem la dispoziție. Deși ETE a fost utilizată în diagnosticarea și identificarea evoluției inițiale a unor CAA, considerăm că, dată fiind natura sa semi-invazivă, ar trebui să fie utilizată numai după ce alte tehnici au eșuat. Astăzi, datorită disponibilității din ce în ce mai mari și a imaginilor tridimensionale excelente care pot fi obținute, ar părea prudent să se opteze pentru CT multidetector (figura 5) sau pentru CMRI.49,50 Arteriografia coronariană standard ar fi indicată dacă celelalte teste nu duc la un diagnostic definitiv. În acest sens, cea de-a 36-a Conferință Bethesda51 pentru selecția sportivilor de competiție cu anomalii cardiovasculare, publicată în aprilie 2005, a recomandat: „Anomaliile coronariene trebuie luate în considerare la sportivii cu sincopă de efort sau aritmie ventriculară simptomatică și trebuie investigate cu ajutorul unor studii adecvate, cum ar fi ecocardiografia, CMR sau imagistica prin tomografie computerizată ultrarapidă. Angiografia coronariană este indicată în cazul în care alte studii nu sunt diagnostice.” Pe scurt, nu se optează pentru 1 studiu diagnostic sau altul.
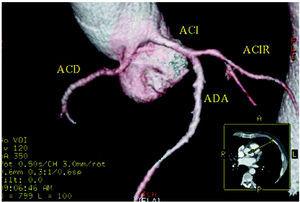
Figura 5. Tomografie computerizată multicelulară (16 felii); reconstrucție tridimensională redată care arată artera coronară dreaptă (ACD) cu originea în sinusul de Valsalva stâng. ACI indiactes artera coronară stângă; ACIR, artera coronară circumflexă; ADA, artera coronară descendentă anterioară. Prin amabilitatea Dr. Joaquín Alonso, Servicio de Cardiología y Servicio de Diagnóstico por Imagen, Hospital de Fuenlabrada, Madrid, Spania.
La pacienții cu vârsta de peste 35 de ani care prezintă semne clinice de angină pectorală sau sincope repetate, după testul funcțional (ergometrie, ecocardiografie de efort etc.), se efectuează de obicei un cateterism, deoarece incidența mai mare a aterosclerozei conduce la o suspiciune de boală coronariană. În anumite centre dotate cu această tehnologie, pacienții cu un tablou clinic atipic pot fi supuși unui screening inițial cu CT multidetector sau CRMI. În ambele circumstanțe, CAA ar fi o constatare (figura 6).
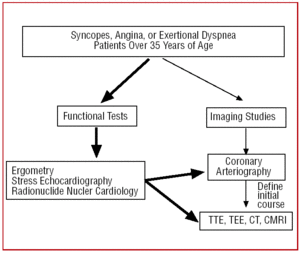
Figură 6. Protocol de diagnostic propus la pacienții de peste 35 de ani cu suspiciune de anomalie coronariană. CRM indică imagistica prin rezonanță magnetică cardiacă; CT, tomografie computerizată; ETE, ecocardiografie transesofagiană; ETT, ecocardiografie transtoracică.
CUM ESTE IDENTIFICAT CURSUL INIȚIAL AL UNEI ANOMALII CORONARE?
Acesta este unul dintre cele mai complexe puncte ale studiului CAA și constituie un aspect fundamental în identificarea riscului.
Pentru început, trebuie să ținem cont de faptul că denumirea și natura unei artere coronare sunt definite de teritoriul pe care îl alimentează, nu de originea lor. Astfel, o coronară care izvorăște din sinusul drept de Valsalva și se ramifică pentru a aproviziona teritoriile arterelor descendentă anterioară și circumflexă (Cx), nu este o arteră coronară dreaptă, ci o arteră coronară principală stângă cu originea în sinusul greșit. Atunci când o arteră coronară ia naștere din sinusul greșit, denumirea, natura și chiar funcția rămân aceleași; doar originea și traseul său inițial sunt anormale.2
După ce iese din sinusul greșit de Valsalva, o arteră coronară anormală poate ajunge în teritoriul său normal de alimentare prin cel puțin cinci căi diferite2,52:
1. Retrocardiac, în spatele valvelor mitrală și tricuspidă.
2. Retroaortică, urmată de obicei de Cx cu originea în sinusul drept de Valsalva sau în artera coronară dreaptă, adiacentă peretelui posterior al aortei, în șanțul dintre atriu și aortă (sinusul transvers) (figura 3).
3. Preaortic sau interarterial (între aortă și artera pulmonară), în care artera coronară dreaptă anormală, artera descendentă anterioară stângă sau artera coronară principală stângă traversează septul sau spațiul aortopulmonar. Acesta este traseul care a fost cel mai frecvent corelat cu semne de ischemie și/sau moarte subită (figurile 7 și 8).
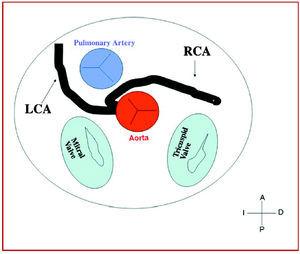
Figura 7. Diagramă care arată traseul interarterial al unei artere coronare drepte (ACR) cu originea în sinusul controlateral.
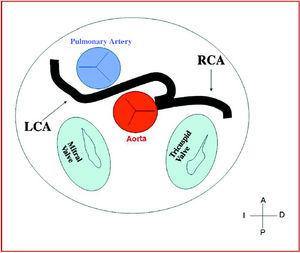
Figura 8. Diagramă care prezintă traseul interarterial al unei artere coronare stângi (ACL) cu originea în sinusul controlateral.
4. Intraseptal, prin porțiunea superioară a septului intraventricular. Este intramiocardică în majoritatea cazurilor și este recunoscută la angiografie datorită îngustării sistolice, asemănătoare unei punți miocardice, și pentru că de obicei există 1 sau 2 ramuri perforante septale în această zonă (figura 9).

Figura 9. Diagramă care arată traseul intraseptal al unei artere coronare stângi (IC) cu originea în sinusul drept de Valsalva.
5. Precardiac sau prepulmonar, caracterizat prin localizarea sa subepicardică, în peretele anterior al tractului de ieșire al ventriculului drept sau infundibulum. Acest pasaj este de obicei urmat de o anomalie a arterei coronare drepte, a arterei coronare principale stângi sau a arterei coronare descendente anterioare stângi.
Au fost raportate și alte trasee posibile sau chiar mai multe trasee la un anumit pacient.2
Cum pot fi identificate aceste trasee inițiale prin coronarografie? Inițial, s-a considerat că introducerea unui fir ghid în artera pulmonară urmată de coronarografie în proiecție laterală ar fi suficientă pentru a determina relația dintre anomalie și vasele mari. Cu toate acestea, această tehnică are o valoare limitată, deoarece, de exemplu, într-o vedere laterală, atât cursul septal, cât și cel interarterial ar părea să fie situate posterior față de artera pulmonară și anterior față de aortă, când, în realitate, cursul septal este situat caudal față de ambele vase.53
Au fost raportate, de asemenea, caracteristici coronarografice diferite pentru recunoașterea anomaliei și a cursului său inițial, chiar înainte de vizualizare. În acest sens, Page et al54 propun două semne care ne permit să recunoaștem o origine anormală a Cx și cursul său inițial:
1. Semnul „miocardului neperfuzat”. În timpul opacifierii selective a arterei coronare stângi, putem observa o zonă avasculară în zona posterolaterală a ventriculului stâng care indică originea anormală a Cx. Este necesar mai întâi să se injecteze un mediu de contrast în sinusul coronarian stâng pentru a exclude implicarea ostiilor independente de arterele descendentă anterioară și Cx. Cu toate acestea, dacă identificarea Cx nu este clară, trebuie să ne amintim că este mai frecventă observarea Cx cu originea în sinusul coronarian drept sau în artera coronară dreaptă decât prezența unor ostii separate în sinusul coronarian stâng. 55
2. Semnul „rădăcinii aortice”. În ventriculografie, proiecția oblică anterioară dreaptă arată conturul Cx-ului anomal și îi urmărește cursul pe măsură ce trece prin spatele sinusului coronarian drept (figura 10).
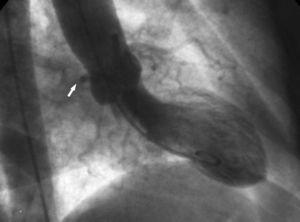
Figura 10. Ventriculografie în proiecție oblică anterioară dreaptă care arată conturul arterei circumflexe anomale (săgeată) care trece în spatele sinusului coronarian drept; acesta este cunoscut sub numele de semnul rădăcinii aortice sau semnul lui Page.
În 1985, Ishikawa et al,56 urmat de Serota et al în 1990,57 au propus o serie de criterii coronarigrafice menite să definească relația, de-a lungul cursului inițial, dintre vasul anomal și aorta și artera pulmonară (figura 11). Acești autori au încercat să identifice cursurile diferite pe baza orientării „buclei” formate de artera coronariană anomală cu restul arborelui coronarian56 sau prin aplicarea conceptului de „punct” (vizualizarea coloanei de contrast a CAA care, datorită întoarcerii pe care o face, adoptă morfologia unui punct57).
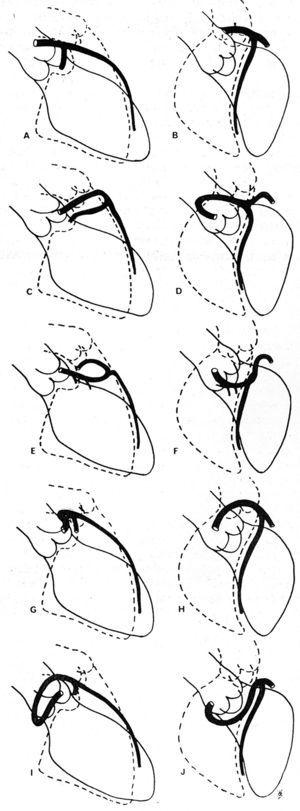
Figura 11. Ilustrații ale imaginilor coronarografice ale arterelor coronare descendentă anterioară stângă și circumflexă proximală în proiecție oblică anterioară dreaptă (A, C, E, G, I) și în proiecție oblică anterioară stângă (B, D, F, H, J), arătând diferitele trasee inițiale posibile ale unei artere coronare stângi cu originea în sinusul de Valsalva drept. A și B reprezintă o arteră coronară normală; C și D arată o „buclă” anterocraniană, descrisă în cursul anterior; E și F: „buclă” anterocaudală, curs septal; G și H: „buclă” posterocraniană, curs interarterial; I și J: „buclă” posterocaudală, curs retroaortic. Preluat din Ishikawa et al.56
În multe cazuri, identificarea cursului inițial al CAA cu ajutorul coronarografiei este dificilă, deoarece această tehnică oferă o vedere bidimensională a arborelui coronarian, care este o structură tridimensională complexă. Cardiologul intervenționist cu experiență în diagnosticul CAA, angiografia coronariană poate fi suficientă pentru identificarea corectă a cursului. Cu toate acestea, având în vedere incidența scăzută a acestora, majoritatea cardiologilor intervenționiști au o experiență limitată în studiul CAA. Astfel, în marea majoritate a cazurilor, acestea nu sunt descrise corect. Într-un registru recent la care au participat 13 spitale spaniole, cursul inițial al CAA raportat nu a fost identificat în majoritatea cazurilor.16
Atunci, în multe ocazii, identificarea cursului inițial al unui CAA cu originea în sinusul greșit necesită o tehnică imagistică suplimentară. Așa cum am menționat mai sus, atât ETT, cât și ETE pot fi utilizate în acest scop, dar, având în vedere disponibilitatea tot mai mare în spitalele noastre a tehnicilor neinvazive care oferă o definire mai corectă și mai exactă a anatomiei coronariene și a relației acesteia cu structurile adiacente la pacienții care pot fi candidați la intervenție chirurgicală, noi optăm pentru RMN sau CT multidetector.35,37,47,49
CARE ESTE CEA MAI BUNĂ ABORDARE TERAPEUTICĂ?
Acesta este unul dintre cele mai controversate aspecte ale acestei afecțiuni, deoarece nu au fost stabilite ghiduri oficiale în acest sens.
După ce CAA a fost diagnosticată și caracterizată, ar părea logic să se încerce să se determine dacă provoacă sau nu ischemie miocardică. Dacă pacientul a suferit un infarct miocardic (fără legătură demonstrabilă cu ateroscleroza) sau a fost resuscitat pentru moarte subită atribuită anomaliei și are sub 35 de ani, majoritatea autorilor recomandă revascularizarea.24,26,35
Un test de efort cu taliu sau o ecocardiografie sub stres medicamentos sau indus de efort care să demonstreze o ischemie reversibilă în teritoriul anomaliei va ajuta în procesul de luare a deciziei.36
Ce trebuie făcut în cazul persoanelor tinere, asimptomatice, la care CAA este descoperită întâmplător dacă sunt îndeplinite criteriile de risc, dar testul de efort nu produce nicio dovadă de ischemie? În primul rând, pacientul ar trebui să adopte un stil de viață sedentar.26,35
Corrado et al au comparat moartea subită la tineri sportivi și neatleți și doar cele atribuite CAA sau displaziei ventriculare drepte aritmogene au fost asociate cu efortul.58 În ceea ce privește tratamentul, revascularizarea este controversată, dar există autori care optează pentru această abordare deoarece, la acești pacienți, moartea subită este imprevizibilă și poate fi primul semn al CAA.24,26,34,35 Unii autori susțin vizitele anuale de control în aceste cazuri, cu ecocardiograme sau teste de efort cu taliu, și își bazează deciziile pe rezultate.7,36 După tratamentul chirurgical, pacienții se bucură de un stil de viață normal, inclusiv participarea la sport.25,34,49
La pacienții cu vârsta peste 35 de ani, deciziile trebuie luate individual. Riscul de moarte subită este mai scăzut, dar, deoarece CAA poate provoca ischemie miocardică simptomatică, în unele cazuri se realizează revascularizarea (figura 12).24,26
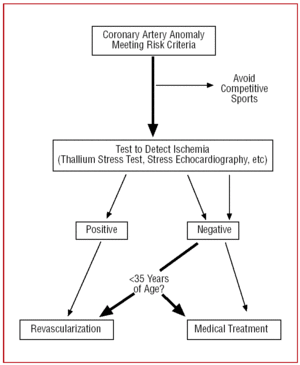
Figura 12. Protocol terapeutic propus pentru anomaliile coronariene cu originea în sinusul de Valsalva contralateral în prezența factorilor de risc.
Câteva grupuri investighează utilizarea anumitor protocoale de diagnostic (ecocardiografia intracoronariană pentru evaluarea ostiumului coronarian anomal în repaus și după infuzie de dobutamină sau suprasarcină lichidiană)59 sau utilizarea firelor de presiune intracoronariană pentru a detecta ischemia.60
După cum se poate observa, până la stabilirea unor ghiduri oficiale în această privință, cea mai rezonabilă abordare pare a fi, în primul rând, să se confirme dacă vârsta pacientului și anatomia CAA sunt asociate cu riscul și, în al doilea rând, să se verifice dacă ischemia coronariană (prezentată de pacient sau demonstrată) este clar provocată de anomalie.
CUM TREBUIE EFECTUATĂ REVASCULARIZAREA?
Logic, este necesar să se trateze fiecare caz în parte, în funcție de anatomia coronariană; astfel, revascularizarea poate fi chirurgicală sau percutanată.
Revascularizarea chirurgicală implică bypass-ul aortocoronarian, reimplantarea osială sau tehnica unroofing, care eliberează segmentul intramural al CAA prin intermediul unei incizii în peretele comun al CAA și aortei, creând astfel un nou orificiu, mai mare, în sinusul corespunzător.61,62 Există o mare controversă în ceea ce privește revascularizarea chirurgicală la acești pacienți, în special la tineri. Grefa de bypass aortocoronarian a fost puternic criticată7,63 din cauza permeabilității sale „limitate” și a fluxului competitiv inevitabil între bypass și CAA. Astfel, se adoptă din ce în ce mai des tehnica de desfundare, care ar părea mai fiziologică62.
Intervenția procutanată, cu implantarea de stenturi în regiunea de compresiune între vasele mari și în ostiumul anomal, a fost realizată în mai multe cazuri, la adulți, cu succes pe termen scurt64. Până în prezent, revascularizarea chirurgicală este preferată la pacienții tineri, iar intervenția percutanată este efectuată numai la adulți.26,62-64 Evident, în ambele cazuri, este necesară o urmărire pe termen lung.
Este tratamentul medical o opțiune?
Fără serii și studii controlate, este dificil de răspuns la această întrebare. Există rapoarte care implică urmărirea la 2 și 5 ani la pacienții care sau pacienții care au refuzat intervenția chirurgicală, la care abordarea a fost fie managementul expectativ, fie tratamentul cu beta-blocante, și în rândul cărora nu au existat cazuri de moarte subită.65-68 Cu toate acestea, unii autori argumentează împotriva deciziei de a iniția un tratament „pe viață” la copii și adolescenți.7
PROBLEME MAJORE NE REZOLVATE
Nu se cunoaște adevăratul risc de moarte subită asociat cu fiecare anomalie.5 Motivul este că riscul este calculat pe baza studiilor de autopsie, care nu indică riscul real ca o persoană să moară ca urmare a unei AAC, dar sugerează posibilitatea ca o persoană care a suferit o moarte subită să aibă o AAC.7 În plus, riscurile calculate pot fi supraestimate în raport cu populația generală, deoarece sunt obținute din serii de sportivi de competiție care, așa cum s-a raportat, au un risc de două ori mai mare de moarte subită decât o persoană sedentară.69 Știm că riscul de moarte subită ca urmare a unui CAA este mai mare la persoanele tinere; de fapt, se recomandă o abordare terapeutică sau alta în funcție de faptul că pacientul are mai puțin de 30 sau 35 de ani. Aceste puncte-limită se bazează pe puținele studii care se ocupă de acest subiect23,25 și, prin urmare, trebuie considerate doar orientative. Din acest motiv, abordarea terapeutică trebuie decisă întotdeauna în mod individual.
Dacă se adoptă soluția chirurgicală descrisă mai sus, trebuie să se țină cont de faptul că nu există serii în care evoluția pacienților să fi fost studiată mai mult de doi ani. La incertitudinea privind permeabilitatea by-pass-ului se adaugă posibilele leziuni ale valvei aortice pe care le poate produce procedura de desfundare. În acest sens, există raportări de insuficiență aortică sau chiar de înlocuire valvulară în urma acestei proceduri.7,70 Trebuie amintit faptul că intervenția chirurgicală cardiacă implică întotdeauna riscul unor complicații neurologice, a căror incidență la tineri a fost estimată la aproximativ 2,3%.71
În cele din urmă, ghidurile pentru selecția sportivilor de competiție cu anomalii cardiovasculare recomandă excluderea pacienților cu CAA din toate sporturile de competiție.51 Încă o dată, datele provenite de la o populație de sportivi au fost extrapolate la populația generală. La un adolescent, termenul „competitiv” poate fi dificil de definit. Mai mult, interzicerea unui adolescent sau tânăr adult de a participa la orele de gimnastică sau la sportul care îi poate plăcea poate provoca mai multe daune decât beneficii. Poate că ar trebui evitate sporturile extenuante, dar nu și un sport mai puțin solicitant.7
CONCLUZII
Arterele coronare care își au originea în sinusul de Valsalva greșit constituie grupul de AAC cel mai frecvent asociate cu ischemia miocardică și, în special, cu moartea subită.
Indexul de suspiciune al acestei anomalii trebuie să fie ridicat la pacienții tineri care prezintă semne clinice de angină pectorală, dispnee sau sincopă de efort. În aceste cazuri, ar trebui să se efectueze ETT în încercarea de a identifica ostia și traseul inițial al ambelor artere coronare.
Ar trebui să definim clar traseul inițial al fiecărei artere coronare anormale, folosind tehnici imagistice precum ETT, ETE sau, de preferință, CT multidetector sau CMRI, în funcție de caracteristicile spitalului nostru.
Trebuie să acordăm prioritate înființării de registre naționale și internaționale care să ne permită să determinăm incidența acestor anomalii, precum și ratele asociate de morbiditate și mortalitate, prognosticul, tratamentul, posibilele influențe genetice sau de mediu și, pe scurt, să învățăm cât mai multe despre acest lucru.
Este necesar să realizăm o urmărire pe termen lung a pacienților care au suferit o intervenție chirurgicală pentru CAA, în special a celor tineri. În orice caz, revascularizarea (chirurgicală sau percutanată) poate fi o soluție valabilă pentru pacienții cu acest tip de boală.
RECUNOȘTINȚE
Le mulțumim Dr. Joaquín Alonso și Dr. Gabriel C. Fernández pentru ajutorul acordat în obținerea imaginilor de tomografie computerizată multidetector.
.