Las señales intracelulares, como el daño al ADN de la célula, impulsan la apoptosis principalmente a través de la vía intrínseca. La vía intrínseca de la apoptosis, en la que intervienen proteínas de señalización conservadas, está físicamente asociada a las mitocondrias y, en los vertebrados, es sensible al estrés oxidativo mitocondrial. La vía está influenciada por miembros de la familia Bcl unidos a la membrana mitocondrial, incluidos los genes Bax y Bcl-2, que actúan como proteínas reguladoras pro o antiapoptóticas, respectivamente.
Resumen de la vía de la apoptosis intrínseca
La vía de la apoptosis intrínseca se inicia, por ejemplo, con quimioterapia y/o radioterapia. Se activa por una serie de estímulos exógenos y endógenos, como el daño al ADN, la isquemia y el estrés oxidativo. Además, desempeña una función importante en el desarrollo y en la eliminación de las células dañadas.
En la vía intrínseca, la consecuencia funcional de la señalización pro-apoptótica es la perturbación de la membrana mitocondrial y la liberación del citocromo c en el citoplasma, donde forma un complejo o apoptosoma con el factor activador de la proteasa apoptótica 1 (APAF1) y la forma inactiva de la caspasa-9. Este complejo hidroliza el adenosín trifosfato para escindir y activar la caspasa-9. A continuación, la caspasa-9 iniciadora escinde y activa las caspasas ejecutoras-3/6/7, lo que da lugar a la apoptosis celular. Es totalmente diferente de las señales extracelulares, que suelen ser generadas por las células citotóxicas del sistema inmunitario y desencadenan la apoptosis principalmente a través de la vía extrínseca.
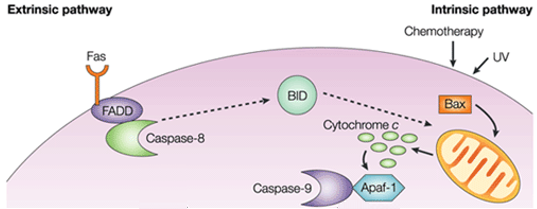
Figura 1. Diferencia entre la vía extrínseca y la vía intrínseca.
Proceso y regulación de la vía intrínseca de la apoptosis
La vía intrínseca de la apoptosis induce la apoptosis mediante la activación directa de la caspasa-3 o mediante la escisión de bid (agonista de la muerte del dominio de interacción BH3), lo que da lugar a la disfunción mitocondrial y a la posterior liberación de citocromo c y a la activación de las caspasas-9 y caspasas-3. La caspasa-3 promueve las características típicas de la apoptosis, incluyendo la fragmentación del ADN y la muerte celular en varios tejidos.
La familia de proteínas del linfoma de células B 2 (Bcl-2) controla estrechamente la activación de la vía intrínseca. Se encuentra en el linfoma folicular y se identificó por primera vez como uno de los genes implicados en la muerte celular al activar la apoptosis proapoptótica o inhibir la apoptosis antiapoptótica. Las proteínas de un subgrupo, que incluye a Bid, Bad, Bim, Bmf, Puma y Noxa, contienen un único dominio de homología 3 de Bcl-2 (proteínas sólo BH3) y tienen actividad proapoptótica. Otros dos subconjuntos de proteínas tienen múltiples dominios BH. El primer subconjunto, que incluye la proteína X asociada a Bcl-2 (Bax), el antagonista/asesino homólogo de Bcl-2 (Bak) y el regulador de la apoptosis de la familia Bcl-2 (Bok), es proapoptótico; el otro subconjunto, que incluye Bcl-2, Bcl-XL y Mcl-1, es antiapoptótico. La vía mitocondrial está parcialmente influenciada por los miembros de la familia Bcl unidos a la membrana mitocondrial, incluyendo tanto las proteínas reguladoras pro-apoptóticas Bax como las proteínas reguladoras anti-apoptóticas Bcl-2.
Las moléculas pro-apoptóticas causan la permeabilización de la membrana mitocondrial externa, lo que conduce al eflujo de citocromo c, que se une al adaptador Apaf-1 y al iniciador caspasa-9 en el citosol para formar el complejo apoptosoma. Esto estimula la caspasa-9, que a su vez activa las caspasas efectoras. La mitocondria también libera una proteína llamada Smac/DIABLO en el citosol. Smac/DIABLO promueve indirectamente la apoptosis al bloquear los efectos de un grupo de proteínas antiapoptóticas denominadas proteínas inhibidoras de la apoptosis (IAP).
Las proteínas antiapoptóticas Bcl-2 y Bcl-XL inhiben la liberación del citocromo c, mientras que Bax, Bak y Bid, todas ellas proteínas proapoptóticas, promueven su liberación desde la mitocondria. El citocromo c y la deoxiadenosina trifosfato (dATP) se unen a APAF-1 para formar un complejo multimérico que recluta y activa la pro-caspasa-9, una proteasa ejecutora mediadora de la apoptosis que a su vez activa la cascada de caspasas, dando lugar a la apoptosis celular. Durante este proceso, la caspasa-2, la caspasa-8, la caspasa-9 y la caspasa-10 participan en el inicio de la apoptosis. La caspasa-3, la caspasa-6 y la caspasa-7 participan en la apoptosis. La caspasa-3 y la caspasa-7 regulan la inhibición de la reparación del ADN e inician su degradación. Además, la caspasa-6 regula la desintegración de la lámina y el citoesqueleto.
Vía de la apoptosis intrínseca en la fisiopatología
La mayoría de las terapias quimioterapéuticas y dirigidas contra el cáncer matan a las células tumorales a través de la generación de una señalización pro-muerte que inicia la vía apoptótica intrínseca de la muerte celular programada. El punto de no retorno en la cascada apoptótica es la permeabilización de la membrana externa mitocondrial (MOMP); una vez que se ha producido, la permeabilización mitocondrial conduce a la formación de un apoptosoma, lo que facilita la activación de las caspasas y, posteriormente, desencadena las demás características de la muerte celular apoptótica. La decisión celular de iniciar la MOMP está controlada por un delicado equilibrio entre las moléculas pro y antiapoptóticas de la familia BCL-2.
Una de las razones de la resistencia a la quimioterapia es el fracaso de las células tumorales para entrar en apoptosis debido a defectos en la vía apoptótica intrínseca (por ejemplo, cambios en p53). A pesar de las importantes mejoras en el tratamiento, las tasas de curación de muchos cánceres siguen siendo inferiores a las óptimas. El auge de la quimioterapia citotóxica ha conducido a una terapia curativa para un subconjunto de cánceres, aunque la resistencia intrínseca al tratamiento es difícil de predecir para los pacientes individuales. La oleada de terapias molecularmente dirigidas se ha centrado en las mutaciones activadoras de fármacos y, por tanto, se limita a subconjuntos específicos de pacientes. La vía mitocondrial intrínseca de la apoptosis representa un objetivo prometedor para las nuevas terapias, y dirigirse con éxito a esta vía tiene el potencial de alterar el panorama terapéutico de una variedad de cánceres.